Влияние катализаторов на скорость реакции
Катализатор – это вещество, не расходующееся в процессе протекания реакции, но влияющее на ее скорость.
Явление изменения скорости реакции под действием таких веществ называется катализом. Обычно катализаторами называют вещества, увеличивающие скорость реакции, а ингибиторами – вещества, замедляющие протекание реакции. В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции.
Химическое равновесие
Среди множества химических реакций выделяют необратимые и обратимые реакции.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные продукты, называются необратимыми.
Условием необратимости химической реакции служит: выпадение осадка, выделение газа, образование малодиссоциируемого вещества и выделение большого количества энергии. В уравнениях необратимых реакций между левой и правой частями ставится знак равенства или стрелка.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций ставят две стрелки, направленные в противоположные стороны.
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. Химическое равновесие можно определить как состояние системы реагирующих веществ, при котором скорости прямой и обратной реакции равны между собой (υпр= υобр).
В состоянии равновесия прямая и обратная реакции не превращаются, поэтому такое равновесие называется подвижным или динамическим равновесием.
Концентрация реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными.
Химическое равновесие характеризуется константой равновесия (Кр) – отношением констант скоростей прямой и обратной. Например, для гомогенной системы СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г) константа равновесия запишется следующим образом: 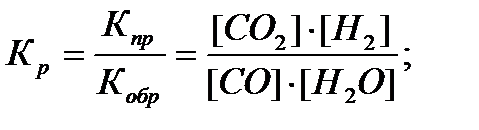
Приведённое математическое выражение называется законом действия масс для обратимой химической реакции.
Переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия. На смещение химического равновесия оказывают влияние концентрация реагирующих веществ, температура, а для газообразных веществ – и давление. Направление смещения химического равновесия под действием данных факторов определяется общим положением, известным под названием принципа подвижного равновесия или принципа Ле Шателье –Брауна:если на систему, находящуюся в равновесии, производится какое –либо внешнее воздействие, то оно благоприятствует протеканию той реакции, которая ослабляет воздействие.
Принцип Ле Шателье – Брауна на примере реакции взаимодействия хлороводорода с кислородом
4НСI (г) + О2 (г) ↔ 2СI2 (г) + 2Н2О (г), ∆Н0=116,4 кДж.
1) Увеличение концентрации реагирующих веществ будет смещать равновесие в сторону расхода этих веществ, т.е. вправо. Уменьшение концентрации реагирующих веществ – в сторону их образования, т.е. влево.
2) Поскольку прямая реакция экзотермическая, то повышение температуры будет способствовать протеканию процесса поглощения температуры, т.е. равновесие сместится влево. Поглощение температуры сместит равновесие в сторону прямой реакции.
3) Влияние давления на равновесие возможно только в газообразных системах, идущих с изменением количества молей газообразных веществ. Повышение давления приводит к смещению равновесия в сторону реакции, приводящей к меньшему количеству вещества, т.е. вправо. Уменьшение давления – влево.
Катализаторы не влияют на смещение химического равновесия в системе, т.к. в одинаковой степени изменяют скорость прямой и обратной реакции.
Вопросы для самоконтроля
1.Что называется скоростью химической реакции в гомогенной и гетерогенной системе. Какова размерность скорости химической реакции.
2. Сформулируйте основной закон химической кинетики – закон действующих масс.
3. Какие факторы влияют на скорость химической реакции? В чём заключается различие кинетики в гомогенных и гетерогенных химических реакциях?
4. Что такое энергия активации реакции?
5. В чём состоит различие между обратимыми и необратимыми химическими реакциями?
6.Что называется состоянием химического равновесия и почему оно называется динамическим?
7. Как формулируется правило Ле Шателье – Брауна?
8. Как влияют катализаторы на химическое равновесие системы?
9. Каковы основные представления теории активных столкновений?
10. Какие факторы влияют на химическое равновесие?
