Т е м а: Химическая кинетика
Индивидуальные
Задания по физической
И коллоидной химии
Практикум
Издание второе, исправленное
и дополненное
Саранск
Издательство Мордовского университета
УДК 541.1+541.18 (076.1)
ББК Г
И60
Авторы: Л. А. Живечкова, Э. В. Романова, Е. П. Коновалова, Н. П. Сыркина
Индивидуальные задания по физической и коллоидной химии: / Л.А. Живечкова, Е.П. Коновалова, Э.В. Романова, Н.П. Сыркина - Изд. 2-е, испр. и доп.– Саранск : Изд-во Мордов. ун-та, 2009. - 79 с.
Настоящие материалы содержат индивидуальные задания по физической и коллоидной химии и примеры решения задач, сгруппированные по основным модулям курса. Приводится список использованной литературы.
Предназначено для студентов нехимических специальностей.
Подписано в печать 30.07.09. Формат 60 ´ 841/16.
Усл. печ. л. 4,42. Тираж 300 экз. Заказ №1029
Издательство Мордовского университета
Типография Издательства Мордовского университета
430005 Саранск, ул. Советская, 24
ПРЕДИСЛОВИЕ
В настоящее время профессиональная деятельность медика и биолога требует глубоких знаний в области химии, овладения современными химическими и физико-химическими методами исследования. При этом особую роль приобретает изучение физической и коллоидной химии. Понимание физико-химических закономерностей функционирования живого организма послужит фундаментом для последующего изучения специальных дисциплин, таких, как биологическая химия, биотехнология, физиология, фармакология и др.
Цель настоящего практикума - оказать помощь студентам медицинских и биологических специальностей в самостоятельной работе при изучении физической и коллоидной химии, сформировать умение использовать теоретические знания в будущей практической и профессиональной деятельности.
Предлагаемые вопросы и задачи сгруппированы по основным темам данного курса и, насколько возможно, носят медико-биологический характер. В начале каждого раздела приведены примеры решения типовых задач. Для установления варианта к каждому разделу приводится таблица, в которой по горизонтали берут предпоследнюю цифру варианта, а по вертикали - последнюю. Поливариантность заданий предполагает строгую индивидуальность при выполнении студентами контрольных работ. В задачах, требующих решения, в скобках указаны ответы.
| Варианты индивидуальных заданий для контрольной работы по теме: “Химическая термодинамика” | Номера вопросов | Последняя цифра | 10, 26, 42, 74, 81 | 4, 21, 38, 55, 72 | 14, 31, 48, 49, 86 | 12, 27, 42, 57, 72 | 2, 19, 34, 66, 84 | 12, 29, 44, 61, 88 | 6, 24, 42, 60, 78 | 16, 18, 36, 54, 72 | 2, 32, 46, 60, 74 | 11, 28, 45, 60,75 | |
| 9, 25, 41, 57, 88 | 3, 20, 37, 61, 82 | 13, 30, 47, 64, 87 | 11, 26, 41, 56, 86 | 1, 18, 33, 50, 65 | 11, 28, 60, 73, 75 | 5, 23, 41, 59, 77 | 15, 17, 35, 81, 85 | 1, 31, 45, 59, 76 | 12, 29, 46, 61, 76 | ||||
| 8, 24, 40, 56, 72 | 2, 3, 19, 55, 70 | 12, 29, 46, 63, 80 | 10, 25, 40, 55, 70 | 2, 19, 34, 80, 83 | 10, 27, 42, 59, 74 | 4, 22, 40, 82, 76 | 14, 32, 34, 52, 84 | 16, 30, 44, 72, 82 | 13, 30, 47, 62, 77 | ||||
| 7, 23, 39, 55, 86 | 1, 18, 33, 35, 69 | 11, 28, 45, 62, 79 | 9, 24, 39, 54, 74 | 3, 18, 39, 64, 79 | 9, 14, 26, 41, 87 | 3, 21, 39, 57, 75 | 13, 31, 33, 51, 69 | 15, 29, 48, 57, 81 | 14, 31, 48, 71, 78 | ||||
| 6, 22, 38, 54, 87 | 16, 32, 48, 64, 80 | 10, 27, 44, 61, 78 | 8, 23, 38, 68, 79 | 2, 17, 48, 63, 78 | 8, 25, 40, 57, 72 | 2, 20, 38, 56, 74 | 12, 30, 50, 68, 88 | 14, 28, 42, 71, 86 | 8, 22, 36, 80, 84 | ||||
| 5, 21, 37, 69, 85 | 15, 31, 47, 63, 79 | 9, 26, 43, 60, 77 | 7, 22, 37, 67, 87 | 1, 32, 38, 62, 77 | 7, 24, 39, 56, 80 | 1, 19, 37, 55, 63 | 11, 29, 47, 67, 76 | 13, 27, 41, 55, 69 | 7, 21, 35, 79, 83 | ||||
| 4, 20, 36, 68, 84 | 30, 50, 58, 62, 78 | 8, 25, 42, 59, 76 | 6, 21, 36, 66, 85 | 16, 31, 46, 61, 76 | 6, 23, 38, 55, 70 | 16, 17, 48, 80, 81 | 10, 28, 46, 64, 78 | 12, 50, 40, 54, 80 | 6, 20, 34, 64, 78 | ||||
| 3, 19, 35, 67, 78 | 13, 29, 45, 61, 77 | 7, 24, 41, 75, 83 | 5, 20, 35, 61, 65 | 15, 30, 45, 60, 75 | 5, 22, 37, 54, 76 | 15, 32, 47, 64, 79 | 9, 27, 45, 57, 63 | 11, 25, 39, 67, 85 | 5, 19, 33, 51, 77 | ||||
| 2, 18, 34, 61, 66 | 12, 28, 44, 60, 76 | 6, 23, 40, 57, 74 | 16, 17, 34, 68, 84 | 14, 29, 44, 74, 82 | 4, 21, 36, 68, 85 | 10, 31, 46, 54, 78 | 8, 26, 62, 73, 80 | 10, 24, 38, 66, 87 | 4, 18, 48, 62, 76 | ||||
| 1, 17, 33, 49, 65 | 11, 23, 27, 59, 75 | 5, 22, 39, 56, 85 | 15, 32, 33, 50, 67 | 13, 28, 43, 55, 81 | 3, 20, 35, 67, 78 | 13, 30, 45, 62, 77 | 7, 25, 43, 61, 79 | 9, 23, 37, 61, 65 | 3, 17, 47, 61, 75 | ||||
| Пред- | послед-няя | цифра |
Т е м а: Химическая термодинамика
Примеры решения задач
Задача 1. Рассчитайте количество теплоты, выделившейся при аэробном окислении 18 г глюкозы, если ее стандартная энтальпия сгорания равна –2805 кДж/моль.
Решение
Процесс аэробного окисления глюкозы можно представить как процесс ее сгорания при постоянном давлении (р = 101,325 кПа)
С6Н12О6(т) + 6 О2(г) = 6 СО2(г) + 6 Н2О(ж), 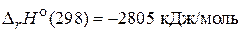 .
.
При сгорании 1 моль глюкозы, по условию задачи, выделяется 2805 кДж/моль теплоты. Молярная масса глюкозы 180 г/моль, поэтому 18 г глюкозы составляют 0,1 моль. Рассчитаем количество теплоты, выделившееся при сгорании 18 г глюкозы:
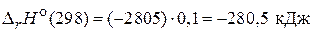 .
.
Задача 2. В растениях происходит гидролитическое расщепление мочевины на аммиак и оксид углерода (IV). Сравните 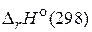 и
и 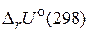 для реакции гидролиза мочевины (стандартные энтальпии образования (
для реакции гидролиза мочевины (стандартные энтальпии образования ( 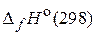 ) участников реакции приведены в таблице 1):
) участников реакции приведены в таблице 1):
Т а б л и ц а 1
| Вещество | 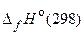 , кДж/моль , кДж/моль |
| CO(NH2)2 (т) | –333,20 |
| Н2О (ж) | –285,85 |
| СО2(г) | –393,50 |
| NН3(г) | –47,70 |
Какой физический смысл имеют величины 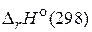 и
и 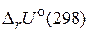 для химической реакции?
для химической реакции?
Решение
Запишем уравнение реакции гидролиза мочевины:
CO(NH2)2(т) + Н2О(ж) = СО2(г) + 2 NН3(г) .
Для расчета используем 1-е следствие из закона Гесса, согласно которому изменение энтальпии реакции равно разности сумм изменения энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов.
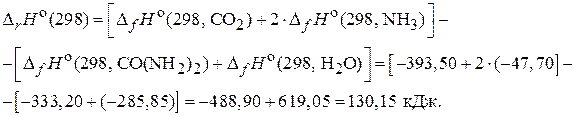
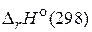 и
и 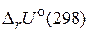 связаны между собой соотношением:
связаны между собой соотношением:
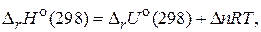
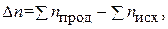
где n – число молей газообразных участников реакции.
Для данной реакции 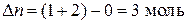 .
.
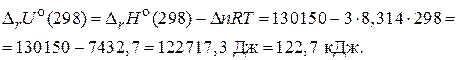
Величины 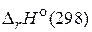 и
и 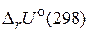 для химической реакции характеризуют тепловой эффект при P = const и V = const, соответственно. Cравнивая их можно заметить, что тепловой эффект реакции при постоянном давлении больше, чем при постоянном объеме. Поскольку
для химической реакции характеризуют тепловой эффект при P = const и V = const, соответственно. Cравнивая их можно заметить, что тепловой эффект реакции при постоянном давлении больше, чем при постоянном объеме. Поскольку 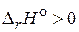 , реакция является эндотермической, т. е. идет с поглощением теплоты.
, реакция является эндотермической, т. е. идет с поглощением теплоты.
Задача 3. Рассчитайте энтальпию образования ацетона, если при сгорании 1 моль его выделяется 1785,73 кДж/моль теплоты, а стандартные энтальпии образования Н2О(ж) и СО2(г) соответственно равны –285,85 кДж/моль и –393,50 кДж/моль.
Решение
Энтальпия образования ацетона представляет собой тепловой эффект реакции образования 1 моль ацетона из простых веществ:
3С(т) + 3Н2(г) + 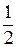 О2(г) ® СН3СОСН3(ж) (1)
О2(г) ® СН3СОСН3(ж) (1)
Составим термохимические уравнения для приведенных значений энтальпий:
СН3СОСН3(ж) + 4О2(г) = 3СО2(г) + 3Н2О(ж); 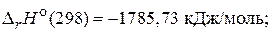 (2)
(2)
С(т) + О2(г) = СО2(г); 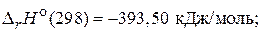 (3)
(3)
Н2(г) + 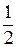 О2(г) = Н2О(ж);
О2(г) = Н2О(ж); 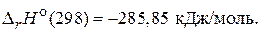 (4)
(4)
Из уравнений (3) и (4) можно заключить, что энтальпия образования СО2 и Н2О является энтальпией сгорания углерода и водорода.
На основании приведенных уравнений (2) - (4) можно сказать, что в задаче известны энтальпии сгорания всех участников реакции (1). Поэтому для расчета энтальпии образования ацетона применим 2-е следствие из закона Гесса, согласно которому изменение энтальпии реакции равно разности сумм энтальпий сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов:
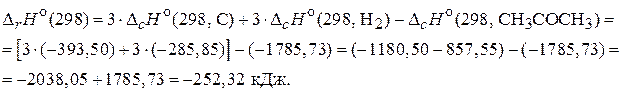
Значение 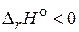 , следовательно, реакция экзотермическая.
, следовательно, реакция экзотермическая.
Задача 4. Рассчитайте 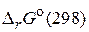 для реакции образования дипептида из глицина и определите направление самопроизвольного протекания процесса. Для расчета используйте данные, приведенные в таблице 2.
для реакции образования дипептида из глицина и определите направление самопроизвольного протекания процесса. Для расчета используйте данные, приведенные в таблице 2.
Т а б л и ц а 2
| Вещество | 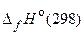 , кДж/моль , кДж/моль | 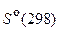 , Дж/(моль×К) , Дж/(моль×К) |
| глицин | –537,23 | 103,00 |
| глицилглицин | –746,01 | 189,95 |
| Н2О(ж) | –285,85 | 69,54 |
Решение
Запишем уравнение реакции:
Н2N— CH2—COOH + Н2N— CH2—COOH =
= Н2N— CH2—CO—НN— CH2—COOH + H2O.
Рассчитаем изменение энтальпии по 1-му следствию из закона Гесса:
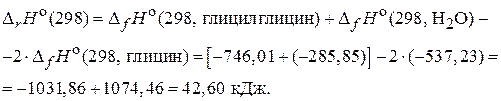
Изменение энтропии рассчитаем по формуле:
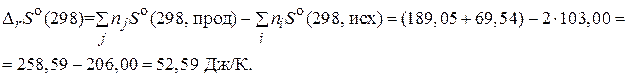 По уравнению Гиббса - Гельмгольца находим изменение
По уравнению Гиббса - Гельмгольца находим изменение 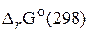 :
:
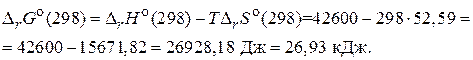
На основании значения 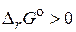 можно заключить, что данная реакция самопроизвольно протекать не может, т. е. предпочтительнее ее протекание в обратном направлении.
можно заключить, что данная реакция самопроизвольно протекать не может, т. е. предпочтительнее ее протекание в обратном направлении.
Вопросы и задания
1. Сформулируйте первый закон термодинамики. Дайте определение понятий "теплота", "работа", "внутренняя энергия системы", "энтальпия".
2. Что называется тепловым эффектом химической реакции и какие методы его определения вы знаете? Приведите примеры реакций, для которых: а) 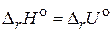 ; б)
; б) 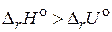 ; в)
; в) 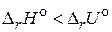 .
.
3. Можно ли рассматривать закон Гесса как следствие из первого закона термодинамики в приложении его к химическим процессам?
4. Что понимают под стандартной энтальпией образования и стандартной энтальпией сгорания веществ? Напишите уравнения реакций, поясняющих физический смысл стандартных энтальпий образования следующих веществ: H2O, CO2, C6H12O6.
5. Укажите какими тремя основными путями расходуется энергия, поглощаемая человеком в виде пищи.
6. Что понимают под стандартной энтальпией сгорания? Можно ли использовать эту величину для оценки энергетики окислительных процессов?
7. Приведите формулировки и математическую запись следствий из закона Гесса. В чем их практическое значение?
8. Что понимают под внутренней энергией и энтальпией системы? Покажите связь между 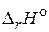 и
и 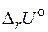 .
.
9. В каких условиях протекают следующие процессы: а) сгорание метана в закрытом стальном сосуде, который погружен в емкость с водой; б) окисление глюкозы в нашем организме; в) сгорание глюкозы на воздухе? К какому типу можно отнести каждую из этих систем?
10. Hапишите уравнение, выражающее связь между тепловым эффектом при постоянном давлении и тепловым эффектом при постоянном объеме.
11. Можно ли экспериментально определить и теоретически рассчитать абсолютные значения внутренней энергии и энтальпии системы?
12. Какие процессы называют экзергоническими и эндергоническими?
13. Зависит ли тепловой эффект химической реакции от числа стадий при изобарно-изотермических условиях проведения процесса?
14. В организме человека окисление этилового спирта протекает в две стадии:
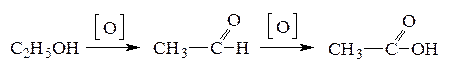
В ходе первой стадии выделяется 256 кДж/моль, а в ходе второй — 237 кДж/моль теплоты. Рассчитайте тепловой эффект процесса окисления этанола до уксусной кислоты. Какие выводы можно сделать о вреде потребления алкоголя, если учесть, что окисление уксусного альдегида в уксусную кислоту протекает во времени, а присутствие уксусного альдегида в крови вызывает затруднение дыхания, сбои пульса, тошноту, чувство жара в голове и груди? (–493 кДж/моль)
15. Можно ли экспериментально определить изменение внутренней энергии при сгорании глюкозы?
16. Какие системы называют открытыми, закрытыми, изолиро-ванными? К каким системам можно отнести живые организмы?
17. Для каких расчетов применяют "стандартную энергию Гиббса образования веществ" ( 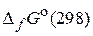 )?
)?
18. Почему термодинамика рассматривает не абсолютные значения внутренней энергии, а только ее изменение?
19. Почему для конденсированных систем разница между энтальпией и внутренней энергии мала, а для газообразных систем значительна?
20. Какие термодинамические функции применяют для определения направления самопроизвольного протекания процессов в открытых и закрытых системах?
21. Для каких расчетов используют термодинамические потенциалы?
22. Какие термодинамические функции являются критериями для определения направления самопроизвольного протекания процесса в условиях а) Р,Т = const, б) V,T = const?
23. Предскажите изменение энтропии в следующих процессах: а) плавление льда; б) кипение воды; в) Н2(г) + 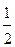 О2(г) = Н2О(г).
О2(г) = Н2О(г).
24. Приведите формулировки и математическое выражение второго закона термодинамики.
25. Приведите примеры самопроизвольных и несамопроизвольных процессов.
26. Могут ли в организме осуществляться эндергонические процессы? Ответ обоснуйте.
27. Как связана константа равновесия реакции с изменением функции Гиббса?
28. Приведите несколько формулировок второго закона термодинамики, напишите его математическое выражение. В чем состоит значение второго закона термодинамики для процессов, протекающих в живых организмах?
29. Можно ли, используя термодинамические параметры реакции, провести оценку выхода продуктов (рассчитать константу равновесия)?
30. Какие из приведенных реакций могут протекать в прямом, а какие - в обратном направлении при Т, Р = сonst:
а) SO2(г) + 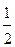 O2(г)= SO3(г),
O2(г)= SO3(г), 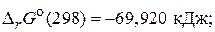
б) 2HСl(г) = H2(г) + Cl2(г), 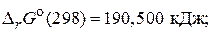
в) 2H2(г) + O2(г) = 2H2O(г), 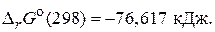
31. Изменение энтальпии для реакции H2(г) + 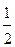 O2(г) = H2O(ж) равно
O2(г) = H2O(ж) равно
–285,85 кДж/моль при 298 К и 101,325 кПа. Предскажите влияние температуры на константу равновесия этой реакции.
32. Назовите критерии самопроизвольности протекания процессов и равновесия в изолированных и неизолированных системах.
33. Стандартные энтальпии образования газообразного оксида углерода(IV) и жидкой воды равны соответственно –393,0 и –285,85 кДж/моль. Какова энергетическая ценность (кДж/г) углерода и водорода как видов топлива? (32,75 кДж/г; 142,9 кДж/г)
34. С ростом температуры равновесие реакции SO2+ 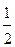 O2=SO3 смещается влево. Сделайте вывод о знаке теплового эффекта реакции. Ответ обоснуйте.
O2=SO3 смещается влево. Сделайте вывод о знаке теплового эффекта реакции. Ответ обоснуйте.
35. Влияет ли давление на выход продуктов в обратимой реакции?
36. Как отличаются изобарный и изохорный тепловые эффекты для реакции образования жидкой воды?
37. Как влияет температура на величину константы равновесия (Кр) экзотермической реакции?
38. Энергетическая ценность сахара составляет 16,80 кДж/г. Объясните возможные пути экспериментального определения или теоретического расчета этой величины?
39. Каким образом можно увеличить выход оксида азота (IV) в реакциях, идущих по уравнениям:
1) 2NО(г) + О2(г) = 2NО2(г) , 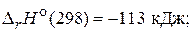
2) N2О4(г) = 2NО2(г), 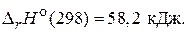
40. Объясните изменение выхода продуктов с повышением температуры для газообразных реакций, протекающих: а) с выделением теплоты, 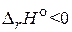 ; б) с поглощением теплоты,
; б) с поглощением теплоты, 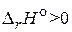 . Для объяснения используйте уравнение изобары Вант–Гоффа.
. Для объяснения используйте уравнение изобары Вант–Гоффа.
41. Чем объяснить постоянство теплоты нейтрализации сильной кислоты сильным основанием?
42. Одинаковые ли будут тепловые эффекты при нейтрализации серной кислоты растворами: а) гидроксида натрия; б) гидроксида калия; в) аммиака?
43. Какова связь между изменениями внутренней энергии и энтальпией системы? Поясните на конкретных примерах.
44. Применяя математическое выражение первого закона термодинамики, покажите, что тепловой эффект химической реакции при постоянном давлении есть изменение энтальпии, а тепловой эффект химической реакции при постоянном объеме - изменение внутренней энергии химической реакции.
45. Что означает понятие "стационарное" состояние организма и чем оно отличается от равновесного состояния системы?
46. В каком направлении сместится равновесие при изменении давления и температуры в реакциях:
1) 2СO(г) + O2(г) = 2СO2(г), 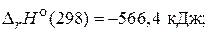
2) СO2(г) + С(т) = 2СO(г), 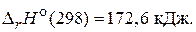
47. Применимы ли основные законы термодинамики к живым организмам?
48. Hе противоречит ли уравнение изобары химической реакции принципу Ле Шателье?
49. Согласно первому закону термодинамики теплота есть функция процесса. Закон Гесса утверждает, что теплота химической реакции не зависит от пути процесса. Объясните это “противоречие”.
50. Укажите факторы, смещающие равновесие и не изменяющие константу равновесия.
51. Какие процессы характеризуются изменением функции Гельмгольца?
52. Классифицируйте следующие реакции по знаку энтальпии:
C2H4(г) + H2O(г) = C2H5OH(г), 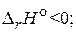
CO2(г) + 2H2S(г) = 2H2O(г) + CS2(г), 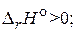
3H2(г) + CO(г) = CH4(г) + H2O(г), 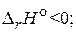
2H2O(г) + 3CO(г) = CH3OH(г) + 2CO2(г), 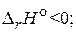
CaCO3(т) = CaO(т) + CO2(г), 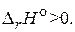
53. Из приведенных процессов укажите те, для которых 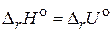 :
:
4HCl(г) + O2(г) = 2H2O(г) + 2Cl2(г);
2NO2(г) + O3(г) = O2(г) + N2O5(г);
CH4(г) + 2O2(г) = CO2(г) + 2H2O(г);
2H2(г) + 2CO(г) = CH4(г) + CO2(г);
H2(г) + Cl2(г) = 2HCl(г).
54. Какая из приведенных ниже реакций поставляет организму больше энергии:
1) C6H12O6(т) = 2C2H5OH(ж) + 2CO2(г);
2) C6H12O6(т) + 6O2(г) = 6CO2(г) + 6H2O(ж).
55. Определите калорийность пищевого продукта массой 380 г, содержащего 15 % углеводов, 20 % жиров, 35 % белков и 30 % воды, если калорийность белков равна 17,1 кДж/г, жиров – 38,0 кДж/г, углеводов 17,1 кДж/г. (6137 кДж)
56. Вычислите стандартную энтальпию образования сахарозы С12Н22О11, если тепловые эффекты реакций сгорания веществ соответственно равны:
C12H22O11(т) + 12O2(г)= 12СО2(г) + 11H2O(ж), 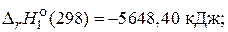
С(т) + O2(г) = CO2(г), 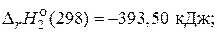
Н2(г)+ 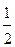 O2(г) = H2O(ж),
O2(г) = H2O(ж), 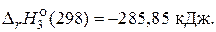
(–2218 кДж/моль)
57. При сгорании некоторого количества глюкозы на открытом воздухе выделилось 563,17 кДж теплоты. Найдите количество прореагировавшей глюкозы, если известно, что энтальпия ее сгорания –2815,83 кДж/моль. (0,2 моль)
58. Не проводя расчетов, покажите отличие изобарного и изохорного тепловых эффектов следующих реакций:
1) СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж);
2) N2(г) + 3Н2(г) = 2NH3(г).
59. Рассчитайте количество теплоты, выделяющейся при гашении 1 кг извести водой, если стандартные энтальпии образования ( 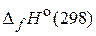 ) СаО(т), Са(ОН)2(т) и Н2О(ж) соответственно равны –635,10; –986,20; –285,85 кДж/моль. (1165,18 кДж)
) СаО(т), Са(ОН)2(т) и Н2О(ж) соответственно равны –635,10; –986,20; –285,85 кДж/моль. (1165,18 кДж)
60. Какое количество теплоты выделится при сгорании 150 г этилового спирта, если стандартные энтальпии образования С2Н5ОН(ж), СО2(г) и Н2О(ж) равны соответственно –277,80; –393,50 и –285,85 кДж/моль. (4456,8 кДж)
61. Найдите разность между qр и qv при 25 °С для следующих реакций:
1) CO(г) + 3H2(г) = CH4(г) + H2O(ж);
2) C2H5OH(ж) = C2H4(г) + H2O(ж).
62. При сгорании 1 л ацетилена при постоянном объеме и 298 К выделяется 58,0 кДж теплоты. Можно ли на основании этих данных вычислить стандартную энтальпию сгорания ацетилена?
63. При горении в стандартных условиях 2 г водорода выделяется 285,85 кДж теплоты. Рассчитайте количество выделяемой теплоты при проведении реакции в закрытом сосуде. (282,3 кДж)
64. При полном сгорании 46 г этилового спирта выделяется 1367,7 кДж теплоты. Рассчитайте стандартную энтальпию образования этилового спирта, если стандартные энтальпии образования воды жидкой и углекислого газа равны соответственно –285,85 и –393,50 кДж/моль. (–276, 85 кДж/моль)
65. Рассчитайте стандартную энтальпию образования сахарозы С12H22О11 (тв), если тепловой эффект реакции
С12H22О11 (тв) + 12О2 (тв) = 12СО2 (г) + 11H2О(ж)
равен –5694 кДж, и стандартные энтальпии образования H2О(ж) и СО2(г) соответственно равны –285,85 и –393,50 кДж/моль. (–2172, 35 кДж/моль)
66. Чему равно изменение энтальпии реакции сгорания водорода при постоянном объеме, если ее тепловой эффект при постоянном давлении и при 25 °С равен 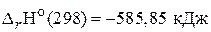 ? (–282,3 кДж)
? (–282,3 кДж)
67. Рассчитайте энтальпию образования пальмитиновой кислоты (C15H31COOH), если при сгорании 1 моль ее при 298 К выделяется 9796 кДж теплоты, а стандартные энтальпии образования CO2(г) и H2О(ж) соответственно равны –393,5 и –285,85 кДж/моль.( –1073,6 кДж/моль)
68. Стандартная энтальпия сгорания метана равна –822 кДж/моль. Рассчитайте количество теплоты, выделившейся при сгорании 160 г метана. (8220 кДж)
69. Реакция горения ацетилена при стандартных условиях сопровождается выделением 1300 кДж теплоты. Рассчитайте стандартную энтальпию образования ацетилена при постоянном давлении, если:
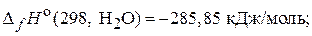
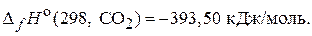
(–228,15 кДж/моль)
70. Вычислите изменение энтальпии реакции при 25 °С
С2H5ОH(ж) + O2(г) = CH3COOH(ж) + H2O(ж),
если стандартные энтальпии сгорания этилового спирта и уксусной кислоты равны соответственно –1367,7 и –872,1 кДж/моль. (–495,6 кДж)
71. Будут ли отличаться изобарный и изохорный тепловые эффекты реакций:
1) N2(г) + O2(г) = 2NO(г); 2) С6Н12О6(т) + 6О2(г) = 6CO2(г) + 6H2O(ж).
72. Стандартное изменение функции Гиббса реакции горения глюкозы равна –2880 кДж. При дыхании часть этой энергии в количестве 1140 кДж запасается клетками для выполнения работы. Сколько энергии запасут клетки при разложении 0,5 г глюкозы? (3,16 кДж)
73. Возможен ли самопроизвольный процесс образования глюкозы из углекислого газа и воды при постоянных температуре и давлении? Ответ обоснуйте.
74. Рассчитайте константы равновесия Кр и Кс реакции N2O4(г) = 2NO2(г), если стандартные изобарные потенциалы образования ( 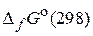 ) для NO2(г) и N2O4(г) равны 51,84 и 98,82 кДж/моль соответственно. (0,14; 5,65·10–5)
) для NO2(г) и N2O4(г) равны 51,84 и 98,82 кДж/моль соответственно. (0,14; 5,65·10–5)
75. Рассчитайте изменение энтропии процесса обмена карбоксиметилцеллюлозы с ионами К+(Na+) при 300 К, если при этом выделяется 23 кДж теплоты, а прирост функции Гиббса составил 0,66 кДж. Какие выводы можно сделать о направлении связывания карбоксиметилцеллюлозы с ионами К+(Na+)? (–78,87 Дж/К)
76. Константы равновесия (Кр) двух реакций равны соответственно 1 и 5×10–3. Рассчитайте изменение изобарно–изотермического потенциала и сделайте вывод о направлении самопроизвольного протекания каждой реакции. (0 кДж/моль; 13,127 кДж/моль)
77. Рассчитайте изменение энтропии при реакции гидролиза АТФ в живом организме АТФ + H2O = АДФ + HРO42– + H+, если при этих условиях выделилось 20 кДж теплоты, а убыль изобарно–изотермического потенциала составила 30 кДж. (–33,56 Дж/К)
78. Энергетическая ценность белков составляет 17 кДж/г, а жиров - 38 кДж/г. Людям, занятым тяжелым физическим трудом, необходимо поглощать с пищей ~ 10500 кДж ежедневно. Рассчитайте массу жиров в суточном рационе человека, если белков в нем содержалось 300 г. (142 г)
79. Константа равновесия реакции аланина с глицином, приводящая к образованию дипептидной связи, равна 1·10–3. Может ли данный процесс идти самопроизвольно при 298 К?
80. При растворении аденина в воде и метаноле при 298 К поглощается 29,58 и 16,57 кДж/моль теплоты, а прирост энтропии при растворении в воде и метаноле составляет 25,5 и 39,3 Дж/(моль×К) соответственно. В каком из этих растворителей лучше растворяется аденин?
81. Рассчитайте тепловой эффект и изменение энтропии реакции разложения карбоната кальция на открытом воздухе, используя данные таблицы 3.
Т а б л и ц а 3
| Вещество | 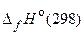 , кДж/моль , кДж/моль | 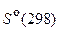 , Дж/(моль×К) , Дж/(моль×К) |
| СО2(г) | –393,51 | 213,82 |
| СаО(г) | –635,09 | 39,77 |
| СаСО3(г) | –1206,83 | 88,8 |
Может ли протекать самопроизвольно эта реакция при температуре 25 °С ? (178,23 кДж; 164,79 Дж/К)
82. Рассчитайте энтальпию образования сероуглерода, используя термохимические уравнения следующих реакций:
S(т) + O2(г) = SO2(г), 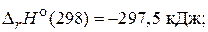
CS2(т) + 3O2(г) = CO2(г)+ 2SO2(г), 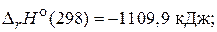
С(т) + O2(г) = CO2(г), 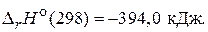
(–120,9 кДж/моль)
83. Стандартное изменение энтальпии сгорания кристаллической аминоуксусной кислоты при 298 К равно –976,7 кДж/моль. Процесс сгорания протекает по схеме
NH2CH2COOH(т) + 2 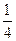 О2 = 2СО2(г) + 2
О2 = 2СО2(г) + 2 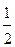 Н2О (ж)+
Н2О (ж)+ 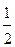 N2(г)
N2(г)
Рассчитайте изменение стандартной энтальпии образования аминоуксусной кислоты при заданной температуре, если
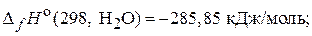
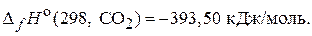
(–524,9 кДж/моль)
84. Энергетическая ценность сливочного масла 30,9 кДж/г, а белого хлеба 9,7 кДж/г. Сколько энергии получит Ваш организм при потреблении бутерброда, состоящего из 100 г хлеба и 20 г масла? (1588 кДж)
85. Оцените возможность образования газообразного метанола из оксида углерода (II) и водорода при 298 К, используя данные таблицы 4:
Т а б л и ц а 4
| Вещество | 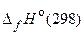 , кДж/моль , кДж/моль | 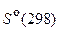 , Дж/(моль×К) , Дж/(моль×К) |
| СО(г) | –110,60 | 197,68 |
| Н2(г) | 130,66 | |
| СН3ОН(г) | –202,10 | 239,90 |
86. При изучении равновесия реакции С(т) + 2H2(г) = CH4(г) значения констант равновесия при температурах 700 и 750 °С равны 0,195 и 0,118. Рассчитайте тепловой эффект этой реакции и сравните с наиболее точным значением ( 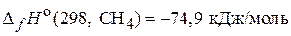 ). (–83,14 кДж)
). (–83,14 кДж)
87. Дайте термодинамическую оценку возможности получения анилина из хлорбензола и аммиака С6H5Cl(ж) + NH3(г) = С6H5NH2(ж) + HCl(г) в стандартных условиях, если стандартные изменения функции Гиббса образования С6H5Cl(ж), NH3(г), С6H5NH2(ж), HCl(г) соответственно равны: 198,4; –16,63; 153,1; –95,28 кДж/моль.
88. Вычислите изменение энтропии реакции при стандартных условиях:
4HCl(г) + O2(г) = 2H2O(г) + 2Cl2(г),
если абсолютные значения энтропии HCl(г), O2(г), H2O(г), Cl2(г) равны соответственно 186,92; 205,17; 188,85; 223,13 Дж/(моль·К). (–128,89 Дж/К)
| | |||
| |
| Варианты индивидуальных заданий для контрольной работы по теме: “Химическая кинетика” | Номера вопросов | Последняя цифра | 15, 24, 32, 61, 81 | 5, 8, 9, 63, 76 | 33, 35, 37, 59, 65 | 18, 23, 50, 55, 82 | 44, 46, 47, 71, 84 | 2, 11, 42, 57, 86 | 22, 39, 45, 74, 79 | 7, 10, 21, 36, 53 | 22, 41, 49, 60, 64 | 2, 20, 32, 67, 83 | |
| 22, 28, 50, 58, 79 | 4, 7, 47, 60, 75 | 20, 26, 30, 64, 88 | 10, 13, 49, 54, 80 | 36, 39, 45, 68, 81 | 1, 9, 32, 51, 85 | 19, 38, 41, 72, 77 | 2, 6, 33, 75, 87 | 12, 19, 40, 59, 62 | 28, 31, 48, 65, 87 | ||||
| 19, 25, 49, 57, 77 | 3, 45, 48, 59, 74 | 17, 29, 43, 62, 84 | 6, 12, 14, 53, 78 | 2, 38, 41, 67, 79 | 8, 28, 43, 56, 83 | 18, 35, 40, 71, 73 | 5, 34, 44, 72, 86 | 11, 18, 37, 61, 88 | 8, 25, 46, 64, 76 | ||||
| 12, 18, 23, 56, 73 | 41, 44, 46, 72, 86 | 24, 27, 42, 61, 81 | 5, 11, 31, 52, 76 | 1, 35, 40, 65, 77 | 25, 43, 46, 54, 82 | 14, 26, 37, 68, 70 | 1, 4, 20, 68, 85 | 9, 14, 30, 58, 84 | 23, 39, 50, 62, 72 | ||||
| 10, 11, 14, 55, 70 | 36, 39, 40, 71, 85 | 16, 22, 32, 58, 79 | 4, 8, 9, 51, 75 | 20, 26, 37, 64, 73 | 21, 23, 24, 39, 80 | 13, 17, 30, 67, 69 | 3, 44, 50, 71, 82 | 12, 29, 34, 57, 81 | 10, 38, 49, 61, 86 | ||||
| 6, 9, 13, 54, 69 | 2, 37, 38, 68, 82 | 15, 19, 28, 57, 77 | 3, 7, 21, 44, 74 | 17, 30, 34, 62, 70 | 10, 22, 38, 55, 78 | 29, 31, 33, 59, 65 | 31, 36, 49, 67, 83 | 27, 42, 50, 56, 79 | 6, 12, 35, 58, 66 | ||||
| 5, 31, 44, 53, 66 | 1, 30, 35, 67, 83 | 18, 25, 50, 56, 73 | 36, 47, 48, 72, 87 | 29 ,42, 43, 61, 69 | 6, 19, 35, 52, 76 | 8, 27, 34, 63, 64 | 2, 8, 12, 65, 80 | 16, 32, 49, 55, 77 | 5, 11, 26, 57, 85 | ||||
| 4, 8, 36, 52, 63 | 26, 29, 34, 65, 80 | 14, 23, 49, 55, 70 | 2, 45, 46, 71, 86 | 24, 27, 32, 58, 66 | 5, 18, 26, 53, 75 | 16, 20, 50, 60, 62 | 1, 7, 11, 78, 88 | 12, 15, 28, 54, 73 | 4, 9, 17, 56, 74 | ||||
| 2, 3, 7, 51, 60 | 17, 20, 27, 64, 87 | 10, 12, 13, 54, 69 | 1, 39, 41, 68, 85 | 16, 22, 28, 57, 63 | 4, 14, 17, 59, 74 | 15, 44, 49, 61, 66 | 9, 43, 48, 76, 84 | 11, 25, 31, 52, 69 | 3, 43, 47, 53, 71 | ||||
| 1, 17, 21, 33, 59 | 16, 42, 43, 62, 78 | 6, 11, 31, 53, 66 | 34, 38, 40, 67, 83 | 15, 19, 25, 56, 60 | 3, 13, 48, 72, 88 | 7, 12, 36, 58, 87 | 24, 46, 47, 75, 81 | 8, 9, 23, 51, 74 | 24, 45, 50 52, 63, | ||||
| Пред- | послед-няя | цифра |
Т е м а: Химическая кинетика
Примеры решения задач
Задача 1. Температурный коэффициент скорости реакции гидролиза некоторого лекарственного препарата равен 2,5. При какой температуре нужно провести его “искусственное старение”, чтобы скорость разрушения препарата возросла в 10 раз? (Рекомендуемая температура хранения 20 °С).
Решение
Согласно правилу Вант–Гоффа при увеличении температуры на каждые 10 ° скорость реакции возрастает в 2 - 4 раза:
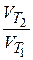 =
= 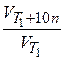 = gn,
= gn,
где n = 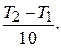
Так как отношение скоростей при Т2 и Т1 = 293 К равно 10, а g = 2,5,
то рассчитаем величину n:
gn = 10; 2,5n = 10.
Прологарифмируем данное выражение:
n lg 2,5 = lg 10,
n = 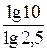 =
= 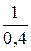 = 2,5.
= 2,5.
T2 = 10n + T1 = 10×2,5 + 293 = 318,1 K (45,1°C).
Задача 2. Хлористый фенилдиазоний при 50 °C в воде подвергается термическому распаду по уравнению первого порядка с константой скорости равной 0,07 мин–1. Сколько времени нужно нагревать раствор при указанной температуре, чтобы исходная концентрация вещества, равная 0,01 моль/л, уменьшилась в 10 раз? Чему равен период полураспада фенилдиазония при 50 °C?
Решение
Запишем выражение для константы скорости реакции первого порядка:
k = 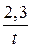 lg
lg 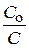 .
.
Отсюда t = 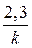 lg
lg 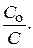
Текущая концентрация будет равна: С = 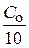 = 0,1×0,01 = 0,001 моль/л
= 0,1×0,01 = 0,001 моль/л
t = 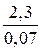 lg
lg 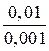 = 32,86 мин.
= 32,86 мин.
Период полураспада, т. е. время, за которое начальная концентрация уменьшается в 2 раза, для реакции первого порядка рассчитываем по формуле
t1/2 = 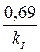 =
= 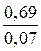 = 9,86 мин.
= 9,86 мин.
Задача 3. Рассчитайте энергию активации реакции, для которой при повышении температуры с 295 до 305 К скорость реакции удваивается.
Решение
Используем уравнение Аррениуса в интегральной форме:
lg 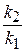 =
= 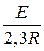 (
( 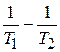 );
);
Если скорость реакции удваивается, то 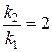 ;
;
E = 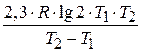 =
= 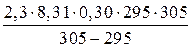 = 51,59 кДж/моль.
= 51,59 кДж/моль.
Вопросы и задания
1. Дайте определение понятия скорости химической реакции и перечислите факторы, влияющие на ее величину.
2. Сформулируйте закон действующих масс для скорости химической реакции. Каков физический смысл константы скорости реакции?
3. Что понимают под молекулярностью и порядком химической реакции? Всегда ли они совпадают? Приведите примеры.
4. Какие реакции относятся к реакциям первого порядка? Приведите уравнение для расчета константы скорости этих реакций.
5. Какие реакции называются реакциями нулевого порядка? Приведите уравнение для расчета константы скорости.
6. Какие реакции относятся к реакциям второго порядка? Приведите уравнения для расчета константы скорости этих реакций.
7. Что называется периодом полураспада? Покажите характер зависимости периода полураспада от начальной концентрации в реакциях нулевого, первого и второго порядков.
8. Какие экспериментальные данные необходимо иметь для определения константы скорости?
9. Как влияет температура на скорость химической реакции? Изобразите графически известные вам зависимости скорости от температуры.
10. Напишите кинетическое уравнение реакции:
FeCl3 + 3 KNCS = 3 KСl + Fe(NCS)3,
если известно, что она имеет первый порядок по концентрациям обоих реагирующих веществ.
11. Какими уравнениями описывается влияние температуры на скорость реакции?
12. В чем заключаются особенности влияния температуры на скорость реакций, протекающих в живых организмах (биологических системах)?
13. Приведите график изменения энергии системы в ходе химической реакции.
14. Какие экспериментальные данные необходимо иметь для определения энергии активации?
15. Приведите примеры простых и сложных реакций. Какие типы сложных реакций вам известны?
16. Какие реакции называются цепными? В чем заключаются их особенности?
17. Сопоставьте действия неорганических катализаторов и ферментов.
18. Столкновение каких молекул, согласно теории Аррениуса, приводит к химическому превращению? Влияют ли на скорость реакции стерические факторы? Обоснуйте ваш ответ.
19. Чем отличаются, согласно теории Аррениуса, активные молекулы от неактивных и как можно рассчитать долю активных молекул?
20. Объясните суть теории активированного комплекса.
21. Применительно к процессам всасывания лекарственных препаратов из желудка в кровь и выведения их в мочу используют термин “время полувыведения”. Константа скорости процесса выведения лекарства из организма называется константой элиминации. Она является характеристикой препарата и для разных препаратов имеет значения 10–5 – 10–3 с–1. Рассчитайте время полувыведения препарата, если константа элиминации равна 6×10–5 с–1, а процесс выведения протекает по первому порядку. (11500 с.)
22. В чем физический смысл понятия “энергия активации”? Объясните в рамках теории Аррениуса влияние температуры на скорость реакции.
23. Скорость оседания эритроцитов (СОЭ) описывается кинетическим уравнением 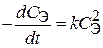 , где
, где 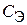 – концентрация эритроцитов в плазме крови. Тангенс угла наклона прямой, построенной в координатах
– концентрация эритроцитов в плазме крови. Тангенс угла наклона прямой, построенной в координатах 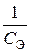 = f (t), равен 10–13л/(моль×мин). Объясните физический смысл этой величины. По какому порядку протекает данный процесс?
= f (t), равен 10–13л/(моль×мин). Объясните физический смысл этой величины. По какому порядку протекает данный процесс?
24. Энергия активации для реакции распада пероксида водорода под действием иона железа (II) и молекулы каталазы соответственно равна 42 и 7,1 кДж/моль. В каком случае разложение H2О2 произойдет быстрее и почему?
25. Можно ли по написанному уравнению химической реакции установить кинетический порядок реакции?
26. Как влияет катализатор на величину энергии активации реакции и на равновесие?
27. Какие реакции называются каталитическими? Приведите примеры таких реакций в живых организмах.
28. Есть ли отличия между реакциями первого и второго порядков?
29. Имеют ли отношение фотохимические реакции к механизму действия зрительного анализатора? Ответ обоснуйте.
30. Какие реакции называются цепными? Приведите примеры.
31. Объясните физический смысл константы скорости реакции. От каких факторов зависит ее величина?
32. Константа скорости некоторой реакции имеет размерность л/(моль×с). Каков порядок этой реакции? Ответ обоснуйте.
33. Является ли образование кислорода как побочного (но очень важного) продукта фотосинтеза универсальным свойством фотосинтеза? Ответ обоснуйте.
34. Какие теории катализа вам известны? Каковы основные положения этих теорий?
35. Покажите роль фермент-субстратного комплекса в ферментативном катализе.
36. Обычный путь лекарственных веществ в организме можно рассматривать как последовательность двух процессов: всасывание из желудка в кровь и выведение из крови в мочу. Каждый из этих процессов характеризуются константами скоростей. Изобразите кинетические кривые изменения массы лекарственного вещества в желудке, крови и моче. Как можно использовать эти зависимости для прогнозирования дозы и частоты приема лекарственного вещества?
37. Приведите основные стадии процесса фотосинтеза. В чем состоит сущность фотохимической реакции?
38. Что понимают под положительным и отрицательным катализом? Приведите примеры.
39. В чем проявляется специфичность и избирательность катализаторов? Покажите это на конкретных примерах.
40. Объясните влияние pH среды на ферментативную активность.
41. Известно, что согласно закону Эйнштейна один поглощенный квант энергии вызывает единственный химический процесс. В то же самое время квантовый выход может быть равен 106. Как объяснить это кажущееся противоречие?
42. Какая разница между молекулярностью и кинетическим порядком реакции? Может ли кинетический порядок реакции быть равен молекулярности?
43. Во сколько раз скорость реакции разложения пероксида водорода под действием каталазы (k2 = 3,5×107 с–1) больше скорости той же реакции, но под действием иона Fe2+ (k1 = 56,0 с–1)? Как будут соотноситься между собой энергии активации данных процессов?
44. Можно ли предсказать по уравнению реакции зависимость ее скорости от концентрации?
45. Какие факторы влияют на скорость ферментативной реакции? В чем физический смысл константы Михаэлиса?
46. В лабораторных условиях кислород часто получают разложением бертолетовой соли в присутствии оксида марганца (IV) в качестве катализатора. Какой это тип катализа - гетерогенный или гомогенный?
47. Что называется квантовым выходом фотохимической реакции?
48. Объясните возможные изменения константы скорости реакции при проведении ее в присутствии катализатора.
49. Почему при повышении температуры скорость реакции увеличивается независимо от того, проходит она с выделением или поглощением теплоты?
50. Жиры и углеводы окисляются в живом организме при температуре около 37 °С, а вне его их окисление происходит при 450 – 500 °С. Объясните причины этого явления.
51. Реакция первого порядка протекает на 30 % за 60 мин. За какое время реакция завершится (время разложения 99,9% вещества)? (1163 мин)
52. Реакция А + В → 2D второго порядка. Если начальные значения концентрации реагентов равны, то за 300 с реакция проходит на 20 %. За какое время она пройдет на 70 %? (2800 с)
53. Рассчитайте, при какой температуре реакция практически закончится через 15 мин, если при 293 К на это потребуется 2 ч. Температурный коэффициент реакции равен 3. (312 К)
54. Как изменится скорость элементарной гипотетической реакции M + 3L = 2D, если концентрацию вещества M увеличить в 4 раза, а концентрацию вещества L уменьшить во столько же раз? (Уменьшится в 16 раз)
55. Сопоставьте константы скорости двух реакций первого порядка 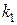 и
и 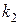 , если период полураспада первой реакции в три раза больше, чем второй. (1:3.)
, если период полураспада первой реакции в три раза больше, чем второй. (1:3.)
56. При авариях на атомных станциях часто происходит выброс изотопа йода с массовым числом 131. Период полураспада этого изотопа равен 8 сут. За какое время произойдет разложение изотопа йода на 90 %? (26,8 сут)
57. Разложение пероксида водорода в водном растворе протекает как реакция первого порядка с периодом полураспада 13,6 мин. Определите время, которое потребуется для разложения при аналогичных условиях 90 % пероксида водорода. (46 мин)
58. При 20 °С 0,01 М раствор уксусноэтилового эфира омыляется 0,02 М раствором NаОH на 10 % в течение 23 мин. Как изменится это время, если уменьшить концентрации реагирующих веществ в пять раз? (115 мин)
59. Скорость бактериального гидролиза мышц рыб удваивается при переходе от температуры –1,1 °С к температуре +2,2 °С. Оцените энергию активации этой реакции. Есть ли здесь какая-нибудь связь с проблемой хранения рыбы? (130,08 кДж/моль)
60. Скорость многих реакций удваивается при повышении температуры на каждые 10 градусов. Считая, что такая реакция идет при 300 К, оцените, какова должна быть энергия активации, чтобы эта закономерность выполнялась. (53,35 кДж/моль)
61. Диссоциация фосгена COCl2 = CO + Cl2 при температуре 109 °С протекает с константой скорости 5×10–3 мин–1. Какое количество фосгена разложится при данной температуре за 100 мин после начала реакции, если начальная концентрация фосгена составила 1 моль/л? (0,396 моль)
62. Срок годности некоторого лекарственного препарата при 40 °С равен 1 году. Определите срок годности его при комнатной температуре (20 °C), если считать, что разложение его идет по первому порядку и температурный коэффициент равен 2. (4 года)
63. Денатурация белка (реакция 1-го порядка) при 60 °С прошла за 15,32 мин. на 50 %. Определите время его распада на 90 % при этих же условиях. Можно ли получить ответ задачи, если в условии вместо периода полураспада, известны энергия активации и константа скорости при 20 °С? (51 мин.)
64. Константа разложения таблеток анальгина при 20 °С равна
1,5×10–9 с–1. Рассчитайте срок хранения таблеток (время разложения 10 % вещества) в этих условиях. (2,23 года)
65. Появление изотопов азота наблюдается при ядерных взрывах. Один из таких изотопов имеет период полураспада 9,93 ч. Какая часть данного изотопа распадается через сутки после начала процесса? (0,81)
66. Какой должна быть энергия активации, чтобы скорость реакции увеличилась в три раза при повышении температуры от 50 до 60 °С? (98,24 кДж/моль)
67. В сосуде имеется 0,025 г радона. Период полураспада радона 3,82 дня. Какое количество радона (%) останется в сосуде через 2 недели? (8 %)
68. Фармацевтический препарат этилхлорид вызывает временную анестезию. При гидролизе (в среде 80%-го этилового спирта) обнаружено, что изменение его концентрации во времени происходит следующим образом:
| t, ч | |||||
| C(С2H5Cl), моль/л | 0,312 | 0,258 | 0,186 | 0,085 | 0,047 |
Определите константу скорости и период полупревращения, если она протекает по первому порядку. (0,0496 час–1, 14 час.)
69. Спазмолитин в водном растворе при 353 К разлагается наполовину за 90 мин. Рассчитайте время, за которое спазмолитин разложится наполовину при температуре 293 К, если энергия активации этого процесса равна 75,7 кДж/моль. (12,3 дня)
70. При хранении таблеток анальгина при комнатной температуре (20 °С) происходит его разложение с константой скорости 1,5×10–9с–1. Рассчитайте срок хранения таблеток анальгина (время разложения 10 % вещества) в этих условиях и в условиях хранения в холодильнике (–5 °С), если энергия активации процесса разложения равна 60 кДж/моль. (2,23 года; 22,07 года)
71. Препарат "Калий-нормин" нормализует количество ионов калия в сыворотке крови. После приема таблеток концентрация ионов калия в сыворотке крови изменилась следующим образом:
| t, ч | |||||
| C(К+), мг /л | 4,60 | 4,40 | 4,20 | 4,08 | 3,53 |
Определите константу скорости реакции распада таблеток. (0,0109 час–1)
72. Одним из опасных последствий ядерного взрыва является образование изотопа 90Sr и его внедрение в кости вместо кальция. Период полураспада изотопа равен 28,1 года. Предположим, что 1 мкг был поглощен новорожденным. Сколько останется его а) к 18 годам, б) к 70 годам? (а) 0,64 мкг; б) 0,18 мкг)
73. Реакция имеет энергию активации 64,79 кДж/моль и константу скорости реакции при 20 °С равную 1,2 мин–1. Рассчитайте величину константы скорости при 0 °С. (0,17 мин–1)
74. Температурный коэффициент скорости некоторой реакции равен 2. Вычислите константу скорости реакции при 390 °С, если при 362 °С она равна 7,5×10–4 с–1. (5,22·10–3 с–1)
75. Монохлоруксусная кислота при 298 К реагирует с водой (вода взята в большом избытке). Константа скорости этой реакции равна 7×10–5 с–1. Определите время полураспада и время, в течение которого прореагирует 75 % монохлоруксусной кислоты. (2,74 час; 5,5 час)
76. Разложение пероксида водорода в водном растворе протекает по кинетическому уравнению реакции первого порядка с константой скорости 5,081×10–2 мин–1. Определите время, за которое пероксид водорода разложится на 50 %. (13,6 мин)
77. Диссоциация фосгена при температуре 109 °С протекает с константой скорости 5×10–3 мин–1, при повышении температуры до 209 °С константа скорости становится равной 6,76×10–1 мин–1. Рассчитайте энергию активации процесса диссоциации фосгена и константу скорости реакции при температуре 150 °С. (75,14 кДж/моль; 4,5×10–2 мин–1)
78. При гидролизе 1 кг сахарозы в присутствии воды и фермента гидролиза сахаразы через 5 ч осталось непрореагировавшим 600 г сахарозы. Вычислите количество сахарозы, разложившейся через 30 мин от начала реакции. (49,4 г.)
79. В условиях 40-градусной жары новокаин гидролизуется с константой скорости 0,66 ч–1. Энергия активации этого процесса равна 55,2 кДж/моль. Сколько процентов новокаина разложится за 30 дней его хранения при 40-градусном морозе? (27,85 %)
80. Для определения срока годности порошка папаверина гидрохлорида проведено исследование по методике "ускоренного старения" и получены следующие результаты:
| время, сут | ||||
| (t=50 °C) C, % | 99,79 | 99,38 | 98,91 | |
| (t=80 °C) C, % | 99,58 | 98,86 | 97,80 |
Определите срок годности порошка (время разложения 10 % вещества) при температуре хранения 20 °С. (1,22 года)
81. Реакция первого порядка при 20 °С осуществляется на 40 % за 50 мин. При какой температуре реакция завершится полностью за это же время, если энергия активации составляет 36 кДж/моль. (357,15 К)
82. Содержание лекарственного препарата в растворе при гидролизе за 14 дней уменьшилось на 6,85 %. Определите константу скорости процесса, период полупpевpащения и срок хранения препарата (время разложения 10 % вещества). (0,005 дн–1; 136 дн; 21 день)
83. При хранении таблеток амидопирина было установлено, что при 80 °С и 90 °С константы скорости разложения соответственно равны 1,64×10‑6 с–1 и 4,20×10–6 с–1. Определите срок хранения таблеток (время разложения 10 % вещества) при 20 °С. (2,22 года)
84. Константа скорости гидролиза новокаина при 313 К равна 0,66 ч–1, энергия активации реакции - 55,2 кДж/моль. Сколько времени потребуется для разложения 50% новокаина при температуре хранения 263 К? (59 ч.)
85. Для реакции разложения сульфацила натрия при 460 К константа скорости - 3,5×10–2 мин–1, а при 518 К она равна 3,43×10–1 мин–1. Определите температурный коэффициент скорости и константу скорости реакции при 486 К. (1,48; 9,78·10–2 мин–1)
86. Температурный коэффициент скорости реакции гидролиза 5 % норсульфазола-натрия равен 3. Оптимальная температура хранения препарата 20 °С При какой температуре нужно проводить "искусственное старение" препарата, чтобы скорость его разрушения возросла в 80 раз? (59,8°С)
