Энергетические уровни, подуровни и орбитали
Многоэлектронного атома
| Энерге-тический уровень n | Энергетический подуровень | Обозначение орбитали | Число орби- талей n 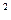 | Число электронов 2n 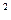 | |
| l | вид орбитали | ||||
| s | 1s | ||||
  2 2 | s p | 2s 2p | 3 4 | 2 8 | |
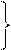 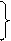 3 3 | s p d | 3s 3p 3d | 3 9 | 6 18 | |
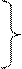 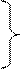 4 4 | s p d f | 4s 4p 4d 4f | 3 16 | 6 32 |
Магнитное квантовое число ml в пределах данного подуровня (n, l = const) принимает все целочисленные значения от +l до –l, включая нуль. Для s-подуровня (n = const, l = 0) возможно только одно значение ml = 0, откуда следует, что на s-подуровне любого (от первого до седьмого) энергетического уровня содержится одна s-АО.
Для p-подуровня (n>1, l = 1) ml может принимать три значения +1, 0, -1, следовательно, на p-подуровне любого (от второго до седьмого) энергетического уровня содержится три p-АО.
Для d-подуровня (n>2, l = 2) ml имеет пять значений +2, +1, 0, -1, -2 и, как следствие, d-подуровень любого (от третьего до седьмого) энергетического уровня обязательно содержит пять d-АО.
Аналогично, для каждого f-подуровня (n>3, l = 3) m 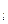 имеет семь значений +3, +2, +1, 0, -1, -2, -3 и поэтому любой f-подуровень содержит семь f-АО.
имеет семь значений +3, +2, +1, 0, -1, -2, -3 и поэтому любой f-подуровень содержит семь f-АО.
Таким образом, каждая атомная орбиталь однозначно определяется тремя квантовыми числами – главным n, орбитальным l и магнитным ml.
При n = const строго определены все относящиеся к данному энергетическому уровню значения l, а при l = const – все относящиеся к данному энергетическому подуровню значения ml.
Ввиду того, что каждая орбиталь может максимально заполняться двумя электронами, число электронов, которое может разместиться на каждом энергетическом уровне и подуровне, вдвое больше числа орбиталей на данном уровне или подуровне. Поскольку электроны, находящиеся в одной атомной орбитали, имеют одинаковые значения квантовых чисел n, l и ml, то для двух электронов на одной орбитали используется четвертое, спиновое квантовое число s, которое определяется спином электрона.
В соответствии с принципом Паули можно утверждать, что каждый электрон в атоме однозначно характеризуется своим набором четырех квантовых чисел – главного n, орбитального l, магнитного m и спинового s.
Заселение электронами энергетических уровней, подуровней и атомных орбиталей подчиняется следующему правилу (принцип минимума энергии): в невозбужденном состоянии все электроны обладают наименьшей энергией.
Это означает, что каждый из электронов, заполняющих оболочку атома, занимает такую орбиталь, чтобы атом в целом имел минимальную энергию. Последовательное квантовое возрастание энергии подуровней происходит в следующем порядке:
1s – 2s – 2p – 3s – 3p – 4s – 3d – 4p – 5s - …..
Заполнение атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом, сформулированным немецким физиком Ф. Хундом (1927 г.).
Правило Хунда: атомные орбитали, принадлежащие к одному подуровню, заполняются каждая вначале одним электроном, а затем происходит их заполнение вторыми электронами.
Правило Хунда также называют принципом максимальной мультиплетности, т.е. максимально возможного параллельного направления спинов электронов одного энергетического подуровня.
На высшем энергетическом уровне свободного атома может находиться не более восьми электронов.
Электроны, находящиеся на высшем энергетическом уровне атома (во внешнем электронном слое), называются внешними; число внешних электронов у атома любого элемента никогда не бывает больше восьми. Для многих элементов именно число внешних электронов (при заполненных внутренних подуровнях) в значительной степени определяет их химические свойства. Для других электронов, у атомов которых есть незаполненный внутренний подуровень, например 3d-подуровень у атомов таких элементов, как Sc, Ti, Cr, Mn и др., химические свойства зависят от числа как внутренних, так и внешних электронов. Все эти электроны называются валентными; в сокращенных электронных формулах атомов они записываются после условного обозначения атомного остова, т. е. после выражения в квадратных скобках.
