Приготування робочого титрованого розчину лугу
2.2.1. Робочі розчини лугів
Звичайно для титрування застосовують розчини гідроксидів калію або натрію. Розчин натрію гідроксиду більш придатний, оскільки його легше отримати вільним від домішок карбонатів. Іноді користуються розчинами барію гідроксиду; перевага останнього в тому, що вони вільні від ВаСО3, оскільки він нерозчинний у воді і випадає в осад. Однак барію гідроксид незручно використовувати в тих випадках, коли аналізований розчин містить солі, які утворюють з катіонами барію осади, наприклад, сульфати та ін. Крім того, із розчину барію гідроксиду при його взаємодії з карбону (ІV) оксидом повітря виділяється в осад ВаСО3, який забруднює бюретки і забиває крани. З тієї ж причини концентрація розчину змінюється і його необхідно час від часу перевіряти.
Найчастіше готують 0,1М розчин натрію гідроксиду. Однак останній гігроскопічний і легко реагує з СО2 повітря. Тому NaОН завжди містить змінні кількості вологи і карбонатів. Крім того, в натрію гідрокисді часто бувають інші домішки, наприклад, хлориди, сульфати, тощо. Тому спочатку готують приблизний 0,1М розчин натрію гідроксиду, а точну концентрацію визначають за вихідною речовиною.
2.2.2. Вихідні речовини
Головними вихідними речовинами, що найчастіше використовуються для встановлення титру розчинів лугів є оксалатна і бензоатна кислоти, калію гідрофталат, янтарна (бурштинова) кислота.
2.2.3. Встановлення концентрації розчину натрію гідроксиду
За оксалатною кислотою
Оксалатна кислота (СООН)2•2Н2О кристалізується з двома молекулами води. При зберіганні кислоти деяка кількість води вивітрюється і склад препарату не відповідає хімічній формулі. Тому концентрація розчину NaОН встановлюється за перекристалізованою оксалатною кислотою. Для перекристалізації готують насичений гарячий розчин кислоти. Розчин, якщо потрібно, фільтрують і швидко охолоджують. Виділені кристали відсмоктують на лійці Бюхнера, промивають 1-2 рази холодною водою. Вологий порошок висушують на повітрі, при цьому дрібні кристалики не повинні прилипати до скляної палички. Зберігають в склянках з притертим корком.
Недолік оксалатної кислоти, як вихідної кислоти, полягає в необхідності доброго очищення від домішок і проведення повторної перекристалізації перед встановленням концентрації. Крім того, розчини оксалатної кислоти нестійкі і поступово концентрація їх зменшується.
Оксалатна кислота часто містить домішки, головним чином, солі кальцію. У цьому випадку оксалатну кислоту необхідно спочатку перекристалізувати із розчину хлоридної кислоти, а потім із води.
2.2.4. Встановлення концентрації розчину NaОН за
Оксалатною кислотою
Реакція між оксалатною кислотою і натрію гідроксидом протікає за рівнянням:
(СООН)2 + 2NaОН = (СООNa)2 + 2Н2О.
Молекулярна маса еквіваленту оксалатної кислоти дорівнює половині молекулярної маси, тобто 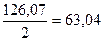 . Для встановлення концентрації розчину досить приготувати 250 см3 0,1н розчину кислоти. Наважку перекристалізованої і висушеної кислоти переносять в мірну колбу місткістю 250 см3, розчиняють у воді, що не містить СО2, доводять об’єм розчину до мітки і добре перемішують.
. Для встановлення концентрації розчину досить приготувати 250 см3 0,1н розчину кислоти. Наважку перекристалізованої і висушеної кислоти переносять в мірну колбу місткістю 250 см3, розчиняють у воді, що не містить СО2, доводять об’єм розчину до мітки і добре перемішують.
Оксалатна кислота є слабкою кислотою (К1 = 6,5•10-2; К2 = 6,1•10-5). В точці еквівалентності утворюється натрію оксалат, який, як сіль слабкої кислоти і сильної основи має в розчині лужну реакцію; рН цього розчину можна обчислити за формулою:
рН = 7+ 1/2рК + 1/2lg Cкисл.
рН = 7+ 2,1 - 0,65 = 8,45.
Найзручнішим індикатором є фенолфталеїн (рТ = 9).
Титрування з фенолфталеїном може бути точним тільки в тому випадку, коли розчин не містить СО2. У разі присутності СО2 на титрування затрачується більше розчину NaОН, ніж кількість, еквівалентна оксалатній кислоті, червоне забарвлення появиться тільки тоді, коли закінчиться реакція:
Н2СО3 + NaОН= NaНСО3 + Н2О.
Для визначення концентрації розчину NaОН відбирають піпеткою в конічну колбу 25 або 20 см3 0,1н розчину оксалатної кислоти, додають 2-3 краплі фенолфталеїну і титрують розчином натрію гідроксиду до появи червоного забарвлення, яке не зникає при збовтуванні протягом 1-2 хвилин. Роблять 3-4 паралельні титрування і для обчислення концентрації беруть середнє значення.
2.2.5. Встановлення концентрації розчину NaOH за робочим титрованим розчином хлоридної кислоти
Цей спосіб менш точний, оскільки при роботі може відбуватися сумуванням помилок одного знаку, допущених при встановленні концентрації за хлоридною кислотою. Тому таке титрування доцільно проводити тільки для перевірки правильності встановлення концентрації обидвох робочих титрованих розчинів.
При встановленні концентрації розчину лугу за хлоридною кислотою придатні і сильні, і слабкі індикатори. Біля точки еквівалентності відбувається велика зміна рН, у границях якої знаходяться показники титрування сильних і слабких індикаторів. У випадку присутності в розчині лугу домішок Na2СО3, краще титрувати з метиловим оранжевим.
Для встановлення концентрації розчину лугу з метиловим оранжевим у конічну колбу місткістю 100 см3 відбирають піпеткою 20 або 25 см3 розчину NaОН, додають до розчину 2-3 краплі метилового оранжевого і титрують із бюретки робочим розчином хлоридної кислоти до появи оранжевого забарвлення. При такому порядку титрування допускається деяка похибка, оскільки невелика кількість хлоридної кислоти витрачається на реакцію з індикатором. Цю помилку можна врахувати контрольним дослідом.
2.2.6.Приготування стандартних розчинів лугу
різних концентрацій
а) Розчин NaОН (1 моль/дм3)
1 см3 розчину містить 0,0400 г NaОН
Виготовлення вихідного розчину: 160 г NaОН розчиняють у 300 см3 води. Посуд щільно закривають гумовим корком і залишають до наступного дня. Прозору рідину зливають з осаду і використовують для виготовлення розчинів NaОН. Зберігати в скляних банках, щільно закритих гумовими корками.
Виготовлення розчину NaОН (1 моль/дм3): 80 см3 вихідного розчину NaОН поміщають у мірну колбу місткістю 1дм3 і доводять об’єм розчину водою до мітки.
Перевірка на вміст карбонатів: 45 см3 розчину хлоридної кислоти (1 моль/дм3) титрують виготовленим розчином NaОН (індикатор – фенолфталеїн). До відтитрованого розчину добавляють краплями розчин хлоридної кислоти (1 моль/дм3) до зникнення рожевого забарвлення і кип’ятять. В процесі кип’ятіння при виникненні рожевого забарвлення додають розчин НСl (1 моль/дм3) до обезбарвлення. Розчин охолоджують і в випадку наявності рожевого забарвлення додають розчин хлоридної кислоти до обезбарвлення. Сумарна кількість добавленого розчину НСl не повинна перевищувати 0,1см3.
Встановлення титру: Біля 0,5 г (точна наважка) калію гідрофталату, попередньо подрібненого і висушеного при температурі 120оС протягом 2 годин, розчиняють у 75 см3 води і титрують приготованим розчином NaОН (індикатор – фенолфталеїн). Молярну концентрацію обраховують за способом окремих наважок. Титр розчину встановлюють кожний раз перед застосуванням. Зберігають в скляних пляшках, щільно закритих гумовими корками.
б) Розчин NaОН (0,5 моль/дм3)
1 см3 розчину містить 0,0200 г NaОН
Приготування: 40 см3 вихідного розчину NaОН поміщають у мірну колбу місткістю 1 дм3 і доводять об’єм розчину водою до мітки.
Перевірка на вміст карбонатів: Проводять, як описано при виготовленні розчину із концентрацією 1моль/дм3. Для визначення беруть 45 см3 розчину НСl (0,5 моль/дм3).
Встановлення титру: Біля 2,5 г (точна наважка) калію гідрофталату, попередньо подрібненого і висушеного при температурі 120оС протягом 2 годин розчиняють у 50 см3 води і дальше поступають так само, як при встановленні титру NaОН (1моль/дм3).
в) Розчин NaОН (0,1моль/дм3)
1 см3 розчину містить 0,0040 г NaОН
Приготування: 8 см3 вихідного розчину NaОН поміщають у мірну колбу місткістю 1 дм3 і доводять об’єм розчину водою до мітки.
Перевірка на вміст карбонатів: Проводять, як описано при виготовленні розчину із концентрацією 1 моль/дм3. Для визначення беруть 45 см3 розчину НСl (0,1 моль/дм3).
Встановлення титру: Біля 0,5 г (точна наважка) калію гідрофталату добре подрібненого і висушеного при температурі 120оС протягом 2 годин розчиняють в 30 см3 води і дальше поступають так само, як при встановленні титру NaОН (1 моль/дм3).
ЛІТЕРАТУРA
1.Аналітична хімія: Навчальний посібник/ О.М.Гайдукевич, В.В.Болотов, Ю.В.Сич та ін. –Х.: Основа, Видавництво НФАУ, 2000. –432 с.
2.Пономарев В.Д. Аналитическая химия: В двух ч. –М.: Высшая школа, 1982. –Ч.1. –304 с; Ч.2. –303 с.
3.Державна Фармакопея України / Держ. підприємство “Науково-експертний фармакопейний центр.” –1-е вид. –Харків: РІРЕГ, 2001. –556 с.
4.Харитонов Ю.Я. Аналитическая химия. В 2-х кн.. Кн. 1. Общие теоретические основы. Качественный анализ. М.: Высшая школа, 2001. –604 с.
5.Харитонов Ю.Я. Аналитическая химия. В 2-х кн.. Кн. 1. Количественный анализ. Физико-химические методы анализа -М.: Высшая школа, 2001. –645 с.
6.Конспект лекцій.
7.Основы аналитической химии: В 2-х кн. Учеб. для вузов/ Ю.А.Золотов, Е.Н.Дорохова, В.И.Фадеева и др. –М.: Высшая школа, 1996. –Кн.1. –383 с.; Кн.2. –461 с.
8.Пилипенко А.Т., Пятницкий И.В. Аналитическая химия: В 2-х кн. –М.: Химия, 1990. –Кн.1. –480 с.; Кн.2. –460 с.
9.Лурье Ю.Ю. Справочник по аналитической химии. –М.: Химия, 1989. –447 с.
10.Дорохова Е.Н., Прохорова Г.В. Аналитическая химия. Физико-химические методы анализа. –М.: Высшая школа, 1991. –256с.
11.Скуг Д., Уэст Д. Основы аналитической химии: В 2-х кн. –М.: Мир, 1979. –Кн.1. –480 с.; Кн.2. –430 с.
12.Васильев В.П. Аналитическая химия: В 2-х кн. –М.: Высшая школа, 1989. –Кн.1. –319 с.; Кн.2. –383 с.
13.Державна Фармакопея України. –1-е вид. –Харків: РІРЕГ, 2001. –Доповнення 1. -2004. -520 с.
14.Кількісний аналіз. Титриметричні методи аналізу / В.В.Петренко, Л.М.Стрілець, С.О.Васюк – Запоріжжя, 2006. -215 с.
ЗАНЯТТЯ №17
ТЕМА: Кислотно-основне титрування. Первинні та вторинні стандарти. Стандартизація розчинів HCl та NaOH за первинними стандартами. Титрування сильних кислот та сильних основ.
АКТУАЛЬНІСТЬ:Вміння визначати концентрацію розчинів дає можливість застосовувати отримані навики при вивченні фармацевтичного, фітохімічного та хіміко-токсикологічного аналізу, є необхідними умовами для аналізу речовин і правильного трактування одержаних результатів досліджень.
НАВЧАЛЬНІ ЦІЛІ: Освоєння методики кількісного визначення вмісту хлоридної кислоти в розчині за допомогою виготовлених титрантів.
ЗНАТИ: -техніку виконання операцій у кількісному титриметричному аналізі;
-розрахунки процентного вмісту досліджуваної речовини за
результатами аналізу;
-правила титрування сильних кислот та основ;
-вихідні речовини для виготовлення стандартних розчинів;
-розрахунки величини наважки при виготовленні стандартних
розчинів.
ВМІТИ:-проводити розрахунки молярної маси еквіваленту речовини при
виготовленні розчинів;
-встановлювати точку кінця титрування з кислотно-основними
індикаторами;
-виготовити стандартні розчини;
-правильно вибирати індикатори в методі кислотно-основного
титрування;
-виготовляти титровані розчини з вихідних речовин з розрахованим
титром та титровані розчини з встановленим титром з
концентрованих кислот;
-робити висновки з результатів аналізу і оформляти їх у вигляді
протоколу.
САМОСТІЙНА ПОЗААУДИТОРНА РОБОТА
1.Які можуть бути помилки в методі кислотно-основного титрування? Відповідь обґрунтуйте та запишіть.
2.Суть титриметричного аналізу. Процес титрування. Точка еквівалентності і точка кінця титрування.
3.Криві кислотно-основного титрування. Скачок титрування. Замалюйте в зошиті приклад кривої титрування сильної кислоти сильною основою. Наведіть відповідні розрахунки.
4.Які існують способи вираження концентрації розчинів? Відповідь обґрунтуйте та запишіть.
5.Дайте загальну характеристику індикаторів методу кислотно-основного титрування. Як грамотно вибрати індикатор для кожного конкретного визначення?
6.Стандартні речовини і вимоги до них. Стандартні розчини, їх приготування і стандартизація.
7.Що таке константа дисоціації індикатора? Наведіть приклади.
8.Способи класифікації титриметричних методів аналізу: а) за типом реакції; б) за способом титрування. Відповідь обґрунтуйте та запишіть.
9.Розрахувати і побудувати криву титрування 0,02М розчину калію гідроксиду 0,02М розчином нітратної кислоти (не враховуючи зміни об’єму). В яких межах рН повинні лежати величини рТ індикаторів, придатних для цього кислотно-основного визначення?
10.До 20 см3 0,1М розчину хлоридної кислоти додали 30 см3 0,1М розчину натрію гідроксиду. Чому рівне рН отриманого розчину без врахування зміни об’єму розчину?
11.В яких випадках точка еквівалентності лежить: а) при рН = 7; б) при рН < 7; в) при рН > 7.
КОНТРОЛЬНІ ПИТАННЯ
1.Як виготовити стандартні розчини бури, хлоридної кислоти, натрію гідроксиду і як їх зберігати?
2.Що таке фіксанали, стандартні взірці (нормальні) і для чого їх використовують?
3.Що таке нормальність і коефіцієнт поправки стандартних розчинів?
4.Що таке молярна маса еквіваленту речовини і фактор еквівалентності? Чи постійні ці величини для речовин? Від чого вони залежать? Відповідь обґрунтуйте та запишіть.
5.Що таке титр розчину? Яка різниця між титром робочим і титром нормальним?
6.Що таке стандартні або титровані розчини?
7.Які вимоги до реакцій, що можуть використовуватися в титриметричному аналізі? Відповідь обґрунтуйте та запишіть.
8.Основні характеристики індикаторів: константа йонізації, інтервал переходу та зв’язок між ними, показник титрування.
9.Приготувати 1 дм3 0,1М розчину хлоридної кислоти, виходячи з концентрованої HCl (ρ=1,17 г/см3) та стандартизувати його за бурою.
10.Приготувати 0,5 дм3 0,1М розчину хлоридної кислоти, виходячи з концентрованої HCl (ρ=1,17 г/см3) та стандартизувати його за титрованим розчином натрію гідроксиду.
11.Константа йонізації індикаторів та інтервал переходу забарвлення, показник титрування індикатора. Основне рівняння теорії індикаторів.
12.У чому суть йонної, хромофорної та йонно-хрофофорної теорій індикаторів? Поясніть це, використовуючи хімічні формули індикаторів.
13.Які робочі розчини застосовують у методі нейтралізації та як їх готують? Відповідь обґрунтуйте та запишіть.
14.У яких випадках при титруванні кислоти основою точка еквівалентності співпадає з точкою нейтральності?
15.Який об’єм концентрованої HCl необхідно взяти для приготування 1 дм3 0,1М розчину хлоридної кислоти (ρ=1,19 г/см3)
16.Розрахуйте рН водного розчину, який містить 1% (за масою) NaOH (густина розчину 1,011 г/см3).
17.Розрахувати об’єм 0,0924М розчину NaOH, який витрачається на титрування 20,00 см3 розчину HCl.
18.Розрахуйте рН розчину, одержаного змішуванням 40 см3 0,015М розчину HCl з:
а) 40 см3 H2O;
б) 20 см3 0,02М розчину NaOH;
в) 40 см3 0,02М розчину NaOH.
19.Розрахуйте рН розчину, одержаного змішуванням 20 см3 0,02М розчину КОН з:
а) 20 см3 H2O;
б) 20 см3 0,01М розчину HCl;
в) 40 см3 0,02М розчину HCl;
г) 20 см3 0,02М розчину Ba(OH)2.
20.Визначити масову частку H2C2O4•2H2O в забрудненому препараті, якщо на титрування наважки 0,1582 г витрачено 21,37 см3 0,1093М розчину КОН.
21.Якою була маса кальцію карбонату, якщо після обробки його наважки 50,00 см3 розчину хлоридної кислоти з молярною концентрацією еквіваленту 0,2000 моль/дм3 на титрування залишку HCl використано 10,00 см3 розчину NaOH? Відомо, що на титрування 25,00 см3 хлоридної кислоти використовується 24,00 см3 розчину натрію гідроксиду.
22.Чому дорівнює титр хлоридної кислоти по кальцію оксиду, якщо на титрування 0,3245 г кальцію карбонату витрачається 46,27 см3 розчину хлоридної кислоти?
23.Знайти (не враховуюи змін об’єму) області стрибка рН і точку еквівалентності на кривій титрування 0,5 моль/дм3 розчину амонію гідроксиду 0,5 моль/дм3 розчином хлоридної кислоти. З якими індикаторами можна проводити титрування?
24.Розрахувати похибку титрування 10,0 см3 0,1000 моль/дм3 розчину хлоридної кислоти 0,1000 моль/дм3 розчином натрію гідроксиду з індикаторами: а) метиловим оранжевим (рТ = 4,0); б) фенолфталеїном (рТ = 9,0); в) тимолфталеїном (рТ = 10,0).
САМОСТІЙНА АУДИТОРНА РОБОТА
1.Ознайомитись з методом титрування сильних кислот та сильних основ за допомогою дослідів, описаних в даних методичних вказівках.
2.Виготовляти стандартні розчини методу нейтралізації.
3. Виконати лабораторні роботи, вказані в цих методичних матеріалах.
4.Оформити та захистити протокол.
5.Відповідати на запитання, запропоновані викладачем, з використанням записів на дошці.
6.Розв'язувати розрахункові задач, запропоновані викладачем.
Експериментальна частина
Завдання 1. Визначення вмісту хлоридної кислоти в розчині
В основі визначення лежить реакція між хлоридною кислотою і натрію гідроксидом:
HCl + NaOH → NaCl + H2O.
