Классификация катионов по кислотно-основному методу
ЛЕКЦИЯ 17
ХИМИЧЕСКИЙ АНАЛИЗ
Аналитическая химия. Химический анализ. Задачи и этапы анализа. Аналитический сигнал. Классификации методов анализа. Идентификация веществ. Дробный анализ. Систематический анализ.
Одной из задач при проведении природоохранных мероприятий является познание закономерностей причинно-следственных связей между различными видами человеческой деятельности и изменениями, происходящими в природной среде. Анализ - это главное средство контроля за загрязненностью окружающей среды. Научной основой химического анализа является аналитическая химия. Аналитическая химия - наука о методах и средствах определения химического состава веществ и материалов. Метод - это достаточно универсальный и теоретически обоснованный способ определения состава.
Основные требования к методам и методикам аналитической химии:
1) правильность и хорошая воспроизводимость;
2) низкий предел обнаружения — это наименьшее содержание, при котором по данной методике можно обнаружить присутствие определяемого компонента с заданной доверительной вероятностью;
3) избирательность (селективность) — характеризует мешающее влияние различных факторов;
4) диапазон измеряемых содержаний (концентраций) с помощью данного метода по данной методике;
5) экспрессность;
6) простота в анализе, возможность автоматизации, экономичность определения.
Химический анализ — это сложный многостадийный процесс, представляющий собой совокупность готовых приемов и соответствующих служб.
Задачи анализ:
· Идентификация объекта, т.е. установление природы объекта (проверка присутствия тех или иных основных компонентов, примесей).
· Количественное определение содержания того или иного компонента в анализируемом объекте.
Этапы анализа любого объекта:
1. Постановка задачи и выбор метода и схемы анализа.
2. Отбор проб (грамотный отбор части пробы позволяет сделать правильный вывод о составе всей пробы).
Проба - это часть анализируемого материала, представительно отражающая его химический состав. В отдельных случаях в качестве пробы используют весь аналитический материал. Время хранения отобранных проб должно быть минимальным. Условия и способы хранения должны исключать неконтролируемые потери легколетучих соединений и любые другие физические и химические изменения в составе анализируемого образца.
3. Подготовка проб к анализу: переведение пробы в нужное состояние (раствор, пар); разделение компонентов или отделение мешающих; концентрирование компонентов;
4. Получение аналитического сигнала.
Аналитический сигнал - это изменение любого физического или физико-химического свойства определяемого компонента, функционально связанное с его содержанием (формула, таблица, график).
5. Обработка аналитического сигнала, т.е. разделение сигнала и шумов. Шумы — побочные сигналы, возникающие в измерительных приборах, усилителях и других аппаратах.
6. Применение результатов анализа.
В зависимости от свойства вещества, положенного в основу определения метода анализа подразделяются на:
· Химические методы анализа основаны на химической аналитической реакции, которая сопровождается ярко выраженным эффектом. К ним относится гравиметрический и титриметрический методы.
· Физико-химические методы основаны измерение каких-либо физических параметров химической системы, зависящих от природы компонентов системы и изменяющихся в процессе химической реакции (например: фотометрия - основана на изменении оптической плотности раствора в результате реакции).
· Физические методы анализа не связаны с использованием химических реакций. Состав веществ устанавливается по измерению характерных физических свойств объекта (например: плотность, вязкость).
В зависимости от измеряемой величины все методы делятся:
| Измеряемая физическая величина | Название метода |
| Масса | Гравиметрия |
| Объем | Титриметрия |
| Равновесный потенциал электрода | Потенциалометрия |
| Поляризационное сопротивление электрода | Полярография |
| Количество электричества | Кулонометрия |
| Электропроводность раствора | Кондуктометрия |
| Поглощение фотонов | Фотометрия |
| Испускание фотонов | Эмиссионный спектральный анализ |
Идентификация веществ основывается на методах качественного распознавания элементарных объектов (атомов, молекул, ионов и др.), из которых состоят вещества и материалы.
Очень часто анализируемую пробу вещества переводят в форму, удобную для анализа, путем растворения в подходящем растворителе (обычно это вода или водные растворы кислот) или сплавлением с каким-либо химическим соединением с последующим растворением.
Химические методы качественного анализа основаны на использовании реакций идентифицируемых ионов с определенными веществами – аналитическими реагентами. Такие реакции должны сопровождаться выпадением или растворением осадка; возникновением, изменением или исчезновением окраски раствора; выделением газа с характерным запахом; образованием кристаллов определенной формы.
Реакции, протекающие в растворах, по способу выполнения классифицируются на пробирочные, микрокристаллоскопические и капельные. Микрокристаллоскопические реакции проводят на предметном стекле. Наблюдают образование кристаллов характерной формы. Капельные реакции выполняются на фильтровальной бумаге.
Аналитические реакции, применяемые в качественном анализе, по области применения делятся на:
1)групповые реакции — это реакции для осаждения целой группы ионов (применяется один реагент, который называется групповым);
2) характерные реакции:
а) селективные (избирательные) — дают одинаковые или сходные аналитические реакции с ограниченным числом ионов (2- 5 шт.);
б) специфичные (высокоселективные) — избирательны по отношению к одному компоненту.
Селективных и специфичных реакций немного, поэтому их применяют в сочетании с групповыми реакциями и со специальными приемами для устранения мешающего влияния компонентов, присутствующих в системе наряду с определяемым веществом.
Несложные смеси ионов анализируют дробным методом, т.е. без предварительного отделения мешающих ионов с помощью характерных реакций определяют отдельные ионы. Мешающий ион – это ион, который в условиях обнаружения искомого дает сходный аналитический эффект с тем же реактивом, либо аналитический эффект, маскирующий нужную реакцию. Обнаружение разных ионов в дробном анализе проводят в отдельных порциях раствора. При необходимости устранения мешающих ионов пользуются следующими способами отделения и маскировки:
1. Перевод мешающих ионов в осадок. В основе лежит различие в величине произведения растворимости получающихся осадков. При этом ПР соединения определяемого иона с реагентом должно быть больше, чем ПР соединения мешающего иона.
2. Связывание мешающих ионов в прочное комплексное соединение. Получаемый комплекс должен обладать необходимой устойчивостью, чтобы осуществить полное связывание мешающего иона, а искомый ион – совсем не реагировать с вводимым реагентом, либо его комплекс должен быть непрочным.
3. Изменение степени окисления мешающих ионов.
4. Использование экстракции. Метод основан на извлечении из водных растворов мешающих ионов органическими растворителями и разделении системы на составные части (фазы), чтобы мешающий и определяемый компонент были в разных фазах.
Преимущества дробного анализа:
- быстрота выполнения, т.к. сокращается время на длительные операции последовательного отделения одних ионов от других;
- дробные реакции легко воспроизводимы, т.е. их можно повторять несколько раз.
Однако в случае трудности подбора: селективных (специфических) реакций обнаружения ионов; маскирующих реагентов; расчета полноты удаления ионов и других причин (сложность смеси) прибегают к выполнению систематического анализа.
Систематический анализ — это полный (подробный) анализ исследуемого объекта, который проводится путем разделения всех компонентов в пробе на несколько групп в определенной последовательности. Деление на группы идет на основе сходства (внутри группы) и различия (между группами) аналитических свойств компонентов. В выделенной группе анализа применяется ряд последовательных реакций разделения, пока в одной фазе останутся лишь компоненты, дающие характерные реакции с селективными реагентами.
Разработано несколько аналитических классификаций катионов и анионов на аналитические группы, в основе которых лежит применение групповых реагентов (т.е. реагентов для выделения в конкретных условиях целой группы ионов). Групповые реагенты в анализе катионов служат как для обнаружения и разделения, а в анализе анионов – только для обнаружения.
Схема деления на группы:
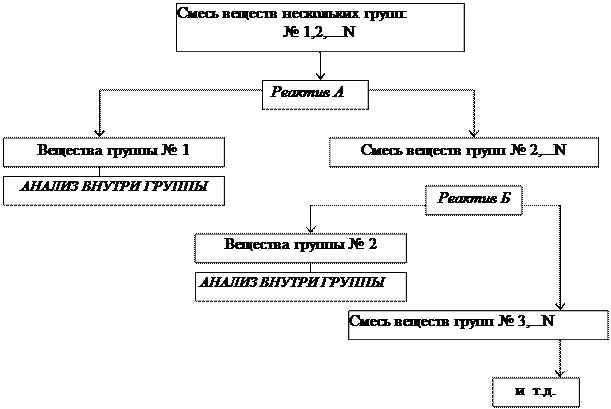
Схема анализа группы:
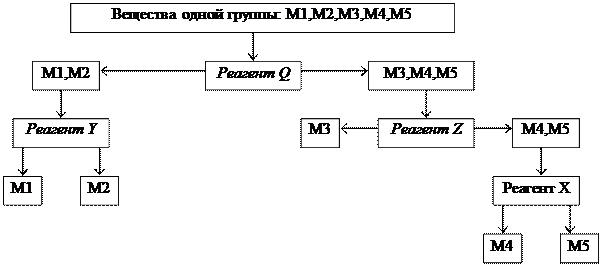 |
Анализ смесей катионов
Групповыми реагентами в качественном анализе катионов являются кислоты, сильные основания, аммиак, карбонаты, фосфаты, сульфаты щелочных металлов, окислители и восстановители. Объединение веществ в аналитические группы основано на использовании сходства и различий в их химических свойствах.
К наиболее важным аналитическим свойствам относятся способность элемента образовывать различные типы ионов, цвет и растворимость соединений, способность вступать в те или иные реакции.
Групповые реагенты выбирают из общих реактивов, поскольку необходимо, чтобы групповой реагент выделял относительно большое число ионов. Основной способ разделения – осаждение, т.е. деление на группы, основано на различной растворимости осадков катионов в определенных средах. При рассмотрении действия групповых реагентов можно выделить следующие группы:
Таблица 1
| Группа | Катионы |
| Сульфатная | Ba2+, Sr2+, Ca2+ |
| Хлоридная | Ag+, Pb2+, Hg2+ |
| Тиосолей | Sn2+, Sn(IV), Sb3+, Sb(V), Hg2+ |
| Гидроксидная | Sn2+, Sn(IV), Pb2+, Sb3+, Sb(V), Cr3+, Al3+, Zn2+ |
| Аммиачная | Co2+, Ni2+, Cu2+, Ag+, Zn2+, Cd2+ |
Кроме того, остаются три катиона (Na+, K+, NH4+) не образующие осадков с указанными групповыми реагентами. Их также можно выделить в отдельную группу.
Помимо указанного общего подхода, при выборе групповых реагентов исходят из значений произведений растворимости осадков, т.к. варьируя условия осаждения, можно разделить вещества из группы действием одного и того же реагента.
Наибольшее распространение получила кислотно-основная классификация катионов. Достоинства кислотно-основного метода систематического анализа: а) используются основные свойства элементов – их отношение к кислотам, щелочам; б) аналитические группы катионов в большей степени соответствуют группам периодической системы элементов Д.И. Менделеева; в) значительно сокращается время проведения анализа по сравнению с сероводородным методом.
Исследование начинают с предварительных испытаний, в которых устанавливают рН раствора по универсальному индикатору и обнаруживают ионы NH4+, Fe3+, Fe2+ специфическими и селективными реакциями.
Разделение на группы. Общая схема на группы дана в табл.2. В анализируемом растворе прежде всего отделяют катионы I и II групп. Для этого 10-15 капель раствора помещают в пробирку и добавляют по каплям смесь 2М HCl и 1М H2SO4. Оставляют осадок на 10 мин, затем его центрифугируют и промывают водой, подкисленной HCl. В осадке смесь хлоридов и сульфатов Ag+, Pb2+, Ba2+, Ca2+. Возможно и присутствие основных солей сурьмы. В растворе катионы III-VI групп.
Из раствора отделяют III группу прибавлением нескольких капель 3%-го H2O2 и избытка NaOH при нагревании и перемешивании. Избыток пероксида водорода удаляют кипячением. В осадке - гидроксиды катионов IV-V групп, в растворе – катионы III и VI групп и частично Ca2+, который может неполностью осадиться в виде CaSO4 при отделении I и II групп.
Из осадка отделяют катионы V группы. Осадок обрабатывают 2н Na2CO3 и затем избытком NH3 при нагревании. Катионы V группы переходят в раствор в виде аммиакатов, в осадке – карбонаты и основные соли катионов IV группы.
Таблица 4
Классификация катионов по кислотно-основному методу
| Группа | Катионы | Групповой реагент | Растворимость соединений |
| I | Ag+, Pb2+, Hg22+ | 2М HCl | Хлориды нерастворимы в воде |
| II | Ca2+ ,Sr2+,Ba2+ | 1M H2SO4 | Сульфаты нерастворимы в воде |
| III | Zn2+, Al3+, Cr3+, Sn2+, Sn(IV), As | 4M NaOH (изб.) | Гидроксиды амфотерны, растворяются в избытке щелочи |
| IV | Mg2+, Mn2+, Fe2+, Fe3+, Вi3+, Sb3+, Sb(V) | 25%-й NH3 | Гидроксиды нерастворимы в избытке NaOH или NH3* |
| V | Co2+, Ni2+, Cu2+, Cd2+ , Hg2+ | 25%-й NH3 (изб.) | Гидроксиды растворяются в избытке NH3 c образованием комплексных соединений |
| VI | Na+, K+ , NH4+ | Нет | Хлориды, сульфаты, гидро-ксиды растворимы в воде |
* Гидроксид магния растворяется в смеси NH3+NH4Cl
Таким образом, после разделения катионов на группы получили четыре пробирки, содержащие: а) осадок хлоридов и сульфатов катионов I-II групп; б) раствор смеси катионов III и VI групп; в) раствор аммиакатов катионов V группы; г) осадок карбонатов и основных солей катионов IV группы. Каждый из этих объектов анализируют отдельно.
Достоинство систематического анализа – получение достаточно полной информации о составе объекта. Недостаток – громоздкость, длительность, трудоемкость. Полностью схемы систематического качественного анализа осуществляются редко. Обычно их используют частично, если есть сведения о происхождении, приблизительном составе образца, а также в учебных курсах аналитической химии.
Анализ смесей анионов

 Общая характеристика изучаемых анионов. Анионы образуются в основном элементами групп IV, V, VI и VII периодической системы. Один и тот же элемент может образовывать несколько анионов, отличающихся своими свойствами. Например, сера образует анионы S2-, SO32-, SO42-, S2O32- и др.
Общая характеристика изучаемых анионов. Анионы образуются в основном элементами групп IV, V, VI и VII периодической системы. Один и тот же элемент может образовывать несколько анионов, отличающихся своими свойствами. Например, сера образует анионы S2-, SO32-, SO42-, S2O32- и др.
Все анионы являются составной частью кислот и соответствующих солей. В зависимости от того, в состав какого вещества входит анион, свойства его существенно меняются. Например, для иона SO42- в составе концентрированной серной кислоты свойственны реакции окисления- восстановления, а в составе солей - реакции осаждения.
Состояние анионов в растворе зависит от среды раствора. Некоторые анионы разлагаются при действии концентрированных кислот с выделением соответствующих газов: CO2 (анион CO32-), H2S (анион S2-), NO2 (анион NO3-) и др. При действии разбавленных кислот анионы MoO42-, Wo42-, SiO32- образуют нерастворимые в воде кислоты (H2MoO4, H2WO4.H2O, H2SiO3). Анионы слабых кислот (CO32-, PO43-, SiO32-, S2-) в водных растворах частично или полностью гидролизуются, например
S2- + H2O ↔ HS- + OH-
Большинство элементов, образующих анионы, обладают переменной валентностью и при действии окислителей или восстановителей изменяют степень окисления, при этом меняется и состав аниона. Хлорид-ион, например, можно окислить до Cl2, ClO-, ClO3-, ClO4-. Иодид-ионы, например, окисляются до I2, IO4-; сульфид–ион S2-― до SO2, SO42-; анионы NO3- можно восстановить до NO2, NO, N2, NH3.
Анионы-восстановители (S2-, I-, Cl-) восстанавливают в кислой среде ионы MnO4- , вызывая их обесцвечивание. Ионы-окислители (NO3-, CrO42-, VO3-, MoO42-) окисляют иодид-ионы в кислой среде до свободного иона, окрашивают дифениламин в синий цвет. Эти свойства используются для качественного анализа. Окислительно-восстановительные свойства хромат-, нитрат-, иодид-, ванадат-, молибдат-, вольфрамат-ионов лежат в основе их характерных реакций.
Групповые реакции анионов. Реагенты по своему действию на анионы разделяют на следующие группы:
1) Реактивы, разлагающие вещества с выделением газов. К таким реактивам относятся разбавленные минеральные кислоты (HCl, H2SO4).
2) Реактивы, выделяющие анионы из растворов в виде малорастворенных осадков (табл.3): а) BaCl2 в нейтральной среде или в присутствии Ba(OH)2 осаждает: SO42-, SO32-, S2O32-, CO32-, PO42-, B4O72-, AsO43-, SiO32-; б) AgNO3 в 2н HNO3 осаждает: Cl- , Br- , I- , S2- (SO42- только в концентрированных растворах).
3) Реактивы-восстановители (KI) (табл.4)
4) Реактивы-окислители (KMnO4, раствор I2 в KI, HNO3(конц), H2SO4).
Анионы при анализе в основном не мешают обнаружению друг друга, поэтому групповые реакции применяют не для разделения, а для предварительной проверки наличия или отсутствия той или иной группы анионов.
Систематические методы анализа смеси анионов, основанные на делении их на группы, используются редко, главным образом для исследования несложных смесей. Чем сложнее смесь анионов, тем более громоздкими становятся схемы анализа. Дробный анализ позволяет обнаружить анионы, не мешающие друг другу, в отдельных порциях раствора.
В полусистематических методах имеет место разделение анионов на группы с помощью групповых реактивов и последующее дробное обнаружение анионов. Это приводит к сокращению числа необходимых последовательных аналитических операций и в конечном итоге упрощает схему анализа смеси анионов.
Таблица 3
Классификация анионов по признаку растворимости солей
| Групповой реагент | Анионы | Групповой признак |
| BaCl2 в нейт-ральной или слабощелочной среде | SO42-, SO32-, S2O32-, CO32-, SiO32-,CrO42-, BO2-, В4O72-, PO43-, AsO43-, AsO33- ,C2O42-, MoO42-, WO42-, VO3- | Соли Ba малораство-римы в воде, соли Ag растворимы в кисло-тах |
| AgNO3 в азотнокислой среде | Cl-, Br-, I-,SCN-, S2-, CN-, ClO-, BrO3-, IO3-, [Fe(CN)6]3-, [Fe(CN)6]4- | Соли Ag малораство-римы в HNO3 |
| - | NO3-, NO2-, MnO4-, ClO-, CH3COO- | Соли Ba и Ag растворимы в воде |
Таблица 4
Классификация анионов по признаку окислительно-восстановительной активности
| Групповой реагент | Анионы | Групповой признак |
| KMnO4 + H2SO4 | Восстановители Cl-, Br-, I-, SCN-, S2-, C2O42-, SO32-, AsO33-, NO2- | Обесцвечивание раствора |
| I2 + крахмал + H2SO4 | S2-, SO32-, S2O32- | Обесцвечивание раствора |
| KI + 1M H2SO4 (крахмал) | Окислители СrO42-, AsO43-, MnO4-, ClO-, ClO3-, BrO3-, IO3-, NO2- | Окрашивание раствора |
| MnCl2 + HCl (конц.) | NO3-, CrO42-, [Fe(CN)6]3-, NO2-, ClO-, ClO3-, BrO3-, IO3-, MnO4- | |
| Инертные CO32-, SO42-, SiO32-, PO43-, F-, BO2- |
Современное состояние качественного анализа не ограничивается классической схемой. В анализе как неорганических, так и органических веществ, часто используются инструментальные методы, такие как люминесцентный, абсорбционно-спектроскопический, различные электрохимические методы, некоторые варианты хроматографии и т. д.. Однако в ряде случаев (полевые, заводские экспресс-лаборатории и др.) классический анализ ввиду простоты, доступности, дешевизны не утратил своего значения.
