Примеры ОВР для самостоятельного решения
1. FeS + HNO3  Fe(NO3)3 + NO + H2SO4+ H2O
Fe(NO3)3 + NO + H2SO4+ H2O
2. KJ + (NH4)2Cr2O7 + H2SO4  J2 + Cr2(SO4)3 + (NH4)2SO4 + K2SO4 + H2O
J2 + Cr2(SO4)3 + (NH4)2SO4 + K2SO4 + H2O
3. PH3 + KMnO4 + H2SO4  H3PO4 + MnSO4 + K2SO4 + H2O
H3PO4 + MnSO4 + K2SO4 + H2O
4. MnO2 + KC1O3 + KOH  K2MnO4 + KC1 + H2O
K2MnO4 + KC1 + H2O
5. C3H5(OH)3 + K2Cr2O7 + H2SO4  CO2 + Cr2(SO4)3 + K2SO4 + H2O
CO2 + Cr2(SO4)3 + K2SO4 + H2O
6. CoCl2 + K2S2O8 + KOH  Co2O3 + K2SO4 + KC1 + H2O
Co2O3 + K2SO4 + KC1 + H2O
7. C2H2 + KMnO, + H2SO4  CO2 + K2SO4 + MnSO4 + H2O
CO2 + K2SO4 + MnSO4 + H2O
8. K2MnO4 + Na2SO3 + H2O  MnO2 + Na2SO4 + KOH
MnO2 + Na2SO4 + KOH
9. NO3 + Р + H2O  H3PO4 +NO
H3PO4 +NO
10. BaFeO4 + KJ + HC1  FeCl2 + BaCl2 + J2 + KC1 + H2O
FeCl2 + BaCl2 + J2 + KC1 + H2O
11. CrO3 + H2O2 + H2SO4  Cr2(SO4)3 + H2O + O2
Cr2(SO4)3 + H2O + O2
12. FeCl3 + H2O2 + KOH  K2FeO4 + KC1 + H2O
K2FeO4 + KC1 + H2O
13. KOH + Cl2  KC1 + KC1O3 + H2O
KC1 + KC1O3 + H2O
14. Na2WO4 + FeSO4 + H2SO4  WO2 + Fe2(SO4)3 + Na2SO4 + H2O
WO2 + Fe2(SO4)3 + Na2SO4 + H2O
15. HJO3+HJ  J2+H2O
J2+H2O
16. КВrO + MnCl2 + KOH  KBr + MnO2 + KC1 + H2O
KBr + MnO2 + KC1 + H2O
17. NaNO2 + NaJ + H2SO4  NO + J2 + Na2SO4 + H2O
NO + J2 + Na2SO4 + H2O
18. J2 + Cl2 + H2O  HJO3 + HC1
HJO3 + HC1
19. N2H4 + AgNO3 + KOH  N2 + Ag + KNO3 + H2O
N2 + Ag + KNO3 + H2O
20. HNO2 + KMnO4 + H2SO4  HNO3 + MnSO4 + K2SO4 + H2O
HNO3 + MnSO4 + K2SO4 + H2O
21. KNO3 + Al + KOH + H2O  NH3 + KAIO2
NH3 + KAIO2
22. Au + HNO3 + HC1  AuCl3 + NO +H2O
AuCl3 + NO +H2O
23. Pt + HNO3 + HC1  PtCL2, + NO + H2O
PtCL2, + NO + H2O
24. As2O3 + Zn + H2SO4  AsH3 + ZnSO4 + H2O
AsH3 + ZnSO4 + H2O
25. K3AsO4 + KJ + H2SO4  K3 AsO3 + J2 + K2SO4 + H2O
K3 AsO3 + J2 + K2SO4 + H2O
26. KJ + H2O + O3  J2+ KOH + O2
J2+ KOH + O2
27. Br2+ C12+ H2O  HBrO3 + HC1
HBrO3 + HC1
28. C1O2+ KOH  KC1O3 + KC1O2+ H2O
KC1O3 + KC1O2+ H2O
29. KMnO4 + H2O2 + H2SO4  MnSO4 + O2 + K2SO4 + H2O
MnSO4 + O2 + K2SO4 + H2O
30. SO2 + Br2 + H2O  HBr + H2SO4
HBr + H2SO4
31. J2 + KOH  KJO3 + KJ + H2O
KJO3 + KJ + H2O
32. KMnO4 + KOH  K2MnO4 + O2 + H2O
K2MnO4 + O2 + H2O
33. Bi2S3 + HNO3  Bi(NO3)3 + NO + S + H2O
Bi(NO3)3 + NO + S + H2O
34. NiS + H2O2 + H2SO4  S + NiSO4 + H2O
S + NiSO4 + H2O
35. Cr2(SO4)3 + K2S2O8+ H2O  K2Cr2O7 + K2SO4 + H2SO4
K2Cr2O7 + K2SO4 + H2SO4
36. AgNO3 + AsH3 + H2O  Ag + H3 AsO4 + HNO3
Ag + H3 AsO4 + HNO3
37. K2Cr2O7 + HCl 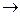 CrCl3 + Cl2 + KCl + H2O
CrCl3 + Cl2 + KCl + H2O
38. KJO3 + Cl2 + KOH  K3JO6 + H2O + KC1
K3JO6 + H2O + KC1
39. Na2SeO3 + Cl2 + NaOH  Na2SeO4 + NaCl + H2O
Na2SeO4 + NaCl + H2O
40. AsH3 + KMnO4 + H2SO4  H3AsO4 + MnSO4 + K2SO4 + H2O
H3AsO4 + MnSO4 + K2SO4 + H2O
41. Hg + NaNO3 + H2SO4  Na2SO4 + Hg2SO4 + NO + H2O
Na2SO4 + Hg2SO4 + NO + H2O
42. H2C2O4 + KC1O3  K2CO3 + CO2 + C1O2 + H2O
K2CO3 + CO2 + C1O2 + H2O
43. Mn(NO3)2 + PbO2 + HNO3  HMnO4 + Pb(NO3)2 + H2O
HMnO4 + Pb(NO3)2 + H2O
44. КClO3 + FeCl2 + HC1  KC1 + FeCl3 + H2O
KC1 + FeCl3 + H2O
45. K2Cr2O7 + NaNO2 + H2SO4 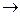 Cr2(SO4)3 + NaNO3 + K2SO4 + H2O
Cr2(SO4)3 + NaNO3 + K2SO4 + H2O
46. KJ + Na2O2 + H2O  J2 + KOH + NaOH
J2 + KOH + NaOH
47. Na2O2 + KMnO4 + H2SO4  O2 + H2O + Na2SO4 + K2SO4 + MnSO4
O2 + H2O + Na2SO4 + K2SO4 + MnSO4
48. SnCl2 + NaOH + Bi(NO3)3 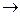 Na2SnO3 + Bi + NaCl + NaNO3 + H2O
Na2SnO3 + Bi + NaCl + NaNO3 + H2O
49. K2MnO4 + H2O  KMnO4 + MnO2 + KOH
KMnO4 + MnO2 + KOH
50. H2S + HNO3  H2SO4 + NO + H2O
H2SO4 + NO + H2O
51. P + KJO3 + KOH  K3PO4 + KJ + H2O
K3PO4 + KJ + H2O
52. N2H4+ J2 + KOH  N2+ KJ + H2O
N2+ KJ + H2O
53. H2O2 + AgNO3 + NH4OH  O2 + Ag + NH4NO3 + H2O
O2 + Ag + NH4NO3 + H2O
54. AsH3 + AuCl3 + KOH  K3AsO3 + Au + H2O
K3AsO3 + Au + H2O
55. NaJ + MnO2 + H2SO4  J2 + MnSO4 + Na2SO4 + H2O
J2 + MnSO4 + Na2SO4 + H2O
56. Br2+ NaOH  H2O + NaBr + NaBrO3
H2O + NaBr + NaBrO3
57. SbCl3 + Hg2Cl2 + NaOH  NaSbO3 + NaCl + Hg + H2O
NaSbO3 + NaCl + Hg + H2O
58. CoBr2 + O2 + KOH + H2O  Co(OH)3 + KBr
Co(OH)3 + KBr
59. Co(NO3)2 + AgNO3 + NaOH  Co(OH)3 + Ag + NaNO3
Co(OH)3 + Ag + NaNO3
60. Co + HNO3 + H2SO4  CoSO4 + N2 + H2O
CoSO4 + N2 + H2O
61. KMnO4 + NaNO2 + Ba(OH)2  BaMnO4 + NaNO3 + KOH + H2O
BaMnO4 + NaNO3 + KOH + H2O
62. KMnO4 + HNO2 + H2SO4  HNO3 + K2SO4 + MnSO4 + H2O
HNO3 + K2SO4 + MnSO4 + H2O
63. Bi(NO3)3 + SnCl2+ NaOH  Bi + Na2SnO3 + NaNO3 + NaCl + H2O
Bi + Na2SnO3 + NaNO3 + NaCl + H2O
64. P + КОН + H2O  PH3 + КН2РО4
PH3 + КН2РО4
65. AgNO3 + КОН + Н2О2  Ag + KNO3 + О2
Ag + KNO3 + О2
66. K2SO3 + KMnO4 + H2SO4  K2SO4 + MnSO4 + Н2О
K2SO4 + MnSO4 + Н2О
67. K2SO3 + KMnO4 + Н2О  K2SO4 + MnO2 + КОН
K2SO4 + MnO2 + КОН
68. K2SO3 + KMnO4 + KOH  K2SO4 + K2MnO4 + H2O
K2SO4 + K2MnO4 + H2O
69. Zn + H2SO4  ZnSO4 + H2S + H2O
ZnSO4 + H2S + H2O
70. Cu + HNO3  Cu(NO3)2 + NO + H2O
Cu(NO3)2 + NO + H2O
71. Zn + HNO3  Zn(NO3)2 + N2O + H2O
Zn(NO3)2 + N2O + H2O
72. Zn + HNO3  Zn(NO3)2 + N2 + H2O
Zn(NO3)2 + N2 + H2O
73. Mg + HNO3  Mg(NO3)2 + NH4NO3 + H2O
Mg(NO3)2 + NH4NO3 + H2O
74. КClO3 + FeSO4 + H2SO4  KC1 + Fe2(SO4)3 + H2O
KC1 + Fe2(SO4)3 + H2O
75. KMnO4 + KCrO2 + H2O  K2CrO4 + MnO(OH)2
K2CrO4 + MnO(OH)2
76. KMnO4 + H2SO4 + H2S  K2SO4 + MnSO4 + S + H2O
K2SO4 + MnSO4 + S + H2O
77. CuS + HNO3  Cu(NO3)2 + NO + H2O + S
Cu(NO3)2 + NO + H2O + S
78. Na2SO3 + Na2Cr2O7 + H2SO4  Na2SO4+ Cr2(SO4)3 + H2O
Na2SO4+ Cr2(SO4)3 + H2O
79. KCIO3 + FeCl2 + HCI  KC1 + FeCl3 + H2O
KC1 + FeCl3 + H2O
80. KMnO4 + HNO2 + H2SO4  HNO3 + K2SO4 + MnSO4 + H2O
HNO3 + K2SO4 + MnSO4 + H2O
81. H2O2 + AgNO3 + NH4OH  O2 + Ag + NH4NO3 + H2O
O2 + Ag + NH4NO3 + H2O
82. KJ + O3 + H2O  J2 + O2 + KOH
J2 + O2 + KOH
83. Na2SO3 + HNO3  Na2SO4 + NO + H2O
Na2SO4 + NO + H2O
84. As2O3 + HOC1 + H2O  H3AsO4 + HCI
H3AsO4 + HCI
85. MnSO4 + Ca(OCl)2 + NaOH  MnO2 + CaCl2 + Na2SO4 + H2O
MnO2 + CaCl2 + Na2SO4 + H2O
86. MnCl2 + KOC1 + KOH  MnO2 + KC1 + H2O
MnO2 + KC1 + H2O
87. MnSO4+ H2O2+ KOH  MnO2+ K2SO4+ H2O
MnO2+ K2SO4+ H2O
88. KJ + CeO2 + HCI  J2 + CeCl3 + KC1 + H2O
J2 + CeCl3 + KC1 + H2O
89. Al + KNO3 + KOH  K3AlO3 + NH3 + H2O
K3AlO3 + NH3 + H2O
90. PbO2 + MnSO4 + HNO3 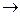 HMnO4 + PbSO4 + Pb(NO3)2 + H2O
HMnO4 + PbSO4 + Pb(NO3)2 + H2O
Пример решения задания 1
Подберите коэффициенты в следующих реакциях ионно-электронным методом. Укажите окислитель и восстановитель, определите направление реакции и вычислите э.д.с.
Решение:
Для подбора коэффициентов к уравнениям ОВР этим методомрекомендуется следующая последовательность действий.
1). Представим схему реакции в ионно-молекулярном виде, записывая в виде ионов только сильные и хорошо растворимые электролиты.
КМnО4 +Н2С2О4 +H2SO4 → МnSО4+ СО2 + K2SO4 +Н2О
K++ МnО4-+H2C2O4 +2H++SO42-→Мn2++ SO42-+СО2 +2K++SO42- + H2O
2). В ионно-молекулярном уравнении ОВР, выделим молекулы и ионы, в которых происходит изменение степеней окисления элементов:
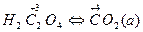
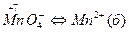
3). Составим материальный баланс для всех элементов в схемах превращений.
Реакция идет в водном растворе в кислой среде, поэтому атомы кислорода и водорода уравниваются молекулами воды (где имеется недоствток атомов кислорода) и ионами водорода противоположным стороне реакции.
В схеме (а) сначала уравниваются атомы углерода 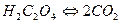 , а затем атома водорода
, а затем атома водорода 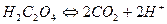
В схеме (б) в левой части имеется 4 атома кислорода, а в левой их нет. Поэтому, в правую часть схемы добавляем 4 молекулы воды, а в левую 8 ионов водорода МпО4- +8H+ →Мп2+ +4Н2О.
4). Составим баланс по зарядам. В схеме (а) подсчитаем суммарные заряды частиц в левой и правой частях схемы и уравняем их путем вычитания определённого числа электронов. В схеме (а) суммарный заряд частиц в левой частиравен нулю, в правой - плюс двум. Равенство зарядов будет наблюдаться в том случае, еслииз левой части схемы убрать два электрона:
Н2С2О4 –2e-→2СО2 +2Н+ (процесс окисления).
восстановитель
В схеме (б) МпО4- +8H+ → Мп2+ +4Н2О подсчитываем суммарные зарядычастиц в левой и правой частях схемы.
Суммарный заряд частиц в левой части равен (+7), а в правой (+2). Равенство зарядов будет соблюдаться в том случае, еслик левой части уравнения прибавить пять электронов:
МпО4- +8H+ +5ē → Mп2+ +4H2O (процесс восстановления).
окислитель
5). Уравняем число отданных ипринятых электронов,найдя наименьшее общее кратное соответствующихчисел имножители к ним. В рассматриваемом примере наименьшее общее кратное для чисел 2 и 5 равно 10. Поэтому для процесса окисления дополнительным множителем будет 5, а для процесса восстановления - дополнительный множитель 2.
6). С учётомэтих множителей произведём суммирование левых и правых частей полученныхуравнений:
5 | Н2С2О4-2 ē →2CO2 + 2Н+
2 | МпО4- + 8H+ + 5 ē →Мп2+ +4H2O
 |
5Н2С2О4+ 2МпО4- + 16H+ →10CО2 +10Н+ +2Мn2+ +8H2O
После приведения подобных членов получим сокращённое ионно-молекулярное уравнение рассматриваемой реакции.
5Н2С2О4 +2МпО4- +6Н+ →10CО2 +2Мп2++8H2O
Коэффициенты этого уравнения соответствуют коэффициентам молекулярного уравнения:
5 Н2С2О4 +2KМпО4 +3H2SO4=10СО2 + 2МпSО4 +K2SO4 +8H2O
Проверка правильности подобранных коэффициентов производится по равенству числа атомов всех элементов в обеих частях уравнения.
э.д.с. = ∆φ = φокс – φвосс = 1,51-(-0,49) = 2 В; ∆φ > 0, следовательно реакция идёт в прямом направлении.
Если реакция протекает в щелочной среде, то для составления материального баланса используются частицы ОН- и Н2О.
В ту часть схемы, в которой не хватает атомов кислорода, добавляют удвоенное число ОН- - групп. В противоположную часть схемы записывают молекулы воды, число которых равно половине количества ОН- - ионов.
Например 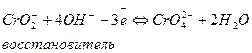 (процесс окисления)
(процесс окисления)
Пример решения задания 2
Вычислите э.д.с. гальванического элемента, составленного из стандартных цинкового и оловянного электродов. Определите направление тока во внешней цепи указанного гальванического элемента. На каком электроде будет идти растворение металла?
Решение:
Табличное значение стандартного электродного потенциала цинка -0,76 В, а олова -0,13 В.
Электродвижующая сила (э.д.с) равна разности двух электродных потенциалов. э.д.с. = ∆φ = φкатода – φанода
э.д.с. = ∆φ = φокислитель – φвосстановитель
Т.к. φокислитель > φвосстановитель, то вычитаем из большей алгебраической величины меньшую:
-0,13 - (-0,76) = 0,63 В.
Э.д.с. цинково-оловянного гальванического элемента равна 0,63 В.
ē


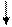
Zn|Zn +2||Sn +2|Sn
-0,76B -0,13B
Цинковая пластина заряжена более отрицательно, чем оловянная. Между ними возникает разность потенциалов. При замыкании системы в цепь электроны с цинковой пластины за счёт разности потенциалов переходят на оловянную. Растворение металла будет наблюдаться на цинковом электроде
Zn - 2ē → Zn2+ (окисление восстановителя);
на оловянном электроде
Sn2+ +2ē → Sn0 (восстановление окислителя)
Пример решения задания 3
Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в кислую среду (НCI)? Дайте схему образующегося при этом гальванического элемента.
Решение:
Исходя из положения металлов в ряду напряжений, определяем, что хром является более активным металлом (φCr+3/Cr=-0,74 В) и в образующейся гальванической паре будет анодом. Медь является катодом ( 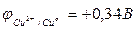 ). Хромовый анод растворяется, а на медном катоде выделяется водород.
). Хромовый анод растворяется, а на медном катоде выделяется водород.
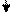

 e–
e–
Cr/Cu, H+;
-0,74 В < 0,34 В
на аноде Cr – 3e → Сr3+ (p-p) процесс окисления
на катоде 2H+ + 2e → H2/Сu процесс восстановления
суммарное ионное уравнение электрохимической коррозии
2Cr/Cu + 6Н+ → 2Сrг3+ + 3Н2/Cu
молекулярное уравнение электрохимической коррозии
2Cr/Cu + 6НCI → 2СrCI3 + 3Н2/Cu
Схема работающего гальванического элемента
e–
 | ||||
 | 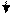 | |||
(-) 2Сг/2Сг3+ | НС1 | (Сu) ЗН2/6Н+ (+)
-0,74 В < 0,34 В
Следовательно, коррозии подвергается хром.
Пример решения задания 4
Какой металл является анодным (катодным) по отношению к покрываемому металлу? Составьте уравнения реакций, протекающих при атмосферной коррозии (во влажном воздухе).
а) Fe покрыт Zn
б) Fe покрыт Cu
Решение:
а) Исходя из положения металлов в ряду напряжений, определяем, что цинк является более активным металлом ( 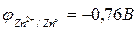 ) и в образующейся гальванической паре будет анодом. Железо является катодом (
) и в образующейся гальванической паре будет анодом. Железо является катодом ( 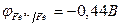 ). Цинк растворяется, а на железе восстанавливается молекулярный кислород.
). Цинк растворяется, а на железе восстанавливается молекулярный кислород.


 e–
e–
Fe|H2O, O2|Zn
–0,44 B > –0,76 B
 |
на аноде 2 Zn – 2ē → Zn2+(p-p) окисление
на катоде 1 О2 + 2Н2О + 4ē → 4ОН– восстановление идет на железе
Итоговое уравнение реакции будет иметь вид
2Zn/Fe + O2 +2H2O → 2Zn(OH)2↓ 
Цинк является анодным покрытием
б) Исходя из положения металлов в ряду напряжений, определяем, что железо является более активным металлом ( 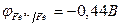 ) и в образующейся гальванической паре будет анодом. Медь является катодом (
) и в образующейся гальванической паре будет анодом. Медь является катодом ( 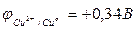 ). Железо растворяется, а на меде восстанавливается молекулярный кислород.
). Железо растворяется, а на меде восстанавливается молекулярный кислород.

 ē
ē
Fe|H2O, O2|Cu
-0,44 B < +0,34 B
 |
на аноде 2 Fe – 2e– → Fe 2+(p-p) окисление
на катоде 1 О2 + 2Н2О + 4е– → 4ОН– восстановление идет на меди
Итоговое уравнение реакции будет иметь вид
2Fe/Сu + O2 + 2H2O → 2Fe(OH)2↓.
Затем идет реакция окисления гидроксида железа (II) в гидроксид железа (III) кислородом воздуха
4Fe(OH)2+ O2 + 2H2O → 4Fe(OH)3↓
Медь является катодным покрытием.
Пример решения задания 5
Вычислите электродный потенциал цинка в растворе ZnCl2, в котором концентрация ионов Zn2+ составляет 7 ∙ 10-2 М.
Решение:
По уравнению Нернста

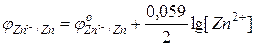
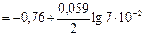 = —0,79 В
= —0,79 В
 Ответ: -0,79В
Ответ: -0,79В
Пример решения задания 6
Составьте схемы электролиза водного раствора CuSO4
а) с инертным анодом.
б) с использованием анода из меди.
Решение:
а) Электролиз водного раствора сульфата меди (II) с инертным анодом;
в растворе происходит диссоциация соли:
CuSO4  Cu2+ + SO42-
Cu2+ + SO42-
Возможные окислители Cu2+ и H2О
Так как 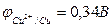 >
> 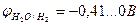 , более сильным окислителем является ион Cu2+, и на катоде происходит восстановление металлической меди.
, более сильным окислителем является ион Cu2+, и на катоде происходит восстановление металлической меди.
| катодная | Cu2+ + 2ē → Cuo | |
| реакция |
Возможные восстановители SO42- и H2O.
Так как 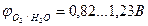 <
< 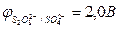 , более сильным восстановителем является вода, и на аноде происходит выделение кислорода из воды
, более сильным восстановителем является вода, и на аноде происходит выделение кислорода из воды
| анодная | 2Н2О – 4ē → О2 + 4Н+ | |
| реакция |
Составим суммарное уравнение реакции, объединив уравнения катодной и анодной реакций с учетом коэффициентов электронного баланса.
краткое ионное уравнение
2Cu2+ + 2H2O  2Cuo(кат.) + O2(ан.) + 4Н+(ан.)
2Cuo(кат.) + O2(ан.) + 4Н+(ан.)
молекулярное уравнение
2CuSO4 + 2H2O  2Cu(кат.) + O2(ан.) + 2H2SO4(ан.)
2Cu(кат.) + O2(ан.) + 2H2SO4(ан.)
б) При электролизе водного раствора сульфата меди (II) с медным анодом в качестве восстановителей будем рассматривать SO42-, H2O и сам анод Cu. Анион SO42- разряжаться не будет, а при сравнении, 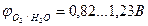 >
> 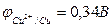 видно, что более сильным восстановителем является медь Cu. На электродах идут следующие процессы:
видно, что более сильным восстановителем является медь Cu. На электродах идут следующие процессы:
на катоде: Cu2+ + 2ē → Cu0
на аноде: Cuo – 2 ē → Cu2+
краткое ионное уравнение
Cu2+ + Cu0  Cu0 + Cu2+
Cu0 + Cu2+
молекулярное уравнение
CuSO4 + H2O +Cu0  Cu0(кат.) + H2O + CuSO4 (анод)
Cu0(кат.) + H2O + CuSO4 (анод)
Рекомендуемая литература
1. Глинка Н.Л., Ермаков А.И. Общая химия: Учебное пособие ждя вузов / Под ред. А.И. Ермакова–29 изд., испр.–М.: Интеграл–Пресс.–2001.–728 с.
2. Глинка Н.И., Рабинович В.А., Рубина Х.М. Задачи и упражнения по общей химии. Учебное пособие для студентов нехим. спец. вузов/Под ред. В.А. Рабиновича, Х.М. Рубиной.–изд. стереотип.–М.: Интеграл–Пресс, 2004.–240 с.
3. Молявко М.А., Шевляков Ф.Б. Окислительно-восстановительные реакции Учебное пособие Уфа, УГНТУ, 2008 г.
ЗАДАНИЕ № 8
по теме: «Классификация неорганических веществ. Свойства»
ЗАДАНИЯ
1. Написать формулы и наименования оксидов указанных кислот:
H2SO4, H3BO3, H4P2O7, HClO, HMnO4.
2. Написать формулы и наименования оксидов, соответствующих указанным гидроксидам: H2SiO3, Cu(OH)2, H3AsO4, H2WO4, Fe(OH)3.
3. Выведите формулы ангидридов и назовите их, зная формулы следующих кислот: H2MoO4, H2Cr2O7, HNO3, HBO2, H2MnO4.
4. Назовите и напишите графические формулы следующих оксидов: N2O, SO2, Mn2O7, CO, SnO2. Приведите соответствующие им гидратные соединения.
5. Назовите и напишите графические формулы следующих оксидов: N2O5, P2O3, CaO, K2O, NO2. Напишите уравнения реакций их гидратации.
6. Какие оксиды можно получить, разлагая при нагревании следующие вещества: Fe(OH)3, Cr(OH)3, Pb(NO3)2, H2SiO3, H2SO4? Напишите уравнения реакций и названия оксидов.
7. С какими из перечисленных ниже оксидов будет реагировать соляная кислота: SiO2, CuO, SO2, Fe2O3, CdO, P2O5, CO2, ZnO? Напишите соответствующие реакции.
8. Могут ли одновременно находиться в растворе: LiOH и NaOH, KOH и SO2, Ca(OH)2 и Ba(OH)2, Sr(OH)2 и NO2, NaOH и P2O5, Ba(OH)2 и CO2? Ответ поясните. Напишите необходимые реакции и названия образующихся соединений.
9. Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: P2O5, CO2, N2O5, SO2, NO2?
10. Написать уравнения реакций, свидетельствующих об основных свойствах FeO, Al2O3, CaO, CrO.
11. Написать уравнения реакций, доказывающих кислотный характер SO3, Mn2O7, P2O5, CrO3.
12. Какие из веществ, формулы которых приведены ниже, будут реагировать с оксидом бария: CO2, NaOH, P2O5, AlCl3, K2O, CuO, H2O? Дайте обоснованный ответ. Напишите уравнения возможных реакций, укажите условия их осуществления и назовите вещества.
13. Какие вещества, формулы которых указаны ниже, будут реагировать с оксидом цинка: NaOH, Fe2O3, Ca(OH)2, SO3, HNO3? Дайте обоснованный ответ. Запишите уравнения возможных реакций, укажите условия их осуществления и назовите вещества.
14. Написать уравнения реакций образования Mg2P2O7, Ca3(PO4)2, Mg(ClO4)2, Ba(NO3)2 в результате взаимодействия:
а) основного и кислотного оксидов;
б) основания и кислотного оксида;
в) основного оксида и кислоты.
15. Укажите какой характер имеют гидраты указанных оксидов: CaO, N2O5, Mn2O7, MnO, SnO, FeO, SiO2, Fe2O3. Напишите формулы гидратов, назовите их.
16. Назовите и напишите графические формулы оксидов: P2O5, CO2, Mn2O7, ZnO. Составьте уравнения реакций взаимодействия их с водой.
17. Напишите реакции солеобразования оксидов следующих элементов:
а) лития, берилия, бора, углерода, азота;
б) натрия, магния, алюминия, фосфора, серы;
в) стронция, серебра, цинка, сурьмы, мышьяка.
18. Назовите оксиды и приведите формулы соответствующих им гидратных соединений: SnO, SnO2, ClO2, SrO, P2O5, N2O5.
19. Напишите эмпирические и графические формулы оксидов:
а) рубидия, цезия, галлия, ртути (II);
б) таллия (I), таллия (III), углерода (II), мышьяка (III);
в) мышьяка (V), сурьмы (V), висмута (III), сурьмы (III);
г) серы (IV), серы (VI), селена (IV), селена (VI);
д) теллура (IV), теллура (VI), хлора (I), хлора (VII);
е) хрома (III), хрома (VI), марганца (II), марганца (IV);
ж) марганца (VII), железа (II), железа (III), олова (IV).
20. Напишите уравнения реакций солеобразования оксидов хрома. Приведите графические формулы этих оксидов.
21. Напишите графические формулы и назовите оксиды:
а) ClO2, P2O5, P2O3, N2O3, SiO2;
б) MgO, PbO2, PbO, GeO2, Pb2O.
22. Назовите соли и напишите их графические формулы:
а) CrCl3, Ba(HCO3)2, MgSO4, AlOHCl2;
б) Fe(NO3)3, CrOHSO4, Ca3(PO4)2, Fe(HS)2;
в) (ZnOH)2SO3, Al(H2PO4)3, CaSiO3, FeCl2;
г) Cr2(HPO4)3, FeOHNO3, Al2(SO4)3, CoS;
д) AlN, (CuOH)2CO3, Al2(SO3)3, Mg(HCO3);
е) MgSO3, Na2HPO4, Al(OH)2Cl, CaSiO3;
ж) Na2S, KClO3, FeOHNO3, Ca(H2PO4)2;
и) FeOHCl, FeHPO4, Cu(AlO2), Al2O3;
к) Cu2(OH)2SO4, Na2Cr2O7, Al2S3, NaHZnO2;
л) Ba(HSO3)2, CrOHSO4, Na2PbO2, Na3AlO3;
м) Mg(ClO4)2, CoOHCl, Al2(CO3)3, ZnF2;
н) PbOHNO3, BaHAlO3, K2Cr2O7, Mg2Si;
п) Al4(SiO4)3, Cd(HS)2, NaH2PO4, K2MnO4;
р) NaMnO4, Al2(ZnO2)3, Fe(HCO3)2, CrOHSO4;
с) Ba(OCl)2, NaVO3, Ca(HSiO3)2, (PbOH)2SO4.
23. Составьте формулы следующих солей:
а) дигидрофосфат кальция, сульфат гидроксоалюминия, сульфат бария, карбонат алюминия;
б) нитрит кальция, гидроалюминат цинка, сульфид бария, хлорид гидроксоцинка;
в) сульфат гидроксоникеля (II), гидросульфид кадмия, карбид железа (III), хромат кальция;
г) хлорид гидроксожелеза (II), силицид магния, дигидроалюминат бария, нитрит цинка;
д) хлорид дигидроксоалюминия, гидросульфит бария, нитрид кальция, манганат железа (III);
е) нитрат гидроксохрома (III), бихромат стронция, дигидросиликат калия, ортоалюминат бария;
ж) метаборат меди (II), ортоалюминат алюминия, хлорид гидроксоцинка (II), сульфид железа (III);
и) гипохлорит алюминия, гидроортоалюминат кальция, бромид ванадия (V), сульфит гидроксомеди (II);
к) метафосфат кальция, перхлорат натрия, гидрокарбонат магния, сульфат дигидроксожелеза (II);
л) ортосиликат магния, нитрит свинца (II), гидрохромат меди (II), бромид гидроксоалюминия;
м) метасиликат цинка, сульфит железа (III), нитрат гидроксожелеза (III), дигидроортоалюминат кобальта (II);
н) метаалюминат кальция, гидросульфид железа (III), перманганат бария, хлорид дигидроксомагния;
п) ортоалюминат магния, гидроксокарбонат алюминия, метафосфат цинка;
р) плюмбит магния, ортосиликат алюминия, нитрат дигидроксохрома (III), гидрофосфат никеля (II);
с) плюмбит алюминия, сульфид алюминия, хлорид дигидроксохрома (III), гидросульфит меди (II).
24. Составить уравнения реакций получения солей: дигидрофосфат натрия, гидросульфит бария, хлорид дигидроксоалюминия, нитрат гидроксохрома (III).
25. Как превратить соли, указанные в задаче 24, в средние?
26. Изменяя соотношение реагирующих веществ по реакции Ca(OH)2+H3PO4 получить кислые, основную и среднюю соли.
27. Назовите приводимые ниже кислые соли и напишите уравнения реакций, при помощи которых можно эти соли превратить в средние: KH2PO4, K2HPO4.
28. Назовите приводимые ниже основные соли и напишите уравнения реакций, при помощи которых можно превратить эти соли в средние: Al(OH)Cl2, Fe(OH)2Cl.
29. Определите массу гидроксида натрия, необходимую для перевода 100 г гидрокарбоната натрия в карбонат натрия.
30. Напишите уравнения реакций образования кислых солей (назовите эти соли):
а) KOH+H2SO3 г) KOH+H3PO3
б) Ca(OH)2+H3PO4 д) NaOH+H2S
в) KOH+CO2 е) Ba(OH)2+H2SO4
31. Напишите уравнения реакций образования основных солей (назовите их):
а) Al(OH)3+HNO3 г) Bi(OH)3+HNO3
б) Mg(OH)2+HCl д) Fe(OH)3+H2SO4
в) Cu(OH)2+HNO3 е) Al(OH)3+H2SO4
32. Составьте формулы средних и кислых бариевых солей следующих кислот: H2SO4, H2S, H3PO4. Напишите реакции получения кислых солей. Назовите их.
33. Переведите в средние следующие соли: NaHCO3, ZnOHCl, Bi(OH)2NO3, Ca(HCO3)2,Mg(HSO3)2. Напишите уравнения соответствующих реакций.
34. Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3, NaHSO4, Fe2(SO4)3, Fe(HCO3)2.
35. Переведите в средние следующие соли: FeOHSO4, Fe(HCO3)2, KHS, (MgOH)2SO4.
36. Напишите формулы средних, кислых и основных солей алюминия следующих кислот: CH3COOH, HNO3, H2SiO3.
37. Напишите формулы основных и кислых кальциевых солей следующих кислот: H2SiO3, H2CO3, H2SO4.
38. Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей K2S, KHS, (MgOH)2SO4, Mg(HSiO3)2.
39. Напишите уравнения реакций в молекулярной и ионной формах, при помощи которых можно осуществить следующие превращения:
а) 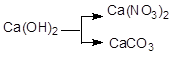 ; б)
; б) 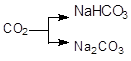 ; в)
; в) 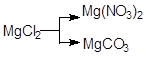 .
.
40. Напишите уравнения реакций в молекулярной и ионной формах, при помощи которых можно осуществить следующие превращения:
а) 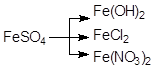 ; б)
; б) 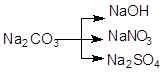 ; в)
; в) 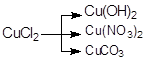 .
.
41. Допишите уравнения реакций взаимодействия веществ в молекулярной и ионной формах:
а) Al2(SO4)3+Ba(NO3)2→…
б) FeCl3+KOH→…
в) Na2CO3+Ca(OH)2→…
г) Na2SiO3+HCl→…
42. Допишите уравнения следующих реакций в молекулярной и ионной формах:
а) CuSO4+NaOH→…
б) CuCl2+K2CO3→…
в) CuO+HNO3→…
г) Cu(OH)2+HCl→…
43. Допишите уравнения реакций образования основных солей в молекулярной и ионной формах:
а) Al(OH)3+HNO3→…
б) Fe2(SO4)3+NaOH→…
в) Zn(OH)2+H3AsO4→…
г) Mg(OH)2+HCl→…
44. Допишите уравнения реакций образования кислых солей в молекулярной и ионной формах:
а) NaOH+H2CO3→…
б) KOH+H3PO4→…
в) KOH+H2SO4→…
г) Ba(OH)2+H3PO4→…
45. Напишите уравнения реакций в молекулярной и ионной формах между следующими веществами: а) хлоридом железа (III) и фосфатом натрия; б) сульфатом меди (II) и фосфатом натрия; в) сероводородом и нитратом меди (II); г) сульфидом калия и сульфатом цинка; д) сульфидом натрия и нитратом магния.
46. Напишите уравнения реакций в молекулярной и ионной формах между следующими веществами: а)гидроксохлоридом магния и гидроксидом натрия; б)гидроксосульфатом железа (III) и серной кислотой; в)гидрофосфатом кальция и гидроксидом кальция; г)гидросульфидом кальция и гидроксидом калия; д)дигидрофосфатом бария и гидроксидом бария.
47. Составьте уравнения реакций в молекулярной и ионной формах между соответствующими кислотами и гидроксидами, приводящими к образованию следующих солей: FeOHSO4, NaHCO3, Mg(NO3)2, Ca3(PO4)2, Al2(SO4)3. .
48. Закончите уравнения следующих реакций получения солей в молекулярной и ионной формах:
а) ZnO+KOH→… в) Sn(OH)2+NaOH→…
б) Al2O3+NaOH→… г) Zn+KOH→…
49. Закончите уравнения реакций получения солей в молекулярной и ионной формах:
а) Ca+H3PO4→… в) Al(OH)3+HClO4→…
б) CaO+HNO3→… г) Ba(OH)2+H3AsO4→…
50. Напишите уравнения реакций образования средних солей между следующими веществами: а) силикатом натрия и азотной кислотой; б) гидрокарбонатом калия и бромводородной кислотой; в) гидросульфатом калия и гидроксидом калия; г) гидроксосульфатом алюминия и серной кислотой; д) гидроксоацетатом алюминия и уксусной кислотой.
51. Составить уравнения реакций получения всеми возможными способами следующих солей: сульфат меди (II), нитрат натрия, карбонат кальция.
52. Какие соли можно получить, имея в своем распоряжении CaSO4, AgNO3, K3PO4, BaCl2. Написать уравнения реакций и назвать полученные соединения.
53. Могут ли одновременно находиться в растворе следующие вещества: CuSO4 и BaCl2, Ca(OH)2 и CO2, KOH и H3PO4, KNO3 и CaCl2, NaOH и Na2HPO4, MgOHCl и KOH? Ответ поясните, напишите уравнения реакций и названия полученных веществ.
54. Какова массовая доля (%) хлорида цинка в растворе , полученном при взаимодействии 13 г металлического цинка со 100 г раствора, содержащего 14,6 г HCl?
55. Какая масса раствора HCl с массовой долей 20% израсходована для полного растворения 10 г смеси цинка с оксидом цинка, если известно, что при этом выделилось 2,24 л водорода?
56. Вычислите массовую долю (%) серной кислоты в растворе, полученном растворением 40 г SO3 в 160 г раствора H2SO4 с массовой долей 80%.
57. При действии серной кислоты на 800 г NaCl получено 200 г HCl. Какова массовая доля (%) продукта реакции от теоретического выхода?
58. Какой объем CO2 выделится, если прокалить 200 г CaCO3, содержащего 15% примесей?
59. К 25 мл раствора HCl с массовой долей 10% (плотность 1,047 г/см3) прибавили 30 мл раствора NaOH с массовой долей 10% (плотность 1,109 г/см3). Какова реакция среды после окончания реакции?
60. Вычислите массу оксида кальция, необходимую для получения гидроксида кальция массой 3,7 г.
61. Оксид углерода (II) можно получить при взаимодействии углерода с оксидом железа (III). Составьте уравнение реакции и вычислите, сколько литров оксида углерода (II) образуется из оксида железа (III) массой 80 г.
62. Сколько граммов оксида серы (VI) пошло на образование сульфата калия массой 270г?
63. Вычислите количество оксида алюминия, необходимое для получения Al(NO3)3 массой 213 г.
64. Сколько молей оксида углерода (IV) необходимо для образования Ca(HCO3)2 количеством вещества 0,5 моль?
65. Сколько граммов гидроксида натрия с массовой долей NaOH 10% требуется на нейтрализацию серной кислоты массой 20 г с массовой долей H2SO4 4,9%?
66. Сколько граммов гидроксида натрия получается в результате взаимодействия с водой оксида натрия количеством вещества 0,1 моль?
67. Сколько граммов водорода можно получить при взаимодействии железа массой 11,2 г с соляной кислотой?
68. Сколько литров водорода можно получить при действии избытка разбавленной серной кислоты на цинк массой 24 г?
69. Смесь оксида меди (II) и металлической меди массой 2,5 г обработали раствором соляной кислоты массой 3,6 г (кислота взята в избытке). Сколько кислоты при этом было израсходовано? Каков состав смеси, если меди в ней 20%?
70. При взаимодействии двухвалентного металла массой 1,4 г с кислотой выделился водород объемом 0,56 л. Назовите этот металл.
71. Какое количество серной кислоты потребовалось для осаждения сульфата бария массой 699 г при взаимодействии избытка хлорида бария с серной кислотой?
72. При обработке серной кислотой фосфорита массой 1 кг с массовой долей Ca3(PO4)2 62% был получен суперфосфат Ca3(PO4)2+2CaSO4 массой 0,910 кг. Определите массовую долю (%) выхода суперфосфата от теоретического.
73. Сколько граммов концентрированной азотной кислоты требуется для окисления меди массой 8 г до нитрата меди?
74. Какое количество аммиака и серной кислоты необходимо для образования сульфата аммония массой 26,4 г?
75. Сколько граммов соляной кислоты должно прореагировать с карбонатом кальция, чтобы образовался диоксид углерода массой 132 г?
76. Сколько граммов гидроксида калия необходимо взять для нейтрализации 0,5 моль серной кислоты?
77. К раствору, содержащему хлорид меди (II) массой 5,4 г, прибавили раствор, содержащий сероводород массой 1,7 г. Раствор выпарили. Определите количество и массу образовавшегося осадка.
78. При взаимодействии избытка сульфата калия с раствором нитрата свинца (II) образовался осадок массой 9,09 г. Сколько граммов нитрата свинца (II) содержалось в растворе?
79. К раствору, содержащему 0,2 моль хлорида железа (III), прибавили 0,24 моль гидроксида натрия. Сколько молей гидроксида железа образовалось в результате реакции и сколько граммов хлорида железа (III) осталось в растворе?
80. Сколько литров диоксида углерода образуется при сжигании соединения массой 8 г, состоящего из С (массовая доля 75%) и Н (25%)?
81. Сколько граммов гидроксида калия потребуется для превращения серной кислоты массой 70 г в кислую соль?
82. Каковы масса и состав соли, образующейся при взаимодействии 20 г NaOH и 30 г H2SO4?
83. Через раствор, содержащий 14,8 г Ca(OH)2, пропустили 22,4 л CO2. Каковы состав соли и её масса?
84. Составить уравнения, с помощью которых можно осуществить следующие превращения:
а) Fe(OH)3→Fe2O3→Fe→FeCl3→FeOHCl2→Fe2(SO4)3→Fe(NO3)3;
б) P→P2O5→H3PO4→Ca3(PO4)2→Ca(H2PO4)2→Ca3(PO4)2;
в) Cu(OH)2→CuO→Cu→CuSO4→Cu2(OH)2SO4→Cu(NO3)2;
г) Ca(HCO3)2→CaCO3→CaO→CaCl2→CaCO3→CaSO4;
д) Al2O3→KAlO2→Al(OH)3→AlOHSO4→Al→Al(NO3)3;
е) Zn→ZnSO4→Zn(OH)2→Na2ZnO2→ZnCl2→ZnCO3→ZnO;
ж) CO2→Ca(HCO3)2→CaCO3→CaCl2→Ca(OH)2→CaCO3→CO2;
и) SiO2→Si→Mg2Si→SiH4→SiO2→Na2SiO3→H2SiO3→SiO2;
к) Al→NaAlO2→HAlO2→K[Al(OH)4]→Al2O3→Al→AlCl3→AlOHCl2;
л) Fe→FeO→Fe(NO3)3 → FeSO4→Fe(HSO4)2→Fe2(SO4)3→FeOHSO4;
м) Cu→Cu(NO3)2→Cu(OH)2→CuOHCl→CuCl2→[Cu(NH3)4]Cl2;
н) (NH4)2Cr2O7→Cr2O3→Cr(OH)3→NaCrO2→Na2CrO4→NaHCrO4;
п) NaHCO3→Na2CO3→Na2O→Na2SO4→NaOH→Cr(OH)3→CrOHSO4;
р) KMnO4→MnO2→MnCl2→Mn(OH)4→ MnCl4;
с) ZnO→Al2(ZnO2)3→Zn(OH)2→ZnCl2→ZnOHCl→ZnCl2.
85. Напишите уравнения реакций в молекулярной и ионной формах, при помощи которых можно осуществить следующие превращения:
а) ZnSO4→Zn(OH)2→ZnCl2→Zn→ZnSO4→Zn(OH)2→Na2[Zn(OH)4];
б) AlCl3→Al(NO3)3→Al(OH)3→Na[Al(OH)4]→Al2(SO4)3;
в) Pb(NO3)2→Pb(OH)2→PbO→Na2[Pb(OH)4]→PbSO4.
86. Напишите уравнения реакций в молекулярной и ионной формах, при помощи которых можно осуществить следующие превращения:
а) Fe2(SO4)3→FeCl3→Fe(OH)3→FeOH(NO3)2→Fe(NO3)3;
б) K→KOH→KHSO4→K2SO4→KCl→KNO3;
в) Cu(OH)2→CuOHNO3→Cu(NO3)2→CuSO4→Cu(OH)2→CuO.
87. Напишите уравнения реакций в молекулярной и ионной формах, при помощи которых можно осуществить следующие превращения:
а) Ca→Ca(OH)2→CaCl2→Ca(NO3)2→CaSO4→(CaOH)SO4;
б) Cu→Cu(NO)2→Cu(OH)2→CuSO4→Al2(SO4)3→Al2O3;
в) Mg→MgSO4→MgCl2→MgOHCl→Mg(OH)2→MgO.
88. Напишите уравнения реакций в молекулярной и ионной формах, при помощи которых можно осуществить следующие превращения:
а) CuSO4→CuCl2→ZnCl2→Na2ZnO2→Zn(OH)2→ZnOHCl;
б) Hg(NO3)2→Al(NO3)3→NaAlO2→Al(OH)3→AlOHCl2→AlCl3;
в) ZnSO4→Zn(OH)2→ZnCl2→AlCl3→Al(OH)3→Al2O3.
89. Напишите уравнения реакций в молекулярной и ионной формах, при помощи которых можно осуществить следующие превращения:
а) CuCl2→Cu(OH)2→CuSO4→ZnSO4→Na2[Zn(OH)4]4;
б) Fe(NO3)3→FeOH(NO3)2→Fe(OH)3→FeCl3→Fe(NO3)3;
в) Al2O3→AlCl3→Al(OH)3→NaAlO2→NaNO3.
Варианты заданий
