Адсорбция и ее характеристики. Теории полимолекулярной адсорбции
Адсорбция – самопроизвольное перераспределение компонентов между поверхностным слоем и объемной фазой.
Физическая адсорбция обусловлена действием физических сил притяжения – различными типами ван-дер-ваальсового взаимодействия. Обратима, является экзотермическим процессом (протекающим с выделением теплоты).
Химическая адсорбция (хемосорбция) происходит за счет образования химических связей между молекулами (ионами, атомами) адсорбата и адсорбента. Хемосорбция обычно необратима.
Поглощающее (адсорбирующее) вещество называют адсорбентом, а поглощающееся (адсорбирующееся) – адсорбатом.
Для количественной характеристики адсорбции используются две величины:
1.удельная (гиббсовская) адсорбция Гi: 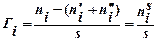 , где ni – количество вещества в реальной системе;
, где ni – количество вещества в реальной системе; 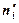 – в фазе I,
– в фазе I, 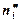 – в фазе II идеальной системы, s – площадь межфазной поверхности.
– в фазе II идеальной системы, s – площадь межфазной поверхности.
Т. е. гиббсовская адсорбция – это избыток вещества в межфазном поверхностном слое, приходящийся на единицу площади поверхности по сравнению с количеством вещества в таком же объеме фазы. 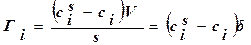 , где – толщина поверхностного слоя,
, где – толщина поверхностного слоя,
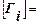 [кг/м2], либо [моль/кг], либо [кг/кг].
[кг/м2], либо [моль/кг], либо [кг/кг].
2.полная адсорбция аi . Полная адсорбция – количество вещества в поверхностном слое толщиной δ в расчете на единицу поверхности или массы адсорбента: 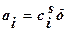
Между Гi и аi существует взаимосвязь: 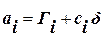 , аi всегда больше0
, аi всегда больше0
Гi может быть больше и меньше 0.
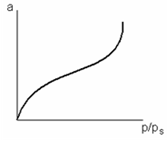
При адсорбции в условиях Т ‹ Ткр имеет место конденсация, и мономолекулярный слой не компенсирует поверхностную энергию è образуется несколько адсорбционных слоев (полимолекулярная адсорбция).
Полимолекулярная адсорбция реализуется в двух случаях:
 |
Для первого случая была предложена потенциальная теория адсорбции Поляни, которая дает термодинамическое описание процесса адсорбции.
Теория Поляни
Основные постулаты:
 все адсорбированное вещество находится в конденсированном состоянии;
все адсорбированное вещество находится в конденсированном состоянии;
 адсорбат у поверхности адсорбента образует адсорбционный объем V.
адсорбат у поверхности адсорбента образует адсорбционный объем V.
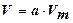 ,
,
где Vm – молярный объем адсорбата в конденсированном состоянии.
У поверхности действует поле адсорбционных сил, интенсивность которых уменьшается с расстоянием. Для характеристики интенсивности поля введен адсорбционный потенциал ε.
Физический смысл ε – это изотермическая работа по переносу 1 моль пара адсорбата из достаточно удаленного от поверхности объема в адсорбционный объем.или это изотермическая работа по сжатию адсорбата от давления р до давления насыщения рs.
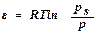 ,
,
где рs – давление насыщенного пара адсорбата в отсутствие адсорбента;
р – равновесное давление, т.е. давление пара адсорбата в присутствии адсорбента.
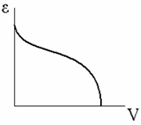 Каждой точке изотермы адсорбции соответствуют определенные значения а и р/рs, которые позволяют получить значения V и ε, т. е. найти зависимость адсорбционного потенциала от объема адсорбата на адсорбенте – потенциальную кривую адсорбции.
Каждой точке изотермы адсорбции соответствуют определенные значения а и р/рs, которые позволяют получить значения V и ε, т. е. найти зависимость адсорбционного потенциала от объема адсорбата на адсорбенте – потенциальную кривую адсорбции.
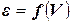
- потенциальная характеристическая кривая данного адсорбента
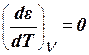 , т. е. адсорбционный потенциал от температуры не зависит.
, т. е. адсорбционный потенциал от температуры не зависит.
Для данного адсорбента и адсорбата, зная изотерму адсорбции при данной температуре Т1, можно рассчитать изотерму для другой температуры Т2. 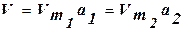 .
.
Рассчитаем а2 и р2 для другой температуры: 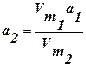 ,
, 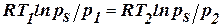
 ê
ê
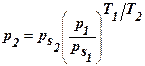
Важная особенность потенциальных кривых была обнаружена Дубининым. Она заключается в том, что характеристические кривые для одного и того же объема адсорбента и разных адсорбатов при всех значениях объемов адсорбата в поверхностном слое находятся в постоянном отношении β: 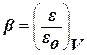 ,где β – коэффициент аффинности, ε – адсорбционный потенциал для одного адсорбата, εо – для другого.
,где β – коэффициент аффинности, ε – адсорбционный потенциал для одного адсорбата, εо – для другого.
Для данного адсорбента, имея β и зная изотерму адсорбции, можно рассчитать изотерму любого другого адсорбата на данном адсорбенте.
D Эта теория не дает уравнения изотермы адсорбции, только термодинамическое описание.
Для второго случая используют теорию БЭТ (теория Брунауэра, Эммета и Теллера).
Теория БЭТ. Согласно этой теории каждый адсорбционный центр sх связывает несколько молекул адсорбента Х, образуя цепочки: 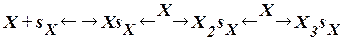
Уравнение, описывающее адсорбцию, выглядит следующим образом:
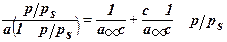 , где
, где 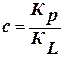 ; Кр – константа адсорбции; КL – константа конденсации.
; Кр – константа адсорбции; КL – константа конденсации.
 Для нахождения констант этого уравнения на основании экспериментальных данных строят график:
Для нахождения констант этого уравнения на основании экспериментальных данных строят график: 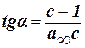
D Это уравнение работает только в интервале 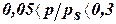 , в котором предполагается отсутствие взаимодействия между цепочками адсорбированных молекул.
, в котором предполагается отсутствие взаимодействия между цепочками адсорбированных молекул.
При 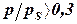 – большая степень заполнения, возникают боковые взаимодействия между молекулами.
– большая степень заполнения, возникают боковые взаимодействия между молекулами.
При 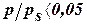 – малая степень заполнения, на величину адсорбции сильно влияют энергетические неоднородности поверхности.
– малая степень заполнения, на величину адсорбции сильно влияют энергетические неоднородности поверхности.
C теория имеет практическое значение, т. к. можно определить удельную поверхность адсорбента. 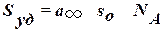 , где sо – площадь, занимаемая молекулой адсорбата.
, где sо – площадь, занимаемая молекулой адсорбата.
Величина а∞ зависит от энергетической равноценности поверхности и наличия пор.
Для характеристики адсорбента используется понятие «пористость» П: 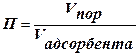
3. Что такое аэрозоли? Чем обусловлены их специфические свойства и как их разрушают?
Аэрозо́ль — дисперсная система, состоящая из мелких твёрдых или жидких частиц, взвешенных в газовой среде (обычно в воздухе). Aэрозоли делят на туманы – системы с жидкой дисперсной фазой и дымы – системы с твердыми частицами. Дымы, в которых частицы дисперсной фазы адсорбировали значительное количество влаги из атмосферы, очевидно, являются одновременно и дымами, и туманами. Такие системы называются смогом.
Размеры частиц в них изменяются от нескольких мм до 10−7 мм. Образуются при механическом измельчении и распылении твёрдых тел или жидкостей, дроблении, истирании, взрывах, горении, распылении в пульверизаторах.
Классификация. По дисперсности аэрозоли с твердой дисперсной фазой разделяют, как и все дисперсные системы, на диспергационные и конденсационные аэрозоли. Диспергационные аэрозоли, образующиеся при измельчении твердых тел или распылении жидкостей имеют довольно крупные частицы и, как правило, полидисперсны. Аэрозоли, полученные методом конденсации из пересыщенных паров или в результате химических реакций обычно являются высокодисперсными системами с более однородными по размеру частицами.
Основные характеристики. Дисперсионную среду характеризуют химическим составом, температурой, давлением, степенью ионизации, параметрами внешних физических полей, полем скоростей течения, наличием турбулентности и ее параметрами, наличием и величиной градиентов температуры и концентрации компонентов. Важнейшие параметры дисперсной фазы аэрозоли - объемная доля частиц φυ и их массовая доля φm, число частиц в единице объема (счетная концентрация) nр, средний размер частицы dp и ее электрический заряд.
Свойства. Важнейшие свойства аэрозолей - способность частиц сохраняться во взвешенном состоянии, перемещаться преим. как единое целое и при столкновении прилипать друг к другу или к какой-либо поверхности с вероятностью, равной единице.
Газовая дисперсионная среда вносит ряд своеобразных черт в свойства аэрозолей.1.- это их лиофобность и отсутствие эффективных путей стабилизации. 2- размер частиц дисперсной фазы r по порядку величины соизмерим с длиной свободного пробега молекул в газе Λм. Движение частиц определяется числом Кнудсена: Kn= Λм/2r. При Kn˂ 10-2 применимы законы механики, закон Стокса:
υ=F/6πηr.
Для частиц малого размера Kn˃102, применимы законы молекулярно-кинетической теори:
υ=F/2mM* Λr/ΰM, где mM- масса молекул газа, ΰM – средняя скорость их движения, Λr- длина свободного пробега частицы.
Для большенства наиболее важных аэрозольных систем число Кнудсена имеет промежуточное значение: 10-2˂Kn ˂ 102, тогда используется формула Кеннингема:
υ=F/6πηr (1+ 1,26Kn)
Многие специфические свойства аэрозолей связаны с особенностями дисперсионной среды — воздуха, его низкой вязкостью и малой электрической проводимостью. Лиофобность аэрозолей и высокие коэффициенты диффузии в газовой фазе обусловливают большую скорость процессов изотермической перегонки и коагуляции, следствием которых является нарушение агрегативной устойчивости системы. В реальных аэрозолях концентрация дисперсной фазы, как правило, составляет не более 108 — 106 частиц/см3. Размер частиц в большинстве аэрозолей оказывается в интервале 10~5 — 10~3 см: более крупные частицы быстро оседают, а мелкие исчезают вследствие коагуляции.
Аэрозольные частицы способны приобретать электрический заряд, если они образуются конденсацией на ионах. Незаряженные частицы могут захватывать газовые ионы, направленно движущиеся к частицам во внешнем поле или диффундирующие в среде. Диспергационные частицы могут приобретать заряд и в процессе образования - при разбрызгивании жидкостей (баллоэлектрический эффект) или распылении порошков (трибоэлектрический эффект), при освещении (фотоэффект), радиоактивном распаде и т.п.
Важнейшие процессы, происходящие в аэрозолях — седиментация, броуновское движение, коагуляция и испарение частиц.
Важнейшие оптические свойства аэрозолей — рассеяние и поглощение ими света.
Разрушение аэрозолей происходит путем:
• рассеивания под действием воздушных течений или вследствие одноименных зарядов частиц;
• седиментации;
• диффузии к стенкам сосуда;
• коагуляции;
• испарения частиц дисперсной фазы (в случае аэрозолей летучих веществ).
Инерционное осаждение проводится с помощью центробежных отделителей, называемых циклонами. Они представляют собой металлические цилиндры, в которых аэрозоль по спирали движется сверху вниз, при этом частицы оседают на стенках цилиндра, а очищенный газ по специальной трубе выводится из циклона. Высокопроизводительный циклон может обеспечить практически полное улавливание частиц крупнее 30 мкм, частицы размерами 5 мкм улавливаются на 80%, а размерами 2 мкм - менее чем на 40%. К инерционному осаждению можно отнести и мокрое пылеулавливание. В этих случаях главная задача состоит в том, чтобы частицы привести в соприкосновение с каплями жидкости, вместе с которыми они удаляются из аппарата. Мокрое пылеулавливание осуществляется двумя способами:
1) для частиц с d 2-5 мкм используют скрубберы (полые или с насадкой), мокрые циклоны, барботажные или пенные пылеулавливатели;
2) для частиц с d 2 мкм используются скоростные пылеулавливатели.
Ультразвуковые установки используются для разрушения туманов. К недостаткам этого метода следует отнести следующее: он не разрушает сильно разбавленные аэрозоли, оставляя нескоагулированной самую вредную - высокодисперсную часть аэрозоля.
Электростатическое осаждение с успехом применяют для улавливания пылей и туманов в цементной, сернокислотной, металлургической промышленности и особенно для улавливания летучей золы из дымовых газов электростанций. Аэрозоль пропускают между электродами, создающими поле высокого напряжения (70-100 кВ), возникает коронный разряд, при котором катод испускает огромное количество электронов. Электроны ионизируют молекулы газа. Образующиеся анионы адсорбируются частицами аэрозоля, затем отрицательно заряженные частицы осаждаются на положительно заряженной стенке трубы, после чего собираются в специальном бункере.
Конденсационный метод пылеулавливания. В этом методе используется свойство аэрозольных частиц выступать в роли центров конденсации водяных паров. Механизм конденсационного метода состоит в том, что за счет конденсации водяных паров трудноуловимый тонкодисперсный аэрозоль превращается в туман, капли которого размерами 2-5 мкм легко осаждаются простыми методами. Достоинством этого метода является то, что превратить в капли тумана можно частицы любой природы и любого размера.
4. С каким коллоидно-химическим явлением в организме человека связано чувство жажды? Охарактеризуйте это явление и его особенности в коллоидных системах по сравнению с истинными растворами.
С точки зрения коллоидно-химической физиологии человека его организм представляет собой сложный комплекс коллоидных систем в их постоянном динамическом взаимодействии..
Коллоиды поступают в организм в виде пищевых веществ и в процессе пищеварения превращаются в специфические, характерные для данного организма коллоиды.
ЖАЖДА – своеобразное чувство, вызывающее потребность в питье и указывающее на нарушение водного баланса организма.
Ощущение жажды связано с изменением состава крови и тканевых жидкостей. А кровь является типичными примером ткани организма, где одни коллоиды находятся внутри других. Решающим фактором здесь, по-видимому, является повышение осмотического давления крови, возникающее в результате повышения в ней концентрации поваренной соли, мочевины и других веществ. (Осмотическое давление равно тому давлению, которое производила бы дисперсная фаза (растворенное вещество), если бы она в виде газа при той же температуре занимала тот же объем, что и коллоидная система (раствор).)
Действительно, экспериментально удается показать, что введение в кровь гипертонических растворов поваренной соли, хлористого кальция, мочевины и глюкозы вызывает ощущение жажды .
В истинных растворах, отделенных от растворителя полупроницаемой перегородкой, может быть измерено осмотическое давление, величина которого зависит от концентрации растворенного вещества и для разбавленных растворов описывается уравнением Вант Гоффа:
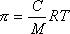 где С – массовая концентрация, кг/м3.
где С – массовая концентрация, кг/м3.
Для коллоидных систем можем записать
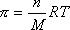 где n – частичная концентрация частиц/м3.
где n – частичная концентрация частиц/м3.
Для коллоидных систем осмотическое давление не превышает 10 Па, в то время, как для истинных растворов при с = 102 моль/м3 оно достигает 105 Па.
В нашем мозгу есть «центр жажды». Он реагирует на количество соли в крови. Когда там происходят изменения, он посылает сообщения в заднюю часть горла. Ответные сообщения оттуда возвращаются в мозг, и такая оперативная связь позволяет нам сказать, что мы чувствуем жажду.
5. Изобразите формулы двух мицелл гидрозоля С, полученного из растворов веществ А и В в случае избытка вещества А или В. А - CaCl2, В - H2SO4, С - CaSO4
Реакция: CaCl2+ H2SO4 = CaSO4 + 2HCl
В первом случае(избыток А): {m[CaSO4]nCa2+2(n-x)Cl-}2x+2xCl-
В избытке B: {m[CaSO4]nSO42-2(n-x)H+}2x-2xH+
Осадок образовался в результате коагуляции гидрозоля ZnS. Напишите формулу частиц осадка, если известно, что промывание его водой приводит к получению коллоидного раствора с положительно заряженными частицами. Назовите метод получения гидрозоля и запишите его схему.
В данном случае используют метод химической конденсации. Он основан на проведении химических реакций, сопровождающихся образованием нерастворимых или малорастворимых веществ. Для этой цели используются различные типы реакций – разложения, гидролиза, окислительно-восстановительные и т.д.
В этом случае – гидролиз.
Реакция: ZnS + H2O = H2S + ZnO
Формула полученной мицеллы: {m[Zn(OH)2] nZn2+ (n - x) S2-}2x+ * xS2-}
Билет 6
