Алкины, их общая формула. Этин (ацетилен), строение молекулы, химические свойства (горение, реакции присоединения), получение и применение
Алкины– нециклические углеводороды, имеющие одну тройную связь и общую формулу СnН2n-2. Тройная связь – сочетание одной σ–связи и двух π –связей.
Гомологический ряд алкинов:
СН≡СН этин
СН≡С-СН3 пропин
СН≡С-СН2-СН3 бутин-1
СН≡С-СН2-СН2-СН3 пентин-1
Изомерия алкинов:
а) Изомерия положения тройной связи
СН≡С-СН2-СН2-СН3 пентин-1 СН3-С≡С-СН2-СН3 пентин-2
б) Изомерия углеродного скелета
СН≡С – СН-СН3 3-метилбутин-1
СН3
Химические свойства ацетилена. Для алкинов характерны реакции окисления, присоединения и полимеризации.
Реакции окисления
а) Горение
2C2H2 + 5O2 → 4CO2 + 2H2O
б) Обесцвечивание KMnO4
Реакции присоединения
а) Гидрирование
СН≡СН+ H2 → CH2 = CH2
этин этен
б) Присоединение галогенов
СН≡СН + Cl2 → CHCl = CHCl
этин 1,2- дихлорэтен
в) Присоединение галогеноводородов
СН≡СН + HCl → CH2 = CHCl
Хлорэтен
Полимеризация
3C2H2 → C6H6 (бензол)
Получение ацетилена
а) Из метана: 2CH4 → C2H2 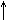 + 3H2
+ 3H2 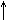
б) Из карбида кальция: CaC2 + 2HOH → C2H2 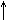 + Ca(OH)2
+ Ca(OH)2
Применение ацетилена: сварка и резка металлов, получение уксусного альдегида, пластмасс, растворителей, лекарств, красителей и многих других веществ.
Арены (ароматические углеводороды), их общая формула. Бензол, его структурная формула, свойства, применение.
Арены или ароматические углеводороды – это соединения, молекулы которых содержат ароматическую связь – единую π-электронную систему из шести электронов. Ароматическая связь прочнее π –связи и менее прочная, чем σ–связь. Для бензола и его гомологов характерны реакции замещения, реакции присоединения идут с трудом.
Общая формула аренов СnН2n-6
Простейший представитель - бензол.
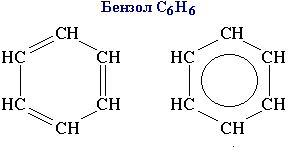 Бензол – бесцветная, нерастворимая в воде жидкость с приятным запахом. Легче воды. Ядовит.
Бензол – бесцветная, нерастворимая в воде жидкость с приятным запахом. Легче воды. Ядовит.
Гомологи бензола: метилбензол C6H5-CH3
этилбензол C6H5-C2H5
пропилбензол C6H5-C3H7
Химические свойства бензола.
Окисление.
Бензол горит, но не обесцвечивает KMnO4.
Реакции замещения.
а) Галогенирование: С6Н6+Cl2 → HCl+C6H5Cl (хлорбензол)
б) Нитрование: С6Н6+HONO2 → H2O + C6H5NO2 (нитробензол)
Реакции присоединения
а) Галогенирование: С6Н6+3Cl2 → C6H5Cl6 (гексахлорциклогексан)
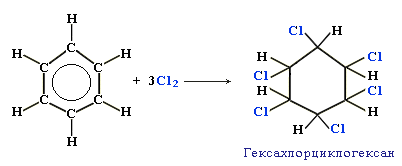
б) Гидрирование: С6Н6+3Н2 → C6H12 (циклогексан)
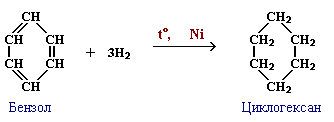
Получение бензола:
а) из ацетилена: 3 C2H2 → C6H6
б) из циклогексана: C6H12 → C6H6 + 3H2
Применение бензола:
Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений, применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Основные положения теории химического строения органических веществ
