Определение щелочности и кислотности воды
Объемный (количественный) анализ.Объемный метод количественного анализа основан на точном измерении реагирующих веществ, концентрация одного из которых известна. Растворы с точно установленной концентрацией называются титрованными, т.к. они используются для определения концентрации исследуемых растворов, то их называют рабочими или стандартными. Процесс прибавления стандартного титрованного раствора к раствору исследуемого вещества называется титрованием. Титрование ведется до достижения точки эквивалентности, т.е. до того момента, когда количество прибавленного стандартного раствора будет эквивалентно количеству определяемого вещества согласно уравнению реакции. Необходимое условие объемного анализа – точная фиксация точки эквивалентности, поэтому используют реакции, конец которых характеризуется определенным внешним признаком (изменение окраски, выпадение осадка). Часто для фиксации точки эквивалентности употребляют специальные вещества, изменяющие цвет или другие свойства с изменением концентрации исследуемого иона. Такие вещества называются индикаторами.
Требования к реакциям, применяемым в объемном анализе:
- возможность тем или иным способом фиксировать точку эквивалентности;
- количественное течение реакции до равновесия, характеризующегося соответствующей величиной константы равновесия реакции;
- можно применять только те реакции, которые протекают с достаточной скоростью;
- при титровании не должны протекать побочные реакции, делающие точное вычисление результатов анализа невозможным.
В зависимости от типа реакции, которая протекает при титровании, выделяют методы объемного анализа:
1 Нейтрализация. В основе метода лежит реакция нейтрализации:
Н+ + ОН- = Н2О
Этим методом определяют кислотность, щелочность, карбонатную жесткость воды.
2 Окислительно-восстановительные методы, в основе которых применяют окислительно-восстановительные реакции, в ходе которых исследуемое вещество количественно переводят в окисленную или восстановленную форму.
3 Осаждение. Объемные определения метода основаны на осаждении определенного иона в виде труднорастворимого соединения.
4 Комплексометрия. В методе исследуемый ион связывается водным реактивом в малодиссоциированный комплекс. Метод применяется при определении жесткости воды Mg2+, Ca2+, иона Fe3+.
Измерение объемов. Для точного измерения в объемном анализе используют бюретки, пипетки, мерные колбы.
1 Бюретки служат для титрования и представляют собой цилиндрические трубки с суженным концом, отсчет ведется сверху вниз.
2 Пипетки служат для точного отмеривания каких-либо определенных объемов исследуемого раствора.
3 Мерные колбы служат для разбавления исследуемого раствора до определенного объема.
Щелочность обусловлена присутствием в воде веществ, содержащих гидроксоанион, а также веществ, реагирующих с сильными кислотами (соляной, серной). К таким соединениям относятся:
1 сильные щелочи (KOH, NaOH) и летучие основания (например, NH3×H2O), а также анионы, обуславливающие высокую щелочность в результате гидролиза в водном растворе при рН > 8,4 (СО32–, S2–, PO43–, SiO32– и др.);
2 слабые основания и анионы летучих и нелетучих слабых кислот (HCO3–, H2PO4–, HPO42–, CH3COO–, HS–, анионы гуминовых кислот и др.).
Щелочность пробы воды измеряется в моль-экв/л или моль-экв/л и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,05 или 0,1 ммоль-экв/л), израсходованной на нейтрализацию раствора.
При нейтрализации до значений рН = 8,0 – 8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом величина называется свободной щелочностью. При нейтрализации до значений
рН = 4,2 – 4,5 в качестве индикатора используют метиловый оранжевый. Определяемая данным образом величина называется общей щелочностью. При рН = 4,5 проба воды имеет нулевую щелочность.
Соединения первой группы из приведенных выше определяются по фенолфталеину, второй – по метилоранжу.
Щелочность природных вод в силу их контакта с атмосферным воздухом и известняками обусловлена, главным образом, содержанием в них гидрокарбонатов и карбонатов, которые вносят значительный вклад в минерализацию воды. Соединения первой группы могут содержаться также в сточных и загрязненных поверхностных водах.
Экспериментальная часть
Определение свободной щелочности. В коническую колбу наливают 100 мл исследуемой воды, прибавляют 2 – 3 капли индикатора фенолфталеина и титруют раствором HCl до обесцвечивания раствора. Расчет производят по формуле:
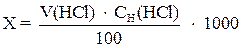
где х – свободная щелочность воды, мг-экв/л;
V (HCl) – объем HCl, мл;
СH(HCl) – молярная концентрация эквивалента раствора HCl, моль/л;
100 – объем взятой пробы.
Определение общей щелочности. В ту же колбу, где проводили титрование, добавляют 2 – 3 капли индикатора метилового оранжевого и продолжают титрование до тех пор, пока окраска индикатора из желтой не перейдет в оранжевую.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 1. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 1 – Результаты титрования
| № | V (H2О), мл | V (HСl), мл | V (HCl) средн., мл |
| 100,0 | |||
Перед каждым титрованием заполняют бюретку раствором до нулевого деления шкалы.
Расчет производят по формуле:
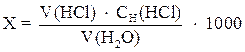
где х – общая щелочность воды, мг-экв/л;
V (HCl) – объем HCl, мл;
СH(HCl) – молярная концентрация эквивалента раствора HCl, моль/л;
V (H2О) – взятый объем воды, мл.
Аналогично щелочности при анализе сточных и технологических вод определяют кислотность воды.
Кислотность воды обусловлена содержанием в воде веществ, реагирующих с гидроксоанионами. К таким соединениям относятся:
1) сильные кислоты: соляная HCl, азотная HNO3, серная H2SO4;
2) слабые кислоты: уксусная CH3COOH; сернистая H2SO3; угольная H2CO3; сероводородная H2S и т.п.;
3) катионы слабых оснований: аммоний NH4+; катионы органических аммонийных соединений.
Кислотность пробы воды измеряется в моль-экв/л или моль-экв/л и определяется количеством сильной щелочи (обычно используют растворы КОН или NaOH с концентрацией 0,05 или 0,1 моль/л), израсходованной на нейтрализацию раствора.
Различают свободную и общую кислотность. Свободная кислотность определяется при титровании до значений рН = 4,3 – 4,5 в присутствии в качестве индикатора метилового оранжевого. В этом диапазоне оттитровываются HCl, HNO3, H2SO4, H3PO4.
Общая кислотность определяется при титровании до значений рН = 8,2 – 8,4 в присутствии фенолфталеина в качестве индикатора. В этом диапазоне оттитровываются слабые кислоты – органические, угольная, сероводородная, катионы слабых оснований.
Естественная кислотность обусловлена содержанием слабых органических кислот природного происхождения (например, гуминовых кислот). Загрязнения, придающие воде повышенную кислотность, возникают при кислотных дождях, при попадании в водоемы не прошедших нейтрализацию сточных вод промышленных предприятий и др.
Экспериментальная часть
Определение свободной кислотности. В коническую колбу наливают 100 мл исследуемой воды, прибавляют 2 – 3 капли индикатора метилового оранжевого и титруют раствором щелочи до перехода оранжевой окраски раствора в желтую.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 2. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 2 – Результаты титрования
| № | V (H2О), мл | V (NaOH), мл | V (NaOH) средн., мл |
| 100,0 | |||
Расчет проводят по формуле:
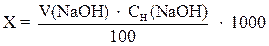
где х – свободная кислотность воды, мг-экв/л;
V (NaOH) – объем раствра щелочи, мл;
СH(NaOH) – молярная концентрация эквивалента раствора щелочи, моль/л;
100 – объем взятой пробы.
Определение общей кислотности. В коническую колбу наливают 100мл исследуемой воды, прибавляют 2 – 3 капли индикатора фенолфталеина и титруют раствором щелочи появления малиновой окраски индикатора.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 3. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 3 – Результаты титрования
| № | V (H2О), мл | V (NaOH), мл | V (NaOH) средн., мл |
| 100,0 | |||
Расчет проводят по формуле:
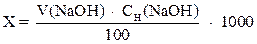
где х – свободная кислотность воды, мг-экв/л;
V (NaOH) – объем раствора щелочи, мл;
СH(NaOHl) – молярная концентрация эквивалента раствора щелочи, моль/л;
100 – объем взятой пробы.
Вопросы для самоконтроля
1 На титрование 100 мл исследуемой воды пошло 20 мл 0,1 н раствора соляной кислоты по метиловому оранжевому. Определите щелочность воды.
2 Вода содержит (мг/л): CaSO4 – 50, Ca(HCO3)2 – 100, Mg(HCO3)2 – 25. Какова величина щелочности.
3 Какова общая щелочность воды, содержащей СО32- – 50 мг/л, НСО3- – 122 мг/л.
4 При определении щелочности воды было израсходовано 0,1 н кислоты на титрование 100 мл пробы с индикатором фенолфталеином 3 мл и дополнительно с индикатором метиловым оранжевым 5 мл. Рассчитайте общую и отдельные виды щелочности воды.
5 Вода имеет жесткость равную 9 мг-экв/л. Постоянная жесткость составляет 60 % от общей жесткости (соли натрия отсутствуют). Какова величина щелочности воды.
6 В 1 л воды содержится 210 мг NaHCO3 и 5,3 мг Na2CO3. Определите общую щелочность воды.
ЛАБОРАТОРНАЯ РАБОТА
