Электролитическая диссоциация сильных и слабых электролитов в водных растворах. Вычисление концентраций ионов.
Электролитическая диссоциация – это полный или частичный распад растворенного вещества на ионы. По признаку электрической проводимости все растворы можно разделить на две большие группы: растворы электролитов (проводят электрический ток) и растворы неэлектролитов (ток не проводят). Например, чистая вода, а также водные растворы сахара, глюкозы, спирта и ряда других веществ ток практически не проводят (в растворах отсутствуют ионы), поэтому эти вещества – неэлектролиты.
Напротив, раствор хлороводорода (соляная кислота) – это не просто электролит, а сильный электролит: более 99% молекул HCl в растворе распадаются на ионы H+ и Cl–. Поэтому обратную стрелку в уравнении диссоциации HCl изображают короткой или вообще не пишут. Такие же свойства у растворов HBr (бромоводородная кислота) и HI (иодоводородная кислота).
Однако вполне похожее соединение – фтороводород HF – не проявляет свойств сильного электролита и в растворе ток проводит плохо. Здесь, наоборот, в уравнении диссоциации нужна более длинная обратная стрелка: 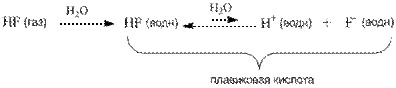
Мы видим, что наряду с процессом диссоциации на ионы, в растворах происходит и обратный процесс – ассоциация ионов в нейтральные молекулы. Таким образом, электролитическая диссоциация – это обратимая химическая реакция или динамическое равновесие, к которому применимы те же закономерности, что и к любому другому химическому равновесию. Например, для описания процесса диссоциации можно использовать константу равновесия Кр, которая в данном случае будет называться константой диссоциации Кд:
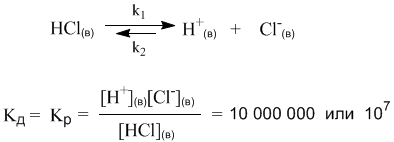
Маленький индекс (в) означает «водный» – т.е. молекулы и ионы находятся в водном растворе. Часто его не пишут, полагая, что и так все понятно.
Итак, константа диссоциации Кд – это частный случай константы равновесия. Значения Кд для сильных электролитов часто бывают настолько велики, что их не удается измерить непосредственно. Эти значения получают косвенно, из термодинамических данных, и в разных справочниках они могут отличаться, хотя и остаются очень большими. Для нас здесь важно то обстоятельство, что ионов H+ и Cl– в растворе очень много (их концентрация – в числителе дроби), а недиссоциированных молекул [HCl] чрезвычайно мало.
Напротив, Кд фтороводорода намного меньше единицы. Следовательно, в растворе много недиссоциированных молекул HF и мало ионов H+ и F–.
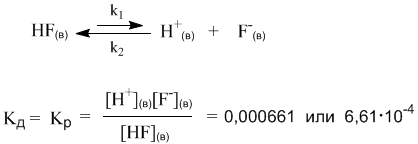
Оба раствора (HCl и HF) являются растворами электролитов, но HCl – сильный электролит, а HF – слабый. На примере этих двух веществ мы видим, что хорошую (или плохую) диссоциацию в растворе, как и хорошую (или плохую) растворимость трудно предсказать только по формуле вещества.
Водоро́дный показа́тель— мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр: 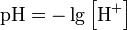
Уравнения реакций.
3K2S+KMnO4+4H2SO4=3S+MnSO4+3K2SO4+4H2O
FeCl3+H2O= Fe(OH)Cl2 + HCl
Билет №14.
Планетарная модель атома водорода Резерфорда, постулаты Бора.
В первой атомной теории Дальтона предполагалось, что мир состоит из определенного числа атомов — элементарных кирпичиков — с характерными свойствами, вечными и неизменными.
Эти представления решительно изменились после открытия электрона. Все атомы должны содержать электроны. Но как электроны в них расположены? Физики могли лишь философствовать, исходя из своих познаний в области классической физики, и постепенно все точки зрения сошлись на одной модели, предложенной Дж.Дж. Томсоном. Согласно этой модели, атом состоит из положительно заряженного вещества, внутрь которого вкраплены электроны (возможно, они находятся в интенсивном движении), так что атом напоминает пудинг с изюмом. Томсоновскую модель атома нельзя было непосредственно проверить, но в ее пользу свидетельствовали всевозможные аналогии.
Рассеяние a-частиц при прохождении через фольгу вызывается кулоновскими силами, т.е. электрическим взаимодействием частицы и заряда атома. Гравитационное взаимодействие в 10 33 раз меньше, поэтому фактически роли не играет.
Какие же заряды в атоме вызывают рассеяние a-частиц? Электроны не могут этого сделать, так как их масса много меньше массы частицы: ma=7350me.При взаимодействии с электронами быстро движущаяся частица не изменяет направление своего движения.
Причиной рассеяния a-частицы является их взаимодействие с положительно заряженными частицами атома, занимающими очень малую область атома. Резерфорд назвал эту область ядром. В ядре сосредоточена почти вся масса атома и весь положительный заряд. Обобщив результаты опытов, Резерфорд предложил следующую модель строения атома:
1. в центре атома - положительно заряженное ядро:
-заряд ядра q = Z·e, где Z-порядковый номер элемента в таблице Менделеева, e =1.6·10-19 Кл - элементарный заряд;
-размер ядра 10-13 см;
-масса ядра фактически равна массе атома.
2. электроны движутся вокруг ядра по круговым и эллиптическим орбитам, как планеты вокруг Солнца:
-электроны удерживаются на орбите кулоновской силой притяжения к ядру, создающей центростремительное ускорение.
-число электронов в атоме равно Z ( порядковый номер элемента)
-электроны движутся с большой скоростью, образуя электронную оболочку атома.
Модель атома, предложенная Резерфордом, называется планетарной.
В 1913 году Бор показал, что несовпадение с экспериментом выводов, основанных на модели Резерфорда, возникла потому, что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел.
Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения.
Законы микромира - квантовые законы! Эти законы в начале 20 столетия еще не были установлены наукой. Бор сформулировал их в виде трех постулатов. дополняющих ( и "спасающих") атом Резерфорда.
Первый постулат:
Атомы имеют ряд стационарных состояний соответствующих определенным значениям энергий: Е1, Е2...En. Находясь в стационарном состоянии, атом энергии не излучает, несмотря на движение электронов.
Второй постулат:
В стационарном состоянии атома электроны движутся по стационарным орбитам, для которых выполняется квантовое соотношение:
m·V·r = n·h/2·p (1)
где m·V·r =L - момент импульса, n=1,2,3..., h-постоянная Планка.
Третий постулат:
Излучение или поглощение энергии атомом происходит при переходе его из одного стационарного состояния в другое. При этом излучается или поглощается порция энергии (квант), равная разности энергий стационарных состояний, между которыми происходит переход: e = h·u = Em-En (2)
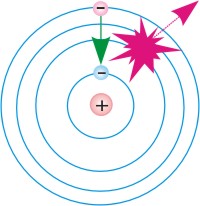
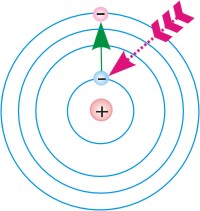 Схемы перехода атома:
Схемы перехода атома:
1.из основного стационарного состояния в возбужденное,
2.из возбужденного стационарного состояния в основное.
