Закон Мозли. Роль закона Мозли. Современная формулировка Периодического закона.
Закон Мозли —закон, связывающий частоту спектральных линий характеристического рентгеновского излучения атома химического элемента с его порядковым номером.
Согласно Закону Мозли, корень квадратный из частоты 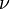 спектральной линии характеристического излучения элемента есть линейная функция его порядкового номера
спектральной линии характеристического излучения элемента есть линейная функция его порядкового номера 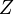 :
: 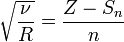
где 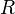 — постоянная Ридберга,
— постоянная Ридберга, 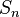 — постоянная экранирования,
— постоянная экранирования, 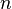 — главное квантовое число. На диаграмме Мозли зависимость от
— главное квантовое число. На диаграмме Мозли зависимость от 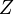 представляет собой ряд прямых (К-, L-, М- и т. д. серии, соответствующие значениям n = 1, 2, 3,...).
представляет собой ряд прямых (К-, L-, М- и т. д. серии, соответствующие значениям n = 1, 2, 3,...).
Закон Мозли явился неопровержимым доказательством правильности размещения элементов в периодической системе элементов Д. И. Менделеева и содействовал выяснению физического смысла 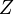 .
.
В соответствии с Законом Мозли, рентгеновские характеристические спектры не обнаруживают периодических закономерностей, присущих оптическим спектрам. Это указывает на то, что проявляющиеся в характеристических рентгеновских спектрах внутренние электронные оболочки атомов всех элементов имеют аналогичное строение.
Более поздние эксперименты выявили некоторые отклонения от линейной зависимости для переходных групп элементов, связанные с изменением порядка заполнения внешних электронных оболочек, а также для тяжёлых атомов, появляющиеся в результате релятивистских эффектов (условно объясняемых тем, что скорости внутренних электронов сравнимы со скоростью света).
В зависимости от ряда факторов — от числа нуклонов в ядре атома (изотопический сдвиг), состояния внешних электронных оболочек (химический сдвиг) и пр. — положение спектральных линий на диаграмме Мозли может несколько изменяться. Изучение этих сдвигов позволяет получать детальные сведения об атоме
Закон мозли раскрыл физический смысл закона Менделеева, исследовал рентгеновские спектры некоторых эл-тов: квадратный корень из частоты для каждой линии спектра ентгеновских лучей есть приблизительно линейная ф-я атомного номера.
В результате появилась совр. формулировка П. з.: св-ва элементов, а также образуемых ими простых и сложных в-в находятся в периодич. зависимости от заряда ядра.
Физический смысл закона: хим св-ва элементов с увеличением порядкового номера периодически повторяются за счет повторения электронной конфигурации внешнего энергетического уровня.
2. Особенности протекания химических реакций в растворах электролитов. Признаки протекания реакций в растворах электролитов.
Электролиты – это вещества, растворы которых обладают ионной проводимостью.
Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакций часто используют так называемые ионные уравнения реакций. Написанием ионных уравнений подчёркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами.
С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода:
1. Образующиеся вещества – сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы.
2. Одно (или несколько) из образующихся веществ – газ, осадок или слабый электролит (хорошо растворимый в воде).
Например, можно рассмотреть две реакции:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2, (1)
2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2. (2)
В ионной форме уравнения (1) и (2) запишутся следующим образом:
2Al + 2Na+ + 2OH- + 6 H2O = 2Na+ + 2[Al(OH)4]- + 3H2, (3)
2Al + 2K+ + 2OH- + 6 H2O = 2K+ + 2[Al(OH)4]- + 3H2, (4)
В данном случае алюминий не является электролитом, а молекула воды записывается в недиссоциированной форме потому, что является очень слабым электролитом. Неполярные молекулы водорода практически нерастворимы в воде и удаляются из сферы реакции. Одинаковые ионы в обеих частях уравнений (3), (4) можно сократить, и тогда эти уравнения преобразуются в одно сокращённое ионное уравнение взаимодействия алюминия с щелочами:
2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2. (5)
Очевидно, что при взаимодействии алюминия с любой щелочью реакция будет описываться уравнением (5). Следовательно, ионное уравнение, в отличие от молекулярного, относится не к одной какой-нибудь реакции между конкретными веществами, а к целой группе аналогичных реакций. В этом его большая практическая ценность и значение, например благодаря этому широко используются качественные реакции на различные ионы.
Так, при помощи ионов серебра Ag+ можно обнаружить присутствие в растворе ионов галогенов, а при помощи ионов галогенов можно обнаружить ионы серебра; при помощи ионов бария Ba2+ можно обнаружить ионы SO2- и наоборот.
С учётом вышеизложенного можно сформулировать правило, которым удобно руководствоваться при изучении процессов, протекающих в растворах электролитов.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
3. Как можно увеличить процентное содержание аммиака в равновесной системе
N2 + 3H2 Û 2NH3 + 92,4 кДж?
-----------------------------------------------------------------------------------------------------------------
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 22
