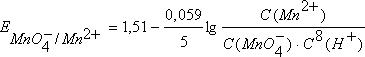Вопрос 33 Электродные потенциалы и механизмы их возникновения.
Для определения направления и полноты протекания окислительно-восстановительных реакций между окислительно-восстановительными системами в водных растворах используются значения электродных потенциалов этих систем.Механизм возникновения электродных потенциалов, их количественное определение, процессы, которые сопровождаются возникновением электрического тока или вызваны электрическим током, изучаются особым разделом химии – электрохимией. Сочетая электрод, представляющий исследуемую окислительно-восстановительную систему, со стандартным водородным электродом, определяют электродный потенциал Е данной системы. Для того, чтобы можно было сравнивать окислительно-восстановительные свойства различных систем по их электродным потенциалам, необходимо, чтобы последние также были измерены при стандартных условиях. Таковыми обычно являются концентрация ионов, равная 1 моль/л, давление газообразных веществ 101,325 кПа и температура 298,15 К. Потенциалы, измеренные в таких условиях, носят название стандартных электродных потенциалов и обозначаются Ео. Они часто называются также окислительно-восстановительными или редокс-потенциалами, представляя собой разность между редокс-потенциалом системы при стандартных условиях и потенциалом стандартного водородного электрода.. Стандартный электродный потенциал – это потенциал данного электродного процесса при концентрациях всех участвующих в нем веществ, равных единице.Стандартные электродные потенциалы окислительно-восстановительных систем приводятся в справочной литературе. Эти системы записаны в форме уравнений полуреакций восстановления, в левой части которых находятся атомы, ионы или молекулы, принимающие электроны (окисленная форма) Электрохимический ряд напряжений характеризует свойства металлов в водных растворах:чем меньше электродный потенциал металла, тем легче он окисляется и труднее восстанавливается из своих ионов;металлы, имеющие отрицательные электродные потенциалы, т.е. стоящие в ряду напряжений левее водорода, способны вытеснять его из разбавленных растворов кислот;каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал.При условиях, отличающихся от стандартных, численное значение равновесного электродного потенциала для окислительно-восстановительной системы, записанной в форме , определяется по уравнению Нернста:
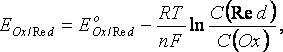
Где 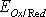 и
и 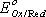 - соответственно электродный и стандартный потенциалы системы; R – универсальная газовая постоянная; Т – абсолютная температура; F – постоянная Фарадея; n – число электронов, участвующих в окислительно-восстановительном процессе.С(Red) и C(Ox) – молярные концентрации соответственно восстановленной и окисленной форм соединения. Например, для окислительно-восстановительной системы
- соответственно электродный и стандартный потенциалы системы; R – универсальная газовая постоянная; Т – абсолютная температура; F – постоянная Фарадея; n – число электронов, участвующих в окислительно-восстановительном процессе.С(Red) и C(Ox) – молярные концентрации соответственно восстановленной и окисленной форм соединения. Например, для окислительно-восстановительной системы
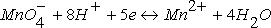 уравнение Нернста имеет вид
уравнение Нернста имеет вид