Растворимость в многокомпонентной системе с одноименными ионами
Рассмотрим расчет растворимости соли Мn+Аn- в системе, содержащей хорошо растворимую соль М¢Аn¢ с одноименным анионом. Пример такой системы: BaSO4–Na2SO4–H2O. Катионы Mz+переходят в раствор только из осадка, поэтому их концентрация определена растворимостью: [Mz+] = n+S. Концентрация анионов в растворе складывается из двух составляющих: растворимость труднорастворимой соли n-S, и концентрация соли М¢An¢, которую обозначим n¢С¢. После подстановки в формулу (97) получаем:
| L = (n+S)n+(n-S + n¢C¢)n-. | (99) |
Растворимость находят путем решения степенного уравнения (99). Если растворимость меньше концентрации соли с одноименным ионом в 100 и более раз, то есть n-S < 0,01n¢C¢, то пренебрегают в сумме меньшим слагаемым и получают:
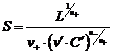 . . | (100) |
Аналогично вычисляют растворимость в присутствии одноименного катиона. Следует запомнить, что растворимость в присутствии одноименных ионов всегда понижается.
5.6.3. Условия образования осадков
Если произведение концентраций ионов, образующих труднорастворимую соль, выше равновесного значения, то есть правая часть в формуле (97) больше левой, то в системе будет происходить образование осадка. При противоположном знаке неравенства осадок будет растворяться.
Значение рН, при котором из данного раствора начинает выпадать осадок гидроксида, называют рН гидратообразования. Для расчета этой характеристики используют следующие формулы:
| М(ОН)z(т) Û Мz+(р-р) + zOH-(р-р); | (101) |
| L = [Mz+][OH-]z. | (102) |
Из формулы (102) находят концентрацию ионов гидроксила, а затем рН гидратообразования.
5.6.4. Примеры решения задач
Пример 1. Рассчитать растворимость флюорита CaF2 в воде, в 0,1 моль/л растворе NaF.
Решение. 1. Запишем уравнение диссоциации CaF2, отвечающее равновесному растворению флюорита:
CaF2(т) ® Сa2+(p-p) + 2F-(p-p),
согласно которому [Ca2+] = S; [F-] = 2S.
2. Составим уравнение произведения растворимости CaF2: L = [Ca2+][F-]2 = S×(2S)2 = 4S3, из которого вычислим растворимость флюорита в воде:
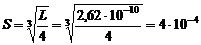 моль/л.
моль/л.
3. Для расчета растворимости в 0,1 М растворе NaF, которую обозначим S1, произведем следующие подстановки в уравнение произведения растворимости: L = [Ca2+][F-]2;
[Ca2+] = S1; [F-] = 2S1 + CNaF = 0,1 моль/л, так как S1<< 0,1.
Получаем: L = S1(0,1)2, откуда
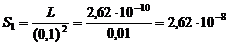 моль/л.
моль/л.
Пример 2. Вычислить рН гидратообразования для раствора сульфата никеля с концентрацией 0,01 моль/л (  = 1,2×10-16).
= 1,2×10-16).
Решение. 1. Осадок гидроксида образуется из раствора NiSO4 в результате установления следующего равновесия:
Ni(OH)2 ® Ni2+ + 2OH-.
2. Гидратообразование начинается при условии:
[Ni2+]×[OH-]2 = L, откуда
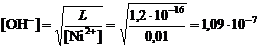
рОН = -lg[OH-] = -lg1,09×10-7 = 6,96; рH = 14 - рОН = 7,04.
Пример 3. Произойдет ли осаждение малорастворимого AgNO2 (L = 1,6×10-4) по реакции AgNO3 + KNO2 ® AgNO2 + KNO3 при смешивании равных объемов 0,02 М растворов AgNO3 и KNO2?
Решение. 1. Для образования осадка AgNO2 должно выполняться условие [Ag+][NO2-] ≥ L. Проверим, выполняется ли это условие в нашей задаче.
2. После смешивания равных объемов растворов AgNO3 и KNO2 общий объем раствора будет в два раза больше каждого из исходных, и концентрации AgNO3 и KNO2 соответственно уменьшатся в два раза, т. е. будут равны 0,01 моль/л. [Ag+][NO2-] = 0,01×0,01 = 1×10-4 > L, следовательно, осадок образуется.
Задачи для решения
I. Вычислить растворимость предложенного соединения при температуре 25°С в воде и в присутствии электролита с одноименным ионом
| № задачи | Твердая фаза | Электролит | Концентрация р-ра |
| 430. | AgBr | AgNO3 | 0,01 г/л |
| 431. | Ag2SO4 | K2SO4 | 0,01 М |
| 432. | PbI2 | KI | 0,05 н. |
| 433. | CaCO3 | Na2CO3 | 0,005 н. |
| 434. | BaCrO4 | K2CrO4 | 0,001 М |
| 435. | BaSO4 | BaCl2 | 0,001 г/л |
| 436. | Ag2CO3 | Na2CO3 | 0,1 % |
| 437. | CaSO4 | K2SO4 | 0,02 % |
| 438. | PbBr2 | KBr | 0,003 н. |
| 439. | PbSO4 | Pb(NO3)2 | 0,005 М. |
| 440. | ZnS | ZnCl2 | 0,09 г/л |
| 441. | Hg2SO4 | Na2SO4 | 0,001 г/л |
| 442. | PbCO3 | K2CO3 | 0,02 г/л |
| 443. | BaSO3 | Na2SO3 | 0,028 М |
| 444. | AgIO3 | KIO3 | 0,009 н. |
| 445. | CaHPO4 | CaCl2 | 0,01 г/л |
| 446. | CuI | KI | 0,01 М |
| 447. | TlI | NaI | 0,05 н. |
| 448. | Hg2I2 | Hg2(NO3)2 | 0,005 н. |
| 449. | Ag2S | AgNO3 | 0,001 М |
| 450. | TlBr | NaBr | 0,001 г/л |
| 451. | BaSO3 | Na2SO3 | 0,003 н. |
| 452. | Ag3PO4 | AgNO3 | 0,005 М. |
| 453. | PbS | Pb(NO3)2 | 0,09 г/л |
| 454. | CaF2 | NaF | 0,001 г/л |
| 455. | LaF3 | NaF | 0,02 г/л |
| 456. | Ca3(PO4)2 | CaCl2 | 0,028 М |
| 457. | Na3AlF6 | NaCl | 0,1 % |
| 458. | AgBrO3 | NaBrO3 | 0,02 % |
| 459. | AgCl | KCl | 0,003 н. |
| 460. | AgI | KI | 0,005 М. |
| 461. | Ag2CrO4 | AgNO3 | 0,09 г/л |
| 462. | CdCO3 | Cd(NO3)2 | 0,001 г/л |
| 463. | CuCl | KCl | 0,02 г/л |
| 464. | Hg2Br2 | KBr | 0,028 М |
| 465. | Hg2Cl2 | KCl | 0,009 н. |
| № задачи | Твердая фаза | Электролит | Концентрация р-ра |
| 466. | PbCl2 | KCl | 0,01 г/л |
| 467. | TlCl | KCl | 0,01 М |
| 468. | Ba3(AsO4)2 | Ba(NO3)2 | 0,05 н. |
| 469. | Ba3(PO4)2 | K3PO4 | 0,005 н. |
| 470. | Bi2(C2O4)3 | Bi(NO3)3 | 0,001 М |
| 471. | Li3PO4 | K3PO4 | 0,001 г/л |
| 472. | In4[Fe(CN)6]3 | K4[Fe(CN)6] | 0,003 н. |
| 473. | NaBeF6 | NaNO3 | 0,01 г/л |
| 474. | K2SiF6 | KNO3 | 0,01 М |
| 475. | Hg2CrO4 | Hg2(NO3)2 | 0,05 н. |
| 476. | SnS | Na2S | 0,0005 н. |
| 477. | Pb3(PO4)2 | K3PO4 | 0,01 М |
| 478. | Tl2S | Na2S | 0,0005 н. |
| 479. | Zn3(AsO4)2 | ZnSO4 | 0,009 н. |
II. Определить рН гидратообразования:
| № задачи | Соль | Концентрация соли, моль/л | № задачи | Соль | Концентрация соли, моль/л |
| 480. | AlCl3 | 0,01 | 481. | MgCl2 | 0,38 |
| 482. | Be(NO3)2 | 0,52 | 483. | MnSO4 | 0,062 |
| 484. | Bi(NO3)3 | 0,046 | 485. | NiCl2 | 0,031 |
| 486. | CaCl2 | 0,023 | 487. | Pb(NO3)2 | 0,004 |
| 488. | CdCl2 | 0,15 | 489. | Sb(NO3)3 | 0,002 |
| 490. | CoSO4 | 0,006 | 491. | Sc(NO3)3 | 0,001 |
| 492. | Cr2(SO4)3 | 0,059 | 493. | SnCl2 | 0,012 |
| 494. | Cu(NO3)2 | 0,038 | 495. | SnCl4 | 0,003 |
| 496. | FeSO4 | 0,064 | 497. | Sr(NO3)2 | 0,055 |
| 498. | FeCl3 | 0,26 | 499. | Tl(NO3)3 | 0,001 |
| 500. | LaCl3 | 0,008 | 501. | Y(NO3)3 | 0,0012 |
| 502. | ZrOCl2 | 0,056 | 503. | ZnSO4 | 0,022 |
504. Определить концентрацию карбоната натрия, необходимую для того, чтобы снизить растворимость карбоната серебра в 100 раз по сравнению с растворимостью в воде.
505. Чему равно произведение растворимости и растворимость иодида серебра в воде, если концентрация иодида серебра в 0,001 н. растворе иодида калия равна 1,5×10-13 моль/л?
506. Во сколько раз меньше растворимость гидроксида кобальта (II) в растворе с рН=12, чем в растворе с рН=10.
507. Какое из оснований – гидроксид железа (II) или гидроксид железа (III) – и во сколько раз лучше растворимо в щелочном растворе с рН=9?
508. Определить растворимость и произведение растворимости гидроксида кальция, если его насыщенный раствор имеет рН=12,4.
509. Определить растворимость гидроксида никеля в воде и в растворе с рН=1.
510. При каком значении рН растворимость гидроксида кадмия снизится в 20 раз по сравнению с растворимостью в воде.
511. Определить произведение растворимости и растворимость в воде сульфата кальция, если концентрация соли в 0,2 н. растворе серной кислоты составляет 6×10-5 моль/л.
512. Определить произведение растворимости и растворимость сульфата свинца в воде, если концентрация соли в 0,004 н. растворе серной кислоты равна 8×10-6 моль/л.
513. Во сколько раз растворимость хлорида серебра в 0,001 н. растворе хлорида натрия меньше, чем в воде?
514. Определить растворимость гидроксида кобальта (II) в воде и в 0,1 н. растворе сульфата кобальта.
515. Определить растворимость гидроксида железа (II) в воде и в 0,05 М растворе сульфата железа (II).
516. Смешаны равные объемы 0,02 н. растворов хлорида кальция и сульфата натрия. Образуется ли при этом осадок сульфата кальция?
517. Во сколько раз растворимость оксалата кальция Са2С2О4 в 0,1 М растворе оксалата аммония меньше, чем в воде?
518. Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе хлорида серебра, если прибавить к нему столько соляной кислоты, чтобы концентрация хлорид ионов в растворе стала равной 0,03 моль/л?
519. Растворимость бромида таллия (I) в воде равна 1,9×10-3 моль/л. определить его произведение растворимости и растворимость в 0,1 н. растворе нитрата таллия (I).
520. Растворимость карбоната кальция в воде составляет 4,15×10-6 моль/л. Определить его произведение растворимости и растворимость в 0,001 М растворе карбоната натрия.
521. К 150 мл насыщенного раствора AgCl прибавили 10 мл раствора NaCl концентрацией 3 %. Сколько молей серебра останется в растворе?
522. К 125 мл насыщенного раствора PbSO4 прибавлено 5 мл раствора H2SO4 концентрацией 0,5 %. Сколько молей свинца останется в растворе?
523. К 20 мл Na2AsO4 прилили 30 мл 0,12 М раствора AgNO3. Какая масса мышьяка останется в растворе?
524. К 50 мл 0,02 М раствора CaCl2 прибавили 50 мл 0,03 М раствора сульфата калия. Какова остаточная концентрация сульфата кальция?
525. Выпадет ли осадок Mg(OH)2 при действии на 0,2 М раствор сульфата магния равным объемом 0,2 М раствора гидроксида аммония?
526. Насыщенный раствор CaSO4 смешали с равным объемом раствора, содержащего 0,0248 г (NH4)2C2O4 в 1 л. Произойдет ли образование осадка CaC2O4?
527. При какой концентрации ионов магния начнется выпадение осадка Mg(OH)2 из раствора, имеющего рН = 8,7?
528. При какой концентрации хромат-ионов начнется выпадение осадка PbCrO4 из 0,1 М раствора нитрата свинца (II)?
529. Будет ли осаждаться SrSO4 при добавлении 5 мл насыщенного раствора сульфата кальция к 20 мл раствора, содержащего 0,5 экв. кальция?
530. В 200 мл раствора содержится по 0,02 экв. хлорида и оксалата натрия. К раствору добавляют нитрат серебра. Какова будет остаточная концентрация хлорид-ионов и когда начнется осаждение Ag2C2O4?
531. Какое вещество начнет осаждаться первым при постепенном приливании нитрата серебра к раствору, в 1 л которого содержится 0,01 моль KCl и 0,1 моль K2CrO4?
532. В 100 мл раствора содержится 0,01 экв. ионов Ba2+ и Sr2+. Сколько молей K2CrO4 следует ввести в раствор, чтобы осадить барий?
533. В 100 мл раствора содержится 0,01 экв. ионов Sr2+. Сколько молей K2CrO4 следует ввести в раствор, чтобы осадить стронций?
