Лабораторно-практическое занятие № 11. «Кислотно-основные взаимодействия» (3ч)
Цель:сформировать знания о кислотности и основности органических соединений, обусловливающие их физико-химические и биологические свойства, формировать умения определять кислотность и основность в зависимости от различных факторов.
Вопросы для обсуждения:
1. Кислотность и основность по Бренстеду-Лоури.
2. Кислоты Бренстеда и общие закономерности зависимости их силы от их строения природа атома в кислотном центре, стабилизация аниона за счет сопряжения, эффект сольватации).
3. Основания Бренстеда и общие закономерности зависимости их силы от их строения (природа атома в кислотном центре, стабилизация аниона за счет сопряжения, эффект сольватации).
4. Слабые кислоты и основания в биологических системах.
5. Кислоты и основания Льюиса.
Материалы и примеры для самостоятельного изучения
Пример 1. Расположите следующие кислоты Брёнстеда – этанол, бутанол, глицерин, фенол, уксусная кислота – в порядке убывания их кислотности в водном растворе.
Решение. В данной задаче предлагается сравнить кислотность трех классов органических соединений: спиртов, фенолов, карбоновых кислот. Данные соединения являются ОН-кислотами:
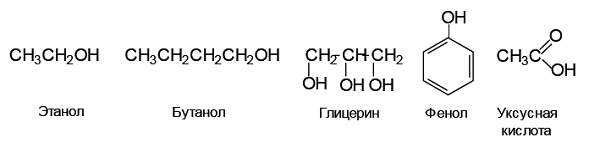
Значит, основными факторами, определяющим стабильность аниона, являются – влияние заместителя и влияние растворителя. Для сравнительной оценки кислотности предложенных соединений следует рассмотреть стабильность соответствующих анионов.
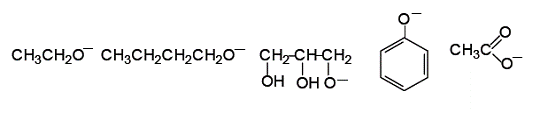
Фенолы являются более сильными кислотами по сравнению с алифатическими спиртами из-за большей стабильности феноксид-иона, в котором отрицательный заряд делокализуется с участием атомов углерода бензольного кольца (р,  -сопряжения).
-сопряжения).
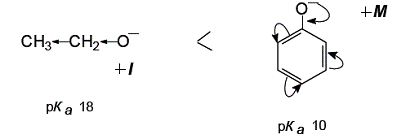
Карбоновые кислоты являются более сильными кислотами по сравнению с фенолами за счет стабилизации карбоксилат-иона, в котором отрицательный заряд за счет р, 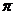 -сопряжения распределен поровну между двумя атомами кислорода:
-сопряжения распределен поровну между двумя атомами кислорода:
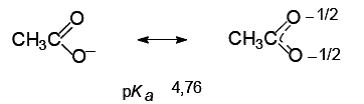
Сравним силу кислотных свойств в ряду различных спиртов, основываясь на стабильности соответствующих анионов:
Глицерин является более сильной кислотой по сравнению с этанолом, так как глицерат-ион является более стабильным, чем этоксид-ион, за счет наличия в глицерине двух электроноакцепторных гидроксильных групп (–I-эффект), которые способствуют делокализации отрицательного заряда.
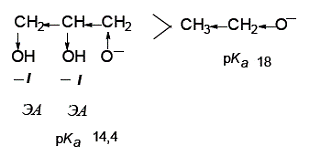
Этанол является более сильной кислотой, чем бутанол, так как небольшой по размеру этоксид-ион лучше сольватирован по сравнению с бутоксид-ионом:
Спирты, как слабые кислоты, не реагируют с гидроксидами металлов. Однако спирты способны реагировать со щелочными металлами:
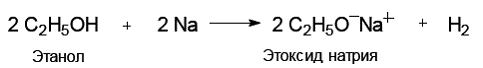
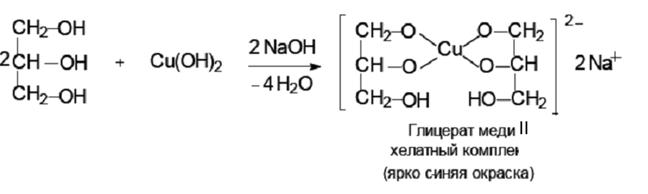
Фенолы в целом более сильные кислоты, чем спирты, реагируют со щелочами:

Карбоновые кислоты обладают более сильными кислотными свойствами, чем спирты и фенолы. Они могут взаимодействовать не только с гидроксидами металлов, но и с солями слабых кислот:
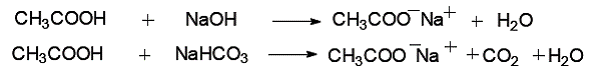
Кислотные свойства предложенных соединений возрастают в следующем порядке: уксусная кислота > фенол > глицерин > этанол > бутанол
Пример 2. Расположите следующие основания Брёнстеда – метиламин, диметиламин, анилин, п-аминофенол – в порядке убывания их основности.
Решение. Приведем структуры сравниваемых оснований:
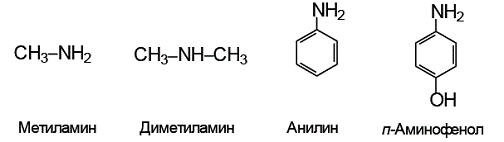
Предложенные соединения можно разделить на две группы: алифатические амины (метиламин и диметиламин) и ароматические амины (анилин и п-аминофенол).
Ароматические амины более слабые основания, чем алифатические амины. Низкая основность ароматических аминов объясняется тем, что неподеленная пара электронов атома азота вступает в сопряжение с 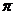 -электронным облаком бензольного кольца.
-электронным облаком бензольного кольца.
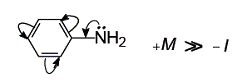
В результате этого неподеленная пара электронов делокализуется, и поэтому снижается ее способность связывать протон. Таким образом, амины алифатического ряда в целом обладают сильными основными свойствами. Электронная плотность на атоме азота у алифатических аминов локализована за счет электронодонорных свойств углеводородных радикалов.
В молекуле диметиламина +I-эффект двух метильных радикалов выше, чем у метиламина, поэтому диметиламин более сильное основание, чем метиламин.
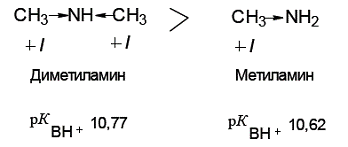
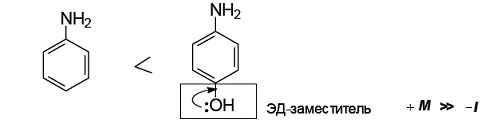
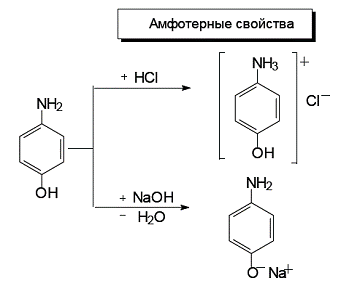
Сравним основность двух ароматических аминов: анилина и п-аминофенола. Заместители в ароматическом кольце влияют на основность аминов. В п-аминофеноле гидроксильная группа является электронодонорным заместителем. Электронодонорный заместитель препятствует делокализации неподеленной пары электронов атома азота и повышает основность анилина.
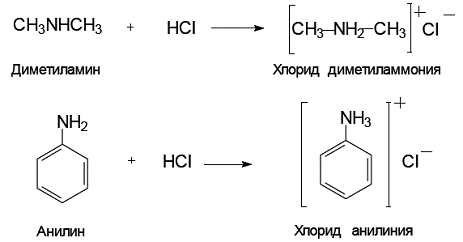
При взаимодействии с кислотами амины превращаются в аммониевые соли:
п-Аминофенол обладает одновременно и кислотными, и основными свойствами, т.е. является амфотерным соединением.
Основность рассматриваемых соединений уменьшается в ряду:
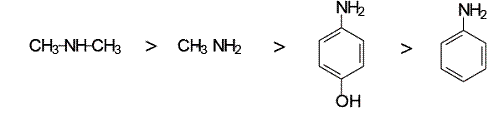
Задачи для самостоятельного решения
Задача 11.1.Расположите следующие соединения в порядке убывания их кислотности в водном растворе: а) этанол, пропанол-1, этиленгликоль (этандиол-1,2); б) уксусная, хлороуксусная, пропановая кислоты. Напишите уравнение реакции солеобразования для наиболее сильной кислоты.
Задача 11.2. Качественно сравните кислотность фенола и п-метилфенола (п-крезола), используемых в качестве дезинфицирующих средств.
Задача 11.3.Объясните, почему в водном растворе уксусная кислота (pKa=
4,76) более кислое соединение, чем фенол (pKa=9,98)?
Задача 11.4.Расположите следующие кислоты Брёнстеда – этанол, этиламин, этантиол – в порядке убывания их кислотности.
Задача 11.5. Сравните кислотность этантиола, 2-метилпропантиола-1, этанола, основываясь на стабильности соответствующих анионов. Напишите уравнение реакции образования натриевой соли для наиболее сильной кислоты.
Задача 11.6. В качестве первого антидота при отравлениях соединениями мышьяка был предложен 2,3-димеркаптопропанол. Какие кислотные центры в его молекуле будут преимущественно участвовать в образовании солей с мышьяком?
Задача 11.7. Укажите кислотные центры в молекуле меркамина (2-аминоэтантиола, радиозащитный препарат) и качественно сравните их кислотность.
Задача 11.8. Расположите следующие основания Брёнстеда – метиламин, метанол, метантиол – в порядке убывания их основности в водном растворе.
Задача 11.9. Сравните основность следующих соединений в водном растворе:
а) анилина и п-аминобензойной кислоты;
б) анилина и этиламина;
в) метиламина и диметиламина;
г) анилина и п-нитроанилина;
д) диэтилового эфира и фенетола (этоксибензола).
Напишите уравнения реакции солеобразования наиболее сильного
основания.
Литература для самостоятельной работы
1. Органическая химия: Учебник для вузов: В 2 кн./В.Л. Белобородов, С.Э. Зурабян, А.П. Тюкавкина; Под ред. Н.А. Тюкавкиной. - М.: Дрофа, 2002. – Кн. 1: Основной курс. – 620с. (С. 138-156)
2. Органическая химия (в вопросах и ответах) / Под ред. Б. А. Ивина и Л. Б. Пиотровского. — СПб.: Наука, 2002. — 510 с. (С. 118-137)
