Аналогичные процессы идут также в опытах: вытеснение хлора, брома и йода из растворов их солей, взаимодействие хлора с железом и сурьмой.
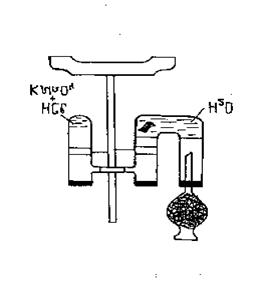 Рис. 22. Получение хлора и хлорной воды.
Рис. 22. Получение хлора и хлорной воды.
В описываемом опыте в U-образной трубке получилась хлорная вода, которую следует слить в темную склянку и использовать для опытов в качестве растворенного в воде хлора:
а)2KI+Cl2 = I2 +2KCl б)2KBr + Cl2 = Br2 +2KCl в)Cl2+Na2S = S +2NaCl
В пробирке (а) образуется йодная вода - использовать в органической химии для обнаружения непредельных углеводородов. В пробирке (б) образуется бромная вода - также использовать для обнаружения непредельных углеводородов. Содержимое пробирки (в) слить в нейтрализатор.
Оставшаяся после реакции с избытком кислоты в пробирке-реакторе жидкая смесь MnCI2, KCl, HCl разбавляется небольшим количеством воды, затем нейтрализуется до образования осадка вначале известковым молоком, а затем известковой водой с фенолфталеином до слабого малинового окрашивания: 2HCl+Ca(OH)2 = CaCl2+2H2O и MnCl2+Ca(OH)2 = Mn(OH)2¯+CaCl2. Хлор также поглощается гидроксидом кальция:
2CI2 + 2Ca(OH)2 = CaCI2 + Ca(CIO)2 + 2H2O.
Дать осадку отстояться, надосадочную жидкость слить в нейтрализатор, осадок 2-3 раза промыть декантацией, промывные воды слить в раковину. Затем осадок отделить фильтрованием. Оставить влажный Mn(OH)2 на воздухе, он постепенно буреет вследствие окисления, протекающего по схеме: 2Mn(OH)2 + O2 +2H2O =2Mn(OH)4.
Гидроксид марганца (IV) вновь можно использовать для получения хлора при нагревании с концентрированной соляной кислотой:
Mn(OH)4 +4HCl = MnCl2 +Cl2+4H2O .
Опыт 2. Получение хлора. Демонстрация окраски
Оборудование и реактивы: Пробирка демонстрационная, хлоркальциевая трубка с активированным углем, шпатель, перманганат калия кристаллический, концентрированная соляная кислота.
Ход работы. Хлор получают взаимодействием перманганата калия с соляной кислотой в демонстрационной пробирке. Помещают 0,5 ложечки для сжигания KMnO4 в пробирку и заливают соль соляной концентрированной кислотой. Быстро закрывают пробирку пробкой с трубкой и активированным углем. Наблюдают на белом фоне зеленоватую окраску хлора.
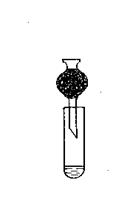 Рис. 23. Получение хлора, демонстрация окраски.
Рис. 23. Получение хлора, демонстрация окраски.
Техника безопасности: Установку мыть под вытяжкой или на улице, вылив содержимое в кристаллизатор с известковой водой.
Утилизация: см. опыт №1
Примечание. В подобной установке можно демонстрировать окрашенные токсичные продукты реакции, например, окраску оксида азота (IV), а также проводить любые эксперименты с выделением токсичных газов и паров. Следует использовать эту установку и для выполнения лабораторных опытов учащимися с токсичными веществами.
Опыт 3. Получение хлороводорода реакцией обмена и растворение его в воде
Оборудование и реактивы: Пробирки, пробка с газоотводной трубкой, U-образная трубка, пробка со стеклянной трубкой и активированным углем, спиртовка, спички, кристаллический хлорид натрия, вода дистиллированная, раствор серной кислоты (3:2), синяя лакмусовая бумага, штатив с лапками, резиновые прокладки, шпатель, ложечка для сжигания.
Ход работы: Помещают в пробирку-реактор хлорид натрия (2-3 ложечки для сжигания) и смачивают раствором серной кислоты с небольшим количеством ее над солью. Хлороводород при этом не выделяется. Спокойно закрывают пробирку пробкой с газоотводной трубкой, которую соединяют с U-образной трубкой, где налита вода (1/5 ее объема) и находится лакмусовая бумага. Другое колено U-образной трубки закрывают пробкой со стеклянной трубкой и активированным углем. Пробирку-реактор прогревают и сильно нагревают верхнюю часть реакционной смеси. Уровень воды в правом колене вначале несколько повышается, наблюдается пробулькивание пузырьков воздуха. По мере увеличения содержания хлороводорода в газовой смеси пробулькивание газов замедляется, затем может прекратиться совсем даже при нагревании пробирки-реактора. При несильном нагревании можно наблюдать втягивание жидкости из левого колена в правое колено U-образной трубки. Эти явления
можно объяснить интенсивным растворением хлороводорода в воде. Лакмусовая бумага краснеет. Реакционную массу нагревают до слабого кипения в течение 1-1,5 мин. За это время в U-образной трубке образуется соляная кислота достаточной концентрации для проведения опытов с цинком, окидом магния, карбонатом натрия и т. д. Избыток хлороводорода полностью поглощается адсорбентом, воздух в кабинете химии остается чистым. Написать уравнение реакции, объяснить условия течения реакции.
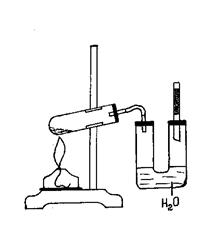
Рис. 24. Получение хлороводорода и растворение его в воде.
Техника безопасности: 1. При нагревании смеси не держать спиртовку руками под пробиркой-реактором. 2. По окончании получения хлороводорода нагревание прекращают. Пробку с адсорбентом снимают с U-образной трубки и закрывают ею пробирку-реактор для поглощения остаточного хлороводорода. 3. Установку мыть под вытяжкой после полного остывания системы, залив детали прибора известковой водой.
Утилизация: Соляную кислоту слить в склянку и использовать в лаборатории. В реакционной пробирке остается смесь сульфата и хлорида натрия, а также серная кислота. Эту смесь после растворения в воде можно использовать для обнаружения сульфат-ионов, демонстрации кислой среды с разными индикаторами. Смесь можно также использовать для демонстрации свойств серной кислоты: H2SO4 + Zn = ZnSO4 + H2 ; H2SO4 + MgO = MgSO4 + H2O; H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
После проведения названных демонстраций, содержимое переносят в емкость-нейтрализатор. Аналогично поступают после проведения качественной реакции на сульфат-ион: H2SO4 + BaCI2 = 2HCI + BaSO4.. Содержащиеся в реакционной смеси другие ионы не мешают проведению указанных процессов.
В случае накопления больших количеств отработанной смеси, ее нейтрализуют известковым молоком и затем известковой водой до нейтральной среды с фенолфталеином. Все сливают в раковину, так как в смеси отсутствуют токсичные вещества.
Опыт 4.Взаимодействие хлора с железом и сурьмой
Оборудование и реактивы: Штатив с двумя лапками, резиновые прокладки, две пробирки Вюрца, три пробки, одна из которых с двумя отверстиями, резиновые трубки, хлоркальциевая трубка, стеклянные трубки, спиртовка, спички, перманганат калия, соляная кислота концентрированная, железо восстановленное, порошок сурьмы, сухой речной песок, уголь активированный, шпатель.
Ход работы: Собирают установку согласно рис. 25. В хлоркальциевую трубку помещают активированный уголь. В пробирку (1) насыпают порошок сурьмы, смешанный с сухим чистым песком. Пробирку закрывают пробкой со стеклянной трубкой и соединяют ее с пробиркой Вюрца (2), где будет накапливаться хлор и происходить взаимодействие сурьмы с хлором. Эта пробирка Вюрца закрывается пробкой с двумя отверстиями: одна для отростка хлоркальциевой трубки с активированным углем, другая для соединительной стеклянной трубки. В другой пробирке Вюрца (3) получают хлор из перманганата калия (1-2 ложечки для сжигания) и концентрированной соляной кислоты (1,5–2 мл). Обе пробирки Вюрца соединены резиновыми трубками и стеклянной трубкой, куда помещают порошок железа.
После добавления соляной кислоты к перманганату калия, быстро закрывают пробку. Хлор “омывает железо”, реакции с железом без нагревания не происходит, далее хлор поступает в пробирку Вюрца (2) и накапливается там некоторое время. Приподнимают пробирку (1) и ссыпают сурьму в приемник хлора. Наблюдают интенсивное взаимодействие хлора с сурьмой (искры, белый дым). Нагревают железный порошок в стеклянной трубке с хлором, наблюдают образование бурого цвета хлорида железа (III). Написать уравнения реакций взаимодействия сурьмы и железа с хлором.
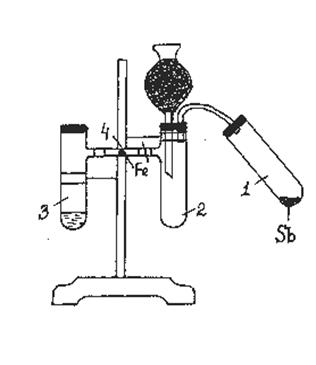
Рис. 25. Взаимодействие хлора с железом и сурьмой.
Техника безопасности: 1. Прибор должен быть герметичным. 2. Стеклянную трубку с железом нагревают осторожно, вначале прогревают ее по всей длине.
Утилизация: Установку разбирают под вытяжкой. Содержимое пробирки со смесью перманганата калия, соляной кислоты и продуктов их взаимодействия переносят в кристаллизатор с известковым молоком. Все другие емкости заполняют также известковым молоком и выливают в емкость-нейтрализатор. Утилизация этой смеси описана в опыте №1.
Опыт 5. Вытеснение хлором иода и брома из растворов их солей
Оборудование и реактивы: Пробирка Вюрца с пробкой, две U-образные трубки, хлоркальциевая трубка с активированным углем, штатив, спиртовка, спички, соляная кислота (конц.), KMnO4 (кристал.), ложечка для сжигания, растворы KI и KBr массовой долей 5%.
Ход работы: Собирают прибор согласно рис. 26. Установка должна быть герметичной. В пробирку Вюрца (4) помещают одну - две ложечки для сжигания кристаллического KMnO4 и соляную кислоту (конц.), немного превышающую уровень соли. Пробирку быстро закрывают пробкой. Выделяющийся хлор проходит сквозь толщу раствора KI в первой U-образной трубке. Наблюдают появление коричневой окраски и образование темно- фиолетовых кристаллов иода. Далее хлор проходит через раствор KBr во второй U–образной трубке, вытесняет бром из соли. Раствор приобретает красновато-бурый цвет. Излишки хлора поглощаются активированным углем в хлоркальциевой трубке (3). Закончив опыт, установку переносят в вытяжной шкаф или на улицу, заливают слабым щелочным раствором для нейтрализации хлора и кислоты. Затем разбирают и моют детали установки.
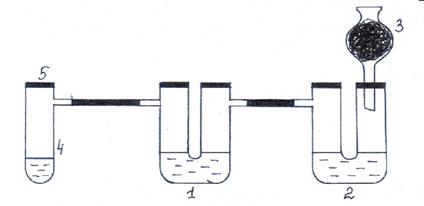
Рис. 26. Взаимодействие хлора с растворами бромида и иодида калия.
Техника безопасности: Концентрированную соляную кислоту необходимого объема наливают в емкость в вытяжном шкафу и переносят на демонстрационный стол.
Утилизация: В первой по ходу хлора U–образной трубке получают иод:
2KI + Cl2 ® I2 + 2KCl.
Кристаллы йода оседают через некоторое время на дно трубки, а над осадком получается раствор йода в солевом растворе. Раствор йода слить в склянку и использовать для обнаружения непредельных углеводородов. Кристаллы йода промыть холодной водой, а затем растворить в спирте. Получим спиртовую настойку йода. Если необходим кристаллический йод, то йод высушивают на воздухе, затем переносят в склянку с плотно притертой пробкой. Во второй U–образной трубке получают бром:
2KBr + Cl2 ® Br2 + 2KCl.
Бром находится в растворе образовавшейся соли. Слить содержимое трубки в склянку. Использовать эту смесь для обнаружения непредельных углеводородов, предварительно разбавив ее водой. Полученную бромную воду можно использовать для демонстрации следующих окислительно-восстановительных реакций:
2NH3 + 3Br2 ® N2 + 6HBr;
H2S + Br2 ® S¯ + 2HBr;
Na2S + Br2 ® S¯ + 2NaBr.
После опытов слить растворы NaBr и HBr с осадка серы, использовать раствор вновь для получения брома: 2NaBr + Cl2 ® 2NaCl + Br2..Утилизация смеси КMnO4 и HCI: см. опыт №1.
Опыт 6. Взаимодействие иода с алюминием и цинком.
Оборудование и реактивы: Фарфоровая ступка с пестиком, пипетка медицинская, шпатель, пробирка демонстрационная, порошок цинка и алюминия, пробка с двумя отверстиями, кристаллический иод, вода дистиллированная, стеклянная трубка с активированным углем, штатив с лапкой, резиновые прокладки.
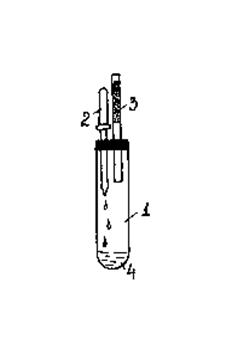
Ход работы: Готовят смесь цинка (1м.ч.) с иодом (4м.ч.). В фарфоровой чашке смесь перетирается до порошкообразного состояния и переносится в пробирку-реактор. Пробирка-реактор закрывается пробкой со вставленной в нее пипеткой, в которую набрана вода. В другое отверстие вставлена трубка с адсорбентом. Пипеткой капают несколько капель воды на смесь в пробирке. Идет бурная реакция с выделением теплоты и возгонкой части иода в виде фиолетовых паров. Аналогично проводится опыт взаимодействия иода с алюминиевым порошком. Подсчитайте, согласно уравнения, массы иода и алюминия для проведения реакции. Напишите уравнения взаимодействия иода с цинком и алюминием.
Рис. 27. Взаимодействие иода с цинком.
Техника безопасности: Избегайте контакта кожи рук с иодом. Иод брать шпателем. Перемешивание смеси производить в вытяжном шкафу.
Утилизация: Пробирки после опыта залить известковой водой и перенести в емкость-нейтрализатор.
