Факторы, воздействующие на скорость гомогенной химической реакции
В 1864 г. норвежские физико-химики Като Гульдберг и Петер Вааге экспериментально показали, что:
скорость гомогенной реакции, протекающей при постоянной температуре, прямо пропорциональна произведению концентраций реагирующих веществ.
Скорость гетерогенной реакции определяется скоростью наименее быстрой ее стадии.
Важным фактором, оказывающим влияние на скорость химических реакций, является природа образующихся промежуточных продуктов, которые в химической кинетике именуются активированными комплексами или переходными состояниями.
ДЕЙСТВИЯ МАСС ЗАКОН - скорость гомогенной реакции, протекающей при постоянной температуре, прямо пропорциональна произведению концентраций реагирующих веществ.
5. Влияние температуры на скорость химической реакции:
Эмпирическое правило Вант-Гоффа, уравнение Аррениуса. Энергия активации.
Скорость химических реакций сильно зависит от температуры. Согласно эмпирическому правилу Вант-Гоффа (1884) при повышении температуры на 10 градусов скорость большинства реакций возрастает в 2—4 раза. Число, показывающее, во сколько раз возрастает скорость реакции при повышении температуры на 10 градусов, называется температурным коэффициентом (γ) скорости данной реакции.
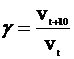
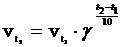
Шведский химик Сванте Аррениус в 1889 высказал мысль, что в реакцию вступают лишь те столкнувшиеся молекулы, у которых кинетическая энергия превышает некоторую минимальную величину, характерную для данной реакции, называемую энергией активации. Такие молекулы получили называние активных.
Молекулы обладают разной кинетической энергией и, следовательно, неодинаковой скоростью движения. Используя специальные методы математической статистики и теории вероятности, для каждой температуры можно получить количественное описание этого распределения (Максвелла).
Максимумы на кривых отвечают наиболее вероятной скорости при указанной температуре.
Например: при 20°С около 10% молекул кислорода обладают скоростями, превышающими 700 м/с. А при 100 градусов доля молекул со скоростями, превышающими 700 м/с, становится равной 17 %.
Та дополнительная энергия, которую надо придать молекулам реагирующих веществ для того, чтобы сделать их активными, называется энергией активации Еа. Она определяется природой реагирующих веществ и служит важной кинетической характеристикой любой химической реакции.
Уравнение Аррениуса связывает константу скорости реакции с ее энергией активации:
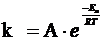
где: k - константа скорости реакции;
A —предэкспоненциальный множитель (множитель Аррениуса), постоянный для данной реакции;
e— основание натурального логарифма;
Ea- энергия активации, Дж/моль;
Т – температура, K;
R – универсальная газовая постоянная, 8,314 Дж/моль K.
