Металлическая связь. Металлические кристаллические решетки.
Металлическая связь – связь между положительно заряженными ионами металлов и свободными электронами в кристаллической решетке. Металлы имеют большое число электронов на внешнем энергетическом уровне и много свободных орбиталей. Электроны у атомов металлов удерживаются слабо, легко перемещаются, занимая свободные орбитали соседних атомов. Металличсекая связь имеет свойство с ковалентной связью, т.к. в их основе лежит обобществление электронов. Но металлическая связь является делокализованной и многоцентровой, в отличие от ковалентной связи. Физические свойства металлов (блеск, ковкость, электро- и теплопроводность) обуславливаются металлической связью и объясняются наличием подвижного электронного облака. Металлы имеют высокую электро- и теплопроводность, т.к. проводником электричества и теплоты является подвижное электронное облако. Металлы пластичны, легко происходит смещение своев атомов, однако общее подвижное электронное облако сохраняет связь.
В кристаллах металлов часть их атомов находится в ионизированном состоянии. В узлах кристаллической решетки металлов находятся положительные ионы и атомы металлов, а между узлами – электроны. Эти электроны становятся общими для всех атомов и ионов металла и могут достаточно свободно перемещаться по всей кристаллической решетке. Поэтому электроны, которые находятся в кристаллической решетке металлов, называются свободными электронами или «электронным газом».
Водородная связь. Природа и механизм образования водородной связи.
электронов при этом антипараллельны:ывающую МО. Спина мума энергии, принципом Паули и правилом Хунда. Так, два электрона молекСтруктурным элементом, оказывающим значительное влияние на свойства многих веществ, является водородная связь. При определённых условиях атом водорода может быть связан довольно прочно с двумя другими атомами. Имея лишь одну стабильную орбиталь, атом водорода способен образовывать только одну ковалентную связь. Если эта связь полярна, она может, однако, резонировать между двумя положениями. Наибольшее значение имеют те водородные связи, которые образуются между двумя сильно электроотрицательными атомами, в особенности между атомами азота, кислорода и фтора.
Механизм образования водородной связи – донорно-акцепторный. Донор – молекула или ион, имеющий неподеленную пару электронов. Акцептор – протон (Н+).
В некоторых соединениях, таких, как ион FHF-, атом водорода находится приблизительно посредине между двумя электроотрицательными атомами, образуя половину связи с каждым из них. Большинство же водородных связей несимметричны, одно межатомное расстояние больше другого на 50-80 пм, что соответствует отношению прочностей связи, равному приблизительно 10. Энергия более слабой связи обычно составляет около 20-100 кдж×моль-1, что и называется энергией водородной связи.
Водородные связи, образуемые молекулами воды, обусловливают удивительно высокие точки плавления льда и кипения воды, существование максимума плотности воды, расширение воды при замерзании. Многие особые свойства неорганических и органических молекул, например димеризация жирных кислот, объясняются образованием водородных связей. Водородная связь - особенно важная структурная особенность белков и нуклеиновых кислот.
Водородная связь обычно схематично изображается точками.
Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородная связь примерно в 15 – 20 раз слабее ковалентной. Водородные связи могут быть внутри- и межмолекулярными.
H - O....H - O Образование межмолекулярной водородной
| | связи между молекулами воды.
H H
(H2O)2
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. Так, фтористоводородная кислота (HF) является слабой кислотой в отличие от других галогенводородных кислот за счет водородной связи она димеризуется (H2F2) и может образовать кислые соли (NaHF2). За счет водородных связей вода характеризуется столь высокими по сравнению с водородными соединениями других элементов (электронных аналогов) главной подгруппы шестой группы температурами плавления и кипения:
| соединение | Н2Te | Н2Se | H2S | Н2О |
| Tкип.0С | -2 | -42 | -60 |
Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Взаимодействие между молекулами воды оказывается достаточно сильным, таким, что даже в парах воды присутствуют димеры и тримеры состава (H2O)2, (Н2O)3 и т. д.
Таким образом, водородные связи могут образовываться, если есть полярная Х—Н связь и свободная пара электронов. Например, молекулы органических соединений, содержащие группы —ОН, —СООН, —CONH2, —NH2 и др., часто ассоциированы вследствие! образования водородных связей.
Водородные связи могут возникать как между различными молекулами, так и внутри молекулы, если в этой молекуле имеются группы с донорной и акцепторной способностями. Например, именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей, которые определяют строение белков. По-видимому, наиболее важным и, несомненно, одним из наиболее известных примеров влияния внутримолекулярной водородной связи на структуру является дезоксирибонуклеиновая кислота (ДНК). Молекула ДНК свернута в виде двойной спирали. Две нити этой двойной спирали связаны друг с другом водородными связями.
Силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса). Ориентационное, индукционное и дисперсионное взаимодействие.
Кроме химической связи, специфической водородной существует ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи.
Межмолекулярное взаимодействие - взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей. В их основе, как и в основе химической связи, лежат электрические взаимодействия.
Силы Ван-дер-Ваальса включают все виды межмолекулярного притяжения и отталкивания. Они получили название в честь Я.Д. Ван-дер-Ваальса, который первым принял во внимание межмолекулярные взаимодействия для объяснения свойств реальных газов и жидкостей. Эти силы определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От них зависят многие структурные, спектральные и другие свойства веществ.
Основу ван-дер-ваальсовых сил составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. На определенном расстоянии между молекулами силы притяжения и отталкивания уравновешивают друг друга, и образуется устойчивая система. Ван-дер-ваальсовы силы заметно уступают химическому связыванию. Например, силы, удерживающие атомы хлора в молекуле хлора почти в десять раз больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого межмолекулярного притяжения нельзя получить жидкий и твердый хлор. Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль–1.
Различают три типа межмолекулярного взаимoдействия: ориентационное, индукционное и дисперсионное.
 Ориентационное взаимодействие: Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, т.е. молекулы, дипольный момент которых отличен от нуля, например HCl, H2O, NH3, ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение. Это диполь-дипольное взаимодействие постоянных диполей. Притяжение диполь-диполь может осуществляться только тогда, когда энергия притяжения превышает тепловую энергию молекул; обычно это имеет место в твердых и жидких веществах. Диполь-дипольное взаимодействие проявляется в полярных жидкостях (вода, фтороводород).
Ориентационное взаимодействие: Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, т.е. молекулы, дипольный момент которых отличен от нуля, например HCl, H2O, NH3, ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение. Это диполь-дипольное взаимодействие постоянных диполей. Притяжение диполь-диполь может осуществляться только тогда, когда энергия притяжения превышает тепловую энергию молекул; обычно это имеет место в твердых и жидких веществах. Диполь-дипольное взаимодействие проявляется в полярных жидкостях (вода, фтороводород).
Индукционное взаимодействие: Если полярная молекула окажется рядом с неполярными, она начнет влиять на них. Поляризация нейтральной частицы под действием внешнего поля (наведение диполя) происходит благодаря наличию у молекул свойства поляризуемости γ. Постоянный диполь может индуцировать дипольное распределение зарядов в неполярной молекуле. Под действием заряженных концов полярной молекулы электронные облака неполярных молекул смещаются в сторону положительного заряда и подальше от отрицательного. Неполярная молекула становится полярной, и молекулы начинают притягиваться друг к другу, только намного слабее, чем две полярные молекулы. Таким образом, индукционное взаимодействие осуществляется между молекулами с постоянным диполем и с молекулами, у которых постоянный дипольный момент равен нулю, но возникает индуцированный диполь под действием полярной молекулы. Притяжение постоянного и наведенного диполей обычно очень слабое, поскольку поляризуемость молекул большинства веществ невелика. Оно действует только на очень малых расстояниях между диполями. Этот вид взаимодействия проявляется главным образом в растворах полярных соединений в неполярных растворителях.
Дисперсионное взаимодействие: Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи. силы притяжения между неполярными частицами (атомами, молекулами) являются весьма короткодействующими. Значения энергии такого притяжения зависят размеров частиц и числа электронов в наведенных диполях. Эти связи очень слабые - самые слабые из всех межмолекулярных взаимодействий. Однако они являются наиболее универсальными, так как возникают между любыми молекулами. Таким образом, дисперсионное взаимодействие наблюдается между всеми молекулами, в том числе между молекулами, дипольный момент которых равен нулю. Обусловлено это флуктуацией электронной плотности в молекуле и образованием коротко живущих диполей (время жизни – 10-8 сек). Взаимодействие между этими диполями определяет величину дисперсионного взаимодействия. Способность к смещению электронной плотности (поляризуемость) увеличивается у атомов и молекул, в которых эти атомы включены, тем выше, чем больше радиус атомов. Таким образом, дисперсионное взаимодействие соединений одной подгруппы возрастает сверху вниз. Например, в ряду неполярных молекул F2, Cl2, Br2, I2 наблюдается рост температур кипения и плавления.
Существуют, однако, такие молекулы у которых нет не только дипольного электрического момента, но и электрических моментов более высокого порядка; это - сферически симметричные молекулы, прежде всего молекулы идеальных газов. Однако и благородные газы при охлаждении сжижаются, а при дальнейшем охлаждении образуют (гелий - только под повышенным по сравнению с атмосферным давлением) атомные и кристаллы. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы (например, метан). Энергия дисперсионного взаимодействия, так же как ориентационного и индукционного взаимодействий, пары частиц обратно пропорциональна шестой степени расстояния между ними. 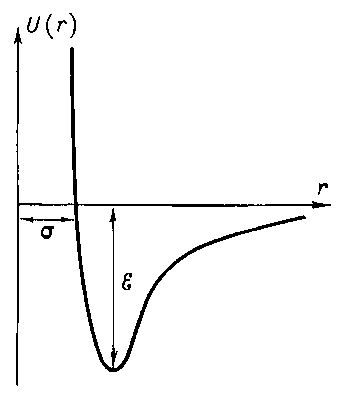 Если бы молекулы только притягивались друг к другу, это привело бы к их слиянию. Но на очень малых расстояниях их электронные оболочки начинают отталкиваться, причем, энергия отталкивания обратно пропорциональна двенадцатой степени расстояния между ними. На малых расстояниях силы отталкивания значительно больше сил притяжения:
Если бы молекулы только притягивались друг к другу, это привело бы к их слиянию. Но на очень малых расстояниях их электронные оболочки начинают отталкиваться, причем, энергия отталкивания обратно пропорциональна двенадцатой степени расстояния между ними. На малых расстояниях силы отталкивания значительно больше сил притяжения:
Концепция гибридизации атомных орбиталей и пространственное строение молекул и сложных ионов. Типы гибридизации sp, sp2, sp3, dsp3,d2sp3. Гибридизация с участием неподеленных электронных пар.
Гибридизация атомных орбиталей – это смешение атомных орбиталей (электронных облаков) различного типа, в результате которого образуются одинаковые по форме и энергии гибридные орбитали.
Число образующихся гибридных орбиталей равно числу орбиталей, участвующих в гибридизации.
Наиболее важные типы гибридизации орбиталей: sp (смешение одной s и одной p орбитали), sp2 (смешение одной s и двух p орбиталей), sp3 (смешение одной s и трех p орбиталей), dsp3,d2sp3.
Гибридизация АО происходит при образовании ковалентной связи, если при этом достигается более эффективное перекрывание орбиталей. Гибридизация атома углерода осуществляется его возбуждением и переносом электрона с 2s- на 2р-АО. Согласно представлению о гибридизации, химические связи образуются смешанными – гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома (s- и p-АО Be, B, C), обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией).
Основные положения теории гибридизации атомных орбиталей:
1)Введение гибридных орбиталей служит для описания направленных локализованных связей. Гибридные орбитали обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей.
2)Число гибридных орбиталей равно числу АО, участвующих в гибридизации.
3)Гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты.
4)В гибридизации участвуют АО, имеющие общие признаки симметрии.
Гибридные орбитали дают молекулы с углами 180°, 120°, 109°28', 90°. Это правильные геометрические фигуры. Такие молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, – несвязывающими или неподеленными электронными парами.
sp-гибридизация – s- и p-орбитали дают две sp-ГО, расположенные под углом 180° друг относительно друга.
Гибридные sp-орбитали участвуют в образовании двух σ-связей. Две р-орбитали не гибридизованы и расположены во взаимно перпендикулярных плоскостях
p-Орбитали образуют в соединениях две p-связи.
Для элементов 2-го периода sp-гибридизация происходит по схеме: 2s + 2px= 2 (2sp), 2py- и 2pz-АО не изменяются.
sp-гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных пар равна 2
sp2-гибридизация (плоскостно-тригональная)
Одна s- и две p-орбитали смешиваются, и образуются три равноценные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120°
Они могут образовывать три σ-связи. Третья р-орбиталь остается негибридизованной и ориентируется перпендикулярно плоскости расположения гибридных орбиталей. Эта р-АО участвует в образовании π-связи.
Для элементов 2-го периода процесс sp2-гибридизации происходит по схеме: 2s + 2px + 2py = 3 (2sp2), 2pz-АО в гибридизации не участвует. sp2-гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов или число его неподеленных электронных пар равна 3. Углерод в sp2-гибридном состоянии образует простое вещество графит. Это состояние характерно для атомов С, N, O и др. с двойной связью. Например, в молекулах ВН3, SO2, SO3, HCOOH, HCONH2 (атомы C и N).
sp3-гибридизация – гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов или число его неподеленных электронных пар равна 4.
На ¼ имеют характер s-орбитали и на ¾ p-орбитали, поэтому у них более вытянутая форма чем у sp2, и от центра атома они расходятся под углами 1090 (к вершинам тетраэдра). Подобный тип имеется в атомах углерода, азота, титана.
d2sp3-гибридизация – когда к одной s и трем p орбиталям примешивается еще две d орбитали, в результате получаются шесть гибридных орбиталей, направленных от ядра атома к вершинам октаэдра под углом 900 относительно друг друга. Встречается у d-элементов IV периода (Cr, Mn, Fe, Co, Ti).
dsp3-гибридизация
