Гибридизация волновых функций. Типы гибридизации. Пространственное строение молекул.
Концепция гибридизации, предложенная Л. Полингом. Согласно этой концепции, при образовании связей орбитали разной симметрии смешиваются и переходят в гибридные атомные орбитали (АО) одинаковой формы, одинаковой усредненной энергии и симметрично расположенные вокруг центрального атома, что обеспечивает равноценность образуемых ими связей. Число гибридных орбиталей равно числу исходных. Относительное пространственное положение гибридных орбиталей в атоме определяется тем, что электроны с параллельными спинами стремятся находиться возможно дальше друг от друга (ОВЭП). Это уменьшает силы отталкивания и таким образом понижает энергию системы. Примеры некоторых видов гибридизации. sp-Гибридизация: в этом случае «перерождаются» одна s- и одна р-орбиталь, при этом возникают две гибридные sp-орбитали, располагающиеся на одной прямой; угол между их направлениями 1800 (BeCl2).


sp2-Гибридизация: гибридизуются одна s- и две р-орбитали, угол 1200 (BCl3).


При sp3-гибридизации валентный угол составляет 109028' (CH4). sp3-гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов.


Возможны также гибридные орбитали с участием d-атомных орбиталей (sp2d, sp3d, sp3d2). Геометрия молекул формируется типом гибридизации АО центрального атома. При образовании π-связи наблюдается максимальное перекрывание орбиталей по обе стороны от линии, соединяющей ядра связанных атомов, вращение вокруг π-связи невозможно. σ-Связь формирует геометрическую форму молекулы, а π-связь упрочняет и закрепляет ее.
Образование кратных ковалентных связей. Их особенности. Делокализованные П-связи.
Встречающиеся в органических соединениях кратные связи (двойные или тройные):
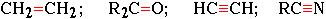
образуются при обобществлении двумя атомами более чем одной пары электронов:
Н2С : : СН2; R2С : : О; HС : : : CH; RС : : : N и т.д.
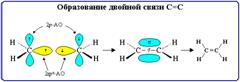
Кратные связи являются сочетанием σ- и π-связей.
Двойная связь состоит из одной σ- и одной π-связей и осуществляется 4-мя общими электронами.
Тройная связь является комбинацией из одной σ- и двух π-связей и включает в себя шесть электронов.
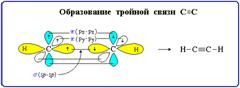
Число электронных пар, участвующих в образовании ковалентной связи называется порядком связи. Таким образом, порядок простой связи равен 1, двойной – 2, тройной – 3.
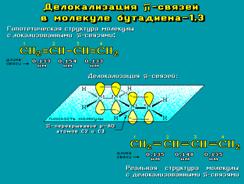
В случае сопряженных (делокализованных) связей порядок связи отличается от этих целочисленных значений.
Ковалентная связь считается локализованной, если её электронная пара находится в поле двух ядер и связывает только два атома. Делокализованная связь - связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов (подобие металлической связи). Такая делокализация (рассредоточение) электронов характерна для сопряженных π-связей, т.е. кратных связей, чередующихся с одинарными.
