Химическая связь. Виды химической связи. Свойства разных видов связей.
Химическая связь удерживает атомы или группы атомов друг около друга. Различают несколько видов химической связи: ионную, ковалентную (полярную и неполярную), металлическую, водородную.
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. 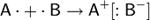
Ковалентная связь — химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака называются общей электронной парой.Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Неполярная ковалентная связь образуется между двумя одинаковыми атомами (О2, N2, Cl2). Ковалентная полярная связь образуется между двумя различными неметаллами. 2 механизма образования ков-ой связи: 1) по обменному механизму взаимодействует 1 неспаренный электрон от каждого атома. Образуется общая электронная пара. 2) По донорно акцепторному механизму связь образована между неподеленной электронной парой одного атома и свободной орбиталью другого атома. Атом с парой – донор, ион с орбиталью – акцептор.
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Водородная связь — разновидность донорно-акцепторной связи, невалентное взаимодействие между атомом водорода H. Водородная связь явл-ся непрочной и распространенной в природе.
Метод молекулярных орбиталей. Строение молекулы водорода с позиции теории молекулярных орбиталей.
Метод молекулярных орбиталей используется в квантовой механике для описания химических связей в соединениях .В его основе несколько принципов:
1)В молекуле все электроны находятся в поле действия их ядер, одако реально учитывается взаимодействие только внешних электронов.
2)Атомная орбиталь представляет собой волновую функцию электрона в поле действия одного центра ядра атома.
3)Число молекулярных орбиталей всегда должно быть равно числу атомных орбиталей, взятых, для их построения. Электроны заполняют орбитали согласно принципу Паули, правила Хунда и принципа минимизации энергии
Для построении молекулярной орбитали молекулы водорода нужно взять две атомные орбитали: по 1 S-орбитали от каждого атома: 1)сложение волн, которое происходит, когда фаза волновой функции совпадает. 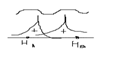 2)Вычитание волн происходит, когда волновые функции находятся в противофазе.
2)Вычитание волн происходит, когда волновые функции находятся в противофазе. 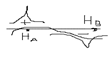 Химическая связь возникает тогда, когда число электронов на связующей орбитали больше чем на разрыхляющей.
Химическая связь возникает тогда, когда число электронов на связующей орбитали больше чем на разрыхляющей.
