Тесты по разделу «Электрохимия»
Тесты по разделу «Электрохимия»
1. Электролиз расплава хлорида натрия описывается суммарным уравнением:
1)NaCl → Na+ + Cl-
2)NaCl → Na + Cl
3)2NaCl→2Na + Cl2
4)2NaCl + H2O → Na2О + Cl2 + H2
5)NaCl + Н2О → NaOH + Cl2 + H2
2. При электролизе водного раствора хлорида калия на инертном аноде выделяется :
1)вода
2)кислород
3)водород
Хлор
5)гидроксид калия
3. Количественно процессы электролиза подчиняются законам
1)Ньютона
2)Ампера
3)Фарадея
4)Ома
5)Кулона
4. Процесс, протекающий при электролизе раствора сульфата натрия на платиновом аноде, описывается уравнением:
1)Na+ + 1ē →Na0
2)2H2O + 2ē → H2 + 2OH-
3)Pt - 2ē → Pt2+
4)2H2O - 4ē → 4H+ + O2
5)Na - 1ē → Na+
5. Процесс, протекающий при электролизе раствора сульфата никеля на никелевом аноде описывается уравнением:
1)2SO42- - 2 ē→ S4O82-
2)2H2O - 4 ē → O2 +4H+
3)Ni - 2 ē → Ni2+
4)2H2O +2 ē → H2 + 2OH-
5)Ni2+ + 2 ē → Ni0
6. Процесс, протекающий при электролизе раствора хлорида меди(II) на платиновом аноде, описывается уравнением
1)2Cl- -2 ē→ Cl2
2)2H2O - 4 ē → O2 + 4H+
3)Pt - 2 ē →Pt2+
4)Cu2+ + 2 ē → Cu0
5)Cu - 2 ē →Cu2+
7. При электролизе водного раствора смеси солей CuCl2, KCl, AlCl3 на катоде протекает процесс:
1)Cu2+ + 2 ē → Cu0
2)K+ + 1 ē → K
3)Al3+ + 3 ē →Al
4)2Cl- - 2 ē →Cl2
5)2H2O - 4 ē → 4H+ + O2
8. На электродах гальванического элемента Якоби-Даниэля, состоящего из цинковой и медной пластин, протекают следующие процессы:
1)A: Cu - 2 ē → Cu2+ K: Zn2+ + 2 ē → Zn
2)A: Zn - 2 ē → Zn2+ K: Cu2+ + 2 ē → Cu
3)A: Cu - 2 ē → Cu2+ K: 2H+ + 2 ē → H2
4)A: Zn - 2 ē → Zn2+ K: 2H2O - 4 ē → O2 + 4H+
5)A: Zn - 2 ē → Zn2+ K: 2H+ + 2 ē → H2
9. На электродах гальванического элемента Якоби-Даниэля, состоящего из серебряной и свинцовой пластин, протекают следующие процессы:
1)A: Pb - 2 ē → Pb2+ K: Ag+ + 1 ē →Ag
2)A: Ag - 1 ē → Ag+ K: Pb2+ + 2 ē → Pb
3)A: Pb - 2 ē → Pb2+ K: 2H+ + 2 ē → H2
4)A: Pb - 2 ē → Pb2+ K: 2H2O - 4 ē →O2 + 4H+
5)A: Sn - 2 ē → Sn2+ K: Ag+ + 1 ē →Ag0
10. Гальванический элемент Вольта состоит из цинковой и медной пластин, опущенных в раствор серной кислоты. На электродах этого гальванического элемента протекают следующие процессы:
1)А: Zn – 2 ē → Zn2+ K: 2H+ + 2 ē → H2
2)А: Cu – 2 ē → Cu2+ K: 2H+ + 2 ē → H2
3)А: Zn – 2 ē → Zn2+ K: Cu2+ + 2 ē → Cu
4)А: Zn – 2 ē → Zn2+ K: 2H2O - 4 ē → O2 + 4H+
5)А: Cu – 2 ē → Cu2+ K: Zn2+ + 2 ē → Zn0
11. На электродах гальванического элемента Якоби-Даниэля., состоящего из цинковой и железной пластин, протекают следующие процессы:
1)А: Zn – 2 ē → Zn2+ K: Fe2+ + 2 ē → Fe
2)А: Zn – 2 ē → Zn2+ K: 2H+ + 2 ē → H2
3)А: Fe – 2 ē → Fe2+ K: 2H+ + 2 ē → H2
4)А: Fe – 2 e → Fe2+ K: Zn2+ + 2e → Zn
5)А: Fe – 2e → Fe2+ K 2H2O + O2 +4e → 4OH-
12. Наибольшую э.д.с. имеет гальванический элемент:
1)Zn / ZnCl2, 1M // CdCl2, 1M /Cd
2)Cd / CdNO3, 1M // AgNO3, 1M / Cd
3)Zn / ZnSO4, 1M // NiSO4, 1M / Ni
4)Mg / Mg(NO3)2, 1M // AgNO3, 1M / Ag
5)Mg / MgSO4, 1M // FeSO4, 1M / Fe
13. В гальваническом элементе Якоби-Даниэля при 298 К установилось равновесие:
Zn + 2Ag+ ←→ Zn2+ + 2Ag
Концентрация ионов Zn2+ составляет 0,01моль/л, концентрация ионов Ag+ составляет 0,001 моль/л. Э.д.с. данного гальванического элемента равна:
1)1,0 В
2)-1,44 В
3)1,44 В
4)1,56 В
5)0,04 В
14. Э.д.с. гальванического элемента
Zn / ZnSO4, 0,000001 M // ZnSO4, 0,01 M /Zn равна:
1)0,76 В
2)0,06 В
В
4)0,24 В
5)0,18 В
15. Краткая схема гальванического элемента Якоби-Даниэля имеет вид:
Zn / ZnSO4, 1M // CuSO4, 1M / Cu
Э.д.с. данного гальванического элемента равна:
1)0,32 В
В
3)-1,1 В
4)-0,32 В
5)0,5 В
16. Процессы, протекающие при контактной коррозии магния и железа в нейтральной водной среде, описываются уравнениями
1)А: Mg – 2e → Mg2+ K: 2H2O + O2 – 4e → 4OH-
2)А: Mg – 2e → Mg2+ K: 2H+ + 2e → H2
3)А: Mg – 2e → Mg2+ K: Fe2+ + 2e → Fe
4)А: Fe – 2e → Fe2+ K: 2H+ + 2e → H2
5)А: Fe – 2e → Fe2+ K: 2H2O + O2 –4e → 4OH-
17.Для протекторной защиты железа от коррозии в нейтральной водной среде применяется:
1)серебро
Цинк
3)медь
4)олово
5)свинец
18. Металлом, наиболее подверженным электрохимической коррозии при контакте с оловом, является:
Магний
2)свинец
3)кобальт
4)железо
5)медь
19. Электрохимическая коррозия железа в нейтральной водной среде описывается уравнением:
1)4Fe + 3O2 + 6H2O = 4Fe(OH)3
2)4Fe + 3O2 = 2Fe2O3
3)Fe + 3Cl2 = 2FeCl3
4)3Fe + C = Fe3C
5)3Fe + Si + Fe3Si
20. Процессы, протекающие при коррозии оцинкованного железа во влажном воздухе, описываются уравнениями:
1)А: Zn – 2e → Zn2+
K: Fe2+ + 2e → Fe
2)А: Zn – 2e → Zn2+
K: 2H+ + 2e → H2
3)А: Zn – 2e → Zn2+
K: 2H2O + O2 – 4e → 4OH-
4)А: Fe – 2e → Fe2+
K: 2H2O + O2 –4e → 4OH-
5)А:Fe – 2e → Fe2+
K: 2H+ + 2e → H2
21. Уравнение, отвечающее электрохимической коррозии металла:
1) 2Mg + O2 = 2MgO
2) Sn + O2 = SnO2
3)2Zn + O2 + 2H2O = 2Zn(OH)2
4) 2Pb + O2 = 2PbO
5) 4Fe + 3O2 = 2Fe2O3
22. Процесс отвода электронов с катодных участков при электрохимической коррозии называется:
Деполяризацией
2)ионизацией
3)диссоциацией
4)аэрацией
5)катодной защитой
23. Металлом, который может служить анодным покрытием на железе, является:
1)свинец
2)олово
3)медь
4)серебро
Магний
24. Процесс коррозии лужёного железа в кислой среде при нарушении целостности покрытия описывается уравнениями:
1)А: Fe – 2ē → Fe2+ K: 2H2O + O2 +4ē → 4OH-
2)А: Fe – 2ē→ Fe2+ K: 2H+ + 2ē → H2
3)А: Sn – 2ē → Sn2+ K: 2H+ + 2ē → H2
4)А: Fe – 2ē → Fe2+ K: Sn2+ + 2ē → Sn
5)А: Sn – 2ē → Sn2+ K: 2H2O + O2 +4ē → 4OH-
25. Атмосферная коррозия лужёного железа (покрытого тонким слоем олова) описывается уравнениями:
1)А: Fe – 2ē → Fe2+ K: 2H2O + O2 +4ē → 4OH-
2)А: Fe – 2ē → Fe2+ K: 2H+ + 2ē → H2
3)А: Sn – 2ē → Sn2+ K: 2H2O + O2 +4ē → 4OH-
4)А: Sn – 2ē → Sn2+ K: 2H+ + 2ē → H2
5)А: Fe – 2ē → Fe2+ K: Sn2+ + 2ē → Sn
Тесты по разделу «Полимеры»
1.Карбоцепным является полимер:
1) (-СF2-)n -тефлон
2) (-CH2O-)n-полифоральдегид
3) (-MeO-)n-оксиды металлов
4) (-ЅιO2-)n-двуокись кремния
5) (-S-)n-сера
2.Гетероцепным полимером является:
1) (-СН2-)n-полиэтилен
2) (-СН2-СClH-)n-поливинилхлорид
3) (СН2-С(СН3)2-)-полиизобутилен
4) (-СН2-СН-F-)n –поливинилфторид
5) (-СН2-СН2О-)n-полиэтиленоксид
3.Полимерами не являются:
1) Вещества, получаемые методами поликонденсации
2) Вещества, получаемые методами полимеризации
3) Вещества, получаемые методами полимераналогичных превращений
4) Продукты взаимодействия щелочей с минеральными кислотами
5) Вещества, получаемые реакциями полиприсоединения
4 Наиболее устойчивым полимером является:
Тефлон ( Фторпласт-4)
2)Белок
3)Полиэтилен
4)Каучук
5)Крахмал
5. При нагревании термопласты:
1)Только разлагаются
2)Переходят в вязкотекучее состояние практически без разложения
3)Испаряются
4)Кристаллизуются
5)Обугливаются
6.Природным полимером является:
1)Желатин
2)Органическое стекло
3)Лавсан
4)Полиэтилен
5)Фторопласт-4
7.Органические ВМС содержат в своем составе:
1)Только углерод
2)Углерод, водород, кремний и водород
4)Углерод, водород, азот, кислород и серу
5)Кремний, фосфор, серу
8.При реакции поликонденсации не образуются:
1) Поликарбонаты
2) Полипептиды
3) Полиэфиры
4) Водород
5) Полиамиды
9. К сетчатым полимерам не относятся:
1) Лавсан
2) Тефлон
3) Резина
4) Клетчатка
5) Нейлон
10. Поликонденсационные ВМС могут быть получены реакциями взаимодействия:
1) Этилена и изобутилена
2) Стирола и соляной кислоты
3) Этилендиамина и уксусной кислоты
4) Гексаметилендиамина и адипиновой кислоты
5) Адипиновой кислоты и метанола
11. Степень полимеризации это:
1) Отношение среднего молекулярного веса полимера к молекулярному весу мономера
2) Отношение молекулярного веса полимера к молекулярному весу мономера
3) Молекулярный вес полимера
4) Молекулярный вес мономера
5) Количество молей полимера
12. При полимеризации метилметакрилата - СН2=С(СН3)СООСН3 образуется:
1) Полиметилметакрилат
2) Метанол
3) Полиакрилонитрил
4) Каучук
5) Лавсан
13. При обработке полистирола серной кислотой образуется:
1) Бензолсульфокислота
2) Сульфированный полистирол
3) Стирол
4) Бензол
5) Винилбензол
14. При гидролизе капрона образуются:
1) Капроновая кислота
2) Капролактам
3) Полиамид
4) Валериановая кислота
5) Азотная кислота
15. Пенополиуретаны это:
1) Пенополиэтилен
2) Вспененные полиуретаны
3) Пенополистирол
4) Поронит
5) Плексиглас
16. Силиконы это:
1) Силикаты
2) Диалкилдихлорсиланы
3) Полисилоксаны
4) Диарилдихлорсиланы
5) Алкиларилдихлорсиланы
17. Натуральный каучук это:
1) Транс-полиизопрен
2) Цис-полиизопрен
3) Полибутадиен
4) Гуттаперча
5) Наирит
18. При нитровании клетчатки не образуется:
1) Вода
2) Пироксилин
3) Динитроклетчатка
4) Целлофан
5) Мононитроклетчатка
19. Лавсан (терилен) образуется при взаимодействии:
1) Диметилтерефталата с этиленгликолем
2) Этиленгликоля с фталиевой кислтой
3) Окиси этилена с диметилтерефталатом
4) Адипиновой кислоты с этиленглиголем
5) Фталевого ангидрида с глицерином
20. При нагревании термореактивных ВМС не образуются:
1) Низкомолекулярные продукты
2) Углистые вещества
3) Продукты уплотнения
4) Термопластичные ВМС
5) Продукты полимераналогичных превращений
21. При реакции поликонденсации формальдегида с фенолом не образуется:
1) Резол
2) Резит
3) Резина
4) Фенолформальдегидные смолы
5) Вода
22. При гидролизе поливинилацетата обрауется:
1) Виниловый спирт
2) Поливиниловый спирт
3) Окись этилена
4) Уксусный альдегид
5) Уксусный ангидрид
23. При полном сгорании полиэтилена образуются:
1) СО2 и Н2О
2) Н2О2
3) Н2 и О2
4) Сажа 5) Олигомеры
24. Реакция радикальной полимеризации осуществляется под действием:
1) Инициаторов радикальной полимеризации
2) Оснований Льюиса
3) Кислот Льюиса
4) Минеральных кислот
5) Металлорганических соединений
25. Полиамиды получаются при взаимодействии:
1) Двухосновных кислот и гликолей
2) Диаминов с альдегидами
3) Аминокислот с минеральными кислотами
4) Диаминов с двухосновными кислотами
5) Диаминов с азотистой кислотой
Становится равной 7
3) Становится меньше 7
4) Становится больше 8
5) Становится меньше 0
24. При взаимодействии: N2 + 3 H2 = 2NH3 аналитическим сигналом будет:
Окраска индикатора
2) Показатель преломления
3) Масса
4) Pадиоактивность
5) Цвет раствора.
Тесты к разделу “ Металлы“
1. С водой при комнатной температуре взаимодействует:
1) Золото
2) Платина
Калий
4) Медь
5) Свинец
2. С соляной кислотой ( НСl ) реагирует с выделением водорода:
1) Серебро
2) Платина
3) Золото
Железо
5) Медь
3. Старательским способом добывают:
1) Калий
2) Натрий
Золото
4) Магний
5) Кальций
Золото
2) Железо
3) Натрий
4) Цинк
5) Литий
Железо
2) Литий
2) Калий
3) Натрий
4) Франций
5) Цезий
6. Золото устойчиво на воздухе ввиду того, что:
Кислотные свойства
3) Основные свойства
4) Восстановительные свойства
5) Безразличный оксид
8. При взаимодействии медного купороса (CuSO4 ) c цинком образуется:
Медь и сульфат цинка
2) Серная кислота
3) Гидроксид меди и сульфат цинка
4) Сульфит меди (II )
5) Оксид цинка и сульфид меди
9. При взаимодействии железа с водой в присутствии кислорода образуется:
1) Бурая ржавчина ( Fe2O3 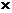 n H2O )
n H2O )
2) Карбонат железа
3) Карбид железа
4) Нитрид железа
5) Озонид железа
K
3) Au
4) Fe
5) Pt
11. Разбавленная серная кислота не реагирует с:
Медью
2) Кальцием
3) Железом
4) Магнием
5) Хромом
12. Алюминий устойчив на воздухе ввиду того , что:
1) Имеет отрицательный стандартный электродный потенциал
Амфотерные свойства
2) Основные свойства
3) Кислотные свойства
4) Окислительные свойства
5) Окислительно-восстановительную двойственность
18. При взаимодействии перманганата калия (марганцовка) с перекисью водорода в присутствии серной кслоты образуются:
Бром, вода, бромид марганца
2) Бром, вода, бромат марганца
3) Бром и бромид марганца
4) Бромистый водород, вода и бромид марганца
5) Бром и бромат марганца
20. CrO3 проявляет:
1) Окислительно-восстановительную двойственность
Na, Fe, Pb, Au, Pt
2) Au, Na, Fe, Pb, Pt
3) Pt, Au, Na, Fe, Pb
4) Pt, Au, Na, Pb, Fe
5) Na, Fe, Pt, Au, Pb
23. Металл может быть получен электролизом водных растворов солей этого металла:
1) Натрий
2) Калий
Медь
4) Кальций
5) Литий
24. Латунь это сплав:
1) Меди и цинка
2) Меди и олова
3) Лантана и цинка
4) Меди и золота
5) Меди и серебра
25. Реакция : Me + nHCl = MeCln + H2 xaрактерна для :
Li
2) Cu
3) Ag
4) Pt
5) Au
И 12
4) 6 и 10
2. В узлах кристаллической решетки металлов находятся
1) нейтральные атомы металла
Au, Ag, Cu
4. В химических реакциях металлы выступают в роли
1) окислителей
2) восстановителей
3) окислителей и восстановителей
4) акцепторов электронов
5. Электродные потенциалы не зависят от
1) природы металла
2) концентрации соли
3) атомной массы металла
4) температуры
6. Промышленная очистка титана от примесей осуществляется
Иодидным способым
2) электролитическим путем
3) отгонкой летучих соединений
4) зонным методом.
7. Промышленная очистка меди от примесей осуществляется
1) иодидным способом
2) электролитическим путем
3) отгонкой летучих соединений
4) зонным методом
8. Получение хрома алюмотермическим методом выражается реакцией to
1) CrCl3 + А1 → А1С13 + Cr
(раствор) (раствор)
to
2) 2 Cr2О3 + А1 → 3Cr + CrО3 + Al2O3
to
3) Cr2О3 + 2А1 → 2Cr + Al2O3
to
4) 4 CrCl3 + 2 А12O3 → 4Cr + 4 А1С13 + 3 O2
(раствор)
9. Электролизом растворов нельзя получить
Na и Mg
2) Pb и Zn
3) Cu и Ag
4) Fe и Ni
10. При электрохимическом рафинировании меди, содержащей марганец, цинк, золото и серебро в анодный шлам перейдут
1) Zn и Ag
2) Mn и Au
Au и Ag
Zn и Mn
11. При электрохимическом рафинировании меди, содержащей марганец, цинк, железо и серебро в раствор перейдут
1) Mn u Zn
2) Mn u Ag
3) Mn, Ag u Fe
Mn, Zn u Fe
12. Стандартные электродные потенциалы соответствуют концентрации иона Men+, равной
1) 0,001 моль/л
2) 0,01 моль/л
3) 0,1 моль/л
4) 1 моль/л
13. Флотационный метод обогащения руды основан на
1) различии плотности минералов
2) различной смачиваемости минералов
3) различии в магнитных свойствах минералов
4) различии химических свойств минералов
14. Не взаимодействуют с разбавленной соляной кислотой
1) Zn u Mg
2) Fe u Be
3) Cu u Ag
4) Mn u Al
15. Возможным является процесс, описываемый уравнением
1) Zn + CuSO4 → ZnSO4 + Cu
2) Ag + Zn(NO3)2 → 2 AgNO3 + Zn
3) Pb + FeSO4 → PbSO4 + Fe
4) Sn + NiCl2 → SnCl2 + Ni
16. Реакция меди с концентрированной азотной кислотой описывается уравнением
1) Cu + 2 HNO3 → Cu(NO3)2 + H2↑
2) 4Cu + 10 HNO3 → 4Cu(NO3)2 + N2O↑ + 5H2O
3) 3Cu + 8 HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
4) Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2↑ + 2H2O
17. Реакция меди с разбавленной азотной кислотой описывается уравнением
1) Cu + 2 HNO3 → Cu(NO3)2 + H2↑
2) 4Cu + 10 HNO3 → 4Cu(NO3)2 + N2O↑ + 5H2O
3) 3Cu + 8 HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
4) Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2↑ + 2H2O
18. Реакция магния с разбавленной азотной кислотой выражается уравнением
1) 4Mg + 10 HNO3 → 4Mg(NO3)2 + N2O↑ + 5H2O
2) Mg + 2 HNO3 → Mg(NO3)2 + H2↑
3) Mg + 4 HNO3 → Mg(NO3)2 + 2 NO2↑ + 2H2O
4) Mg + HNO3 → MgO + HNO2
19. Концентрированная серная кислота не взаимодействует со следующими металлами
1) Cu u Ag
Ag u Pt
3) Zn u Mg
4) Sn u Al
20. Амфотерными свойствами обладают металлы
1) Fe u Ni
Be u Al
3) Na u Mg
4) Co u K
21. Не взаимодействуют с водой
1) Mg u K
2) Mn u Na
3) Ca u Ba
Zn u Sn
22. Относятся к легким конструкционным следующие металлы
Mg u Al
2) Co u Ni
3) Ti u Pt
4) Cu u Zn
23. Из четырех металлов Li , Na , K , Rb наименьший потенциал ионизации имеет
1) Li
2) Na
3) K
Rb
24. Из четырех металлов Mg , Ca , Sr , Ba наименьшую электроотрицательность имеет
1) Mg
2) Ca
3) Sr
Ba
25. Разбавленная серная кислота не взаимодействует со следующими металлами
Сu u Hg
2) Al u Fe
3) Zn u Cr
4) Mg u Pb
КДж/моль
3)+279,1кДж/моль
4)-279,1кДж/моль
5)-87,2 кДж/моль
17. Для реакции, протекающей в стандартных условиях, известны значения энтальпии образования исходных веществ и продуктов реакции
СО + Сl2 = СОСl2
ΔН0обр. 110,6 -220,3 кДж/моль
Изменение энтальпии в данной реакции составляет
1) + 109,7 кДж
2) –109,7 кДж
3)-330,9 кДж
4) +330,9 кДж
5) –210,1 кДж
18. Для реакции, протекающей в стандартных условиях, известны значения энтропии исходных веществ и продуктов реакции:
N2(г) + 3H2(г) = 2NH3(г)
S0298 199,9 130,5 192,6 Дж/моль ∙ К
Изменение энтропии в указанной реакции составляет
1) +206,2 Дж/К
2) –137,8 Дж/К
3) –206,2 Дж/К
4) +137,8 Дж/К
5) –398,9 Дж/К
19. Процесс испарения воды протекает в стандартных условиях:
Н2О (жидк.) = Н2О(газ)
ΔН0обр. –286,0 -242,0 кДж/моль
Энтальпия процесса испарения равна:
1)-44,0 кДж/моль
2)+44,0 кДж/моль
3)-528,0 кДж/моль
4)+528,0 кДж/моль
5)-88,0 кДж/моль
20. Реакция протекает в стандартных условиях:
2Cu(NO3)2 = 2CuO = 4NO2 + O2
Изменение энтальпии в данной реакции равно +420,4 кДж, изменение энтропии в реакции равно +1033.6 Дж/К. Рассчитать изменение свободной энергии Гиббса.
1)+112,3 кДж
2) –112,3 кДж
3) 613,2 кДж
4) –613 кДж
5) +1454,0 кДж
21. Для реакции, протекающей в стандартных условиях, известны значения энтальпии образования исходных веществ и продуктов реакции:
СО2 + Н2 = СО + Н2О
ΔН0обр. –393,8 -110,6 -286,0 кДж/моль
Изменение энтальпии в указанной реакции составляет:
КДж
2) +2,8 кДж
3) –790,4 кДж
4) +790,4 кДж
5) +44,5 кДж
22. Для реакции, протекающей в стандартных условиях, известны стандартные энтальпии образования исходных веществ и продуктов реакции:
СО(г) + 3Н2(г) = СН4(г) + Н2О(г)
Н0обр. –110,6 -74,8 -241,2 кДж/моль
Изменение энтальпии в указанной реакции составляет:
1) +205,4 кДж
2) –205,4 кДж
3) –426,6 кДж
4) +426,6 кДж
5) –25,4 кДж
23. Для реакции, протекающей в стандартных условиях, известны значения энтальпии образования исходных веществ и продуктов реакции:
4НСl + О2 = 2Н2О + 2Сl2
ΔН0обр. –92,5 -242,0 кДж/моль
Изменение энтальпии в ходе данной реакции составляет:
1) +114,0 кДж
2) –114,0 кДж
3) –854,0 кДж
4) +300 кДж
5) +432,0 кДж
24. Процессом, который характеризуется наибольшим возрастанием энтропии,является:
1) конденсация
2) испарение
3) кристаллизация
4) охлаждение
5) изменение кристаллической модификации
25. Внутренняя энергия системы в экзотермических реакциях изменяется следующим образом:
1) увеличивается
2) уменьшается
3) не изменяется
4) знак ΔU зависит от агрегатного состояния вещества
5) знак ΔU зависит от давления в объёме
Тесты по разделу «Растворы»
1.Зависимость осмотического давления раствора от концентрации растворённого вещества описывается законом:
1)Менделеева
Вант-Гоффа
3)Фарадея
4)Авогадро
5)Генри
2 «Понижение давления насыщенного пара растворителя над раствором пропорционально мольной доле растворённого вещества».
Приведённое выражение представляет собой
1)закон Гесса
Закон Рауля
3)закон Фарадея
4)закон Ома
5)первый закон термодинамики
3.Раствор, в котором не происходят химические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы, называется
1)насыщенным
2)концентрированным
Идеальным
4)реальным
5)пересыщенным
4.Отношение числа молекул электролита, распавшихся на ионы, к общему числу его молекул в растворе, называется:
1)степенью гидролиза
Степенью диссоциации
3)произведением растворимости
4)константой диссоциации
5)константой гидролиза
5. Выражение «раствор с массовой долей соли 3%» означает:
1)в 100 г воды растворено 3 г соли
2)в 1 л воды растворено 3 г соли
4)0,1
5)0,125
6. Масса гидроксида натрия, содержащаяся в 500 мл его 1М водного раствора, равна:
1) 10 г
2) 40 г
Г
4) 60 г
5) 50 г
7. Масса хлорида калия, содержащаяся в двух литрах 1М раствора, равна:
1) 74,5 г
Г
3) 35,5 г
4) 39 г
5) 37,2 г
8. Чему равна молярная концентрация раствора, полученного разбавлением 250 мл 2М раствора до объёма 1 л?
1) 0,1 М
М
3) 1 М
4) 1,2 М
5)1,5 М
9. В 250 миллилитрах раствора серной кислоты, имеющего концентрацию 1 моль/л. содержится
1) 98 г кислоты
Г кислоты
3) 49г кислоты
4) 125 г кислоты
5) 9,8 г кислоты
10. Водородный показатель (рН) 0,01 М раствора азотной кислоты равен:
1) 1
2) 0,01
3) 2
4) 10
5)12
11. Водородный показатель (рН) раствора гидроксида калия, имеющего концентрацию 0,01 моль/л, равен:
1) 0,01
2) 2
3) 12
4) 1
5) 10
13. Для уравнения реакции: CuSO4 + NaOH = …………
сокращённое ионное уравнение запишется в виде:
1)Cu2+ + 2OH- = Cu(OH)2
2)CuSO4 + 2OH- = Cu(OH)2 + SO42-
3)SO42- + 2Na+ = Na2SO4
4)2NaOH + Cu2+ = Cu(OH)2 + 2OH-
5)CuSO4 + 2Na+ = Na2SO4 + Cu2+
14. Для уравнения реакции FeCl2 + H2S = …………….
сокращённое ионное уравнение запишется в виде:
1)Fe2+ + S2- = FeS
2)Fe2+ + H2S = Fe2+ + S2- + 2H+
3)Fe2+ + H2S = FeS + 2H+
4)2Cl- + H2S = 2HCl + S2-
5)FeCl2 + S2- = FeS + 2Cl-
15. Сокращённому ионному уравнению : Н+ + ОН- = Н2О
соответствует следующая реакция в молекулярном виде:
1)BaCl2 + H2SO4 = BaSO4 + 2HCl
2)NaOH + HNO3 = NaNO3 + H2O
3)CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
4)AgNO3 + KI = KNO3 + AgI
5)FeCl3 + 3H2O = Fe(OH)3 + 3HCl
16. Ионы Cl- образуются при диссоциации соли:
1)гидросульфид калия
Хлорид калия
3)бертолетова соль KClO3
4)гипохлорит калия KClО,
5)перхлорат калия КClO4
17. Из приведённых ниже солей по катиону гидролизуются:
1) KNO3
2) NaCl
3) ZnCl2
4) K2SO4
5) BaCl2
18. Из приведённых ниже солей по аниону гидролизуются:
1)сульфат меди (II)
2)хлорид алюминия
3)нитрат железа(III)
Сульфид натрия
5)нитрат хрома (III)
19. Из приведённых ниже солей гидролизуется одновременно по катиону и аниону:
1)нитрат меди (II)
2)хлорид бария
3)гидрокарбонат натрия
4)ацетат аммония
5)хлорид аммония
20. Из приведённых ниже солей гидролизу не подвергается:
1)ацетат натрия
2)сульфид железа (II)
3)нитрит натрия
4)хлорид калия
5)нитрат свинца
21. Из приведённых ниже солей гидролизу не подвергается:
1)ацетат алюминия
2)сульфат натрия
3)нитрат цинка
4)хлорид железа (III)
5)карбонат натрия
22. Кислый раствор получается при гидролизе соли:
1)карбонат лития
2)сульфид калия
3)нитрат железа (III)
4)сульфит натрия
5)ацетат натрия
23. Щелочной раствор получается при гидролизе соли:
1)сульфат аммония
2)хлорид олова (II)
3)карбонат калия
4)нитрат меди (II)
5)ацетат аммония
24. Нейтральный раствор получается при гидролизе соли:
1)сульфат железа (III)
2)ацетат аммония
3)нитрат цинка
4)хлорид аммония
5)карбонат натрия
25. Из пяти групп веществ выберите ту, которая содержит только сильные электролиты:
1) NaCl, Cu(OH)2, KMnO4
2) K2SO4, HNO3, NaOH
3) BaCl2, H2CO3, Fe(OH)3
4) KOH, CuCl2, NH4OH
5) Al(OH)3, KCl, H2S
Тесты по разделу «Электрохимия»
1. Электролиз расплава хлорида натрия описывается суммарным уравнением:
1)NaCl → Na+ + Cl-
2)NaCl → Na + Cl
3)2NaCl→2Na + Cl2
4)2NaCl + H2O → Na2О + Cl2 + H2
5)NaCl + Н2О → NaOH + Cl2 + H2
2. При электролизе водного раствора хлорида калия на инертном аноде выделяется :
1)вода
2)кислород
3)водород
Хлор
5)гидроксид калия
3. Количественно процессы электролиза подчиняются законам
1)Ньютона
2)Ампера
3)Фарадея
4)Ома
5)Кулона
4. Процесс, протекающий при электролизе раствора сульфата натрия на платиновом аноде, описывается уравнением:
1)Na+ + 1ē →Na0
2)2H2O + 2ē → H2 + 2OH-
3)Pt - 2ē → Pt2+
4)2H2O - 4ē → 4H+ + O2
5)Na - 1ē → Na+
5. Процесс, протекающий при электролизе раствора сульфата никеля на никелевом аноде описывается уравнением:
1)2SO42- - 2 ē→ S4O82-
2)2H2O - 4 ē → O2 +4H+
3)Ni - 2 ē → Ni2+
4)2H2O +2 ē → H2 + 2OH-
5)Ni2+ + 2 ē → Ni0
6. Процесс, протекающий при электролизе раствора хлорида меди(II) на платиновом аноде, описывается уравнением
1)2Cl- -2 ē→ Cl2
2)2H2O - 4 ē → O2 + 4H+
3)Pt - 2 ē →Pt2+
4)Cu2+ + 2 ē → Cu0
5)Cu - 2 ē →Cu2+
7. При электролизе водного раствора смеси солей CuCl2, KCl, AlCl3 на катоде протекает процесс:
1)Cu2+ + 2 ē → Cu0
2)K+ + 1 ē → K
3)Al3+ + 3 ē →Al
4)2Cl- - 2 ē →Cl2
5)2H2O - 4 ē → 4H+ + O2
8. На электродах гальванического элемента Якоби-Даниэля, состоящего из цинковой и медной пластин, протекают следующие процессы:
1)A: Cu - 2 ē → Cu2+ K: Zn2+ + 2 ē → Zn
2)A: Zn - 2 ē → Zn2+ K: Cu2+ + 2 ē → Cu
3)A: Cu - 2 ē → Cu2+ K: 2H+ + 2 ē → H2
4)A: Zn - 2 ē → Zn2+ K: 2H2O - 4 ē → O2 + 4H+
5)A: Zn - 2 ē → Zn2+ K: 2H+ + 2 ē → H2
9. На электродах гальванического элемента Якоби-Даниэля, состоящего из серебряной и свинцовой пластин, протекают следующие процессы:
1)A: Pb - 2 ē → Pb2+ K: Ag+ + 1 ē →Ag
2)A: Ag - 1 ē → Ag+ K: Pb2+ + 2 ē → Pb
3)A: Pb - 2 ē → Pb2+ K: 2H+ + 2 ē → H2
4)A: Pb - 2 ē → Pb2+ K: 2H2O - 4 ē →O2 + 4H+
5)A: Sn - 2 ē → Sn2+ K: Ag+ + 1 ē →Ag0
10. Гальванический элемент Вольта состоит из цинковой и медной пластин, опущенных в раствор серной кислоты. На электродах этого гальванического элемента протекают следующие процессы:
1)А: Zn – 2 ē → Zn2+ K: 2H+ + 2 ē → H2
2)А: Cu – 2 ē → Cu2+ K: 2H+ + 2 ē → H2
3)А: Zn – 2 ē → Zn2+ K: Cu2+ + 2 ē → Cu
4)А: Zn – 2 ē → Zn2+ K: 2H2O - 4 ē → O2 + 4H+
5)А: Cu – 2 ē → Cu2+ K: Zn2+ + 2 ē → Zn0
11. На электродах гальванического элемента Якоби-Даниэля., состоящего из цинковой и железной пластин, протекают следующие процессы:
1)А: Zn – 2 ē → Zn2+ K: Fe2+ + 2 ē → Fe
2)А: Zn – 2 ē → Zn2+ K: 2H+ + 2 ē → H2
3)А: Fe – 2 ē → Fe2+ K: 2H+ + 2 ē → H2
4)А: Fe – 2 e → Fe2+ K: Zn2+ + 2e → Zn
5)А: Fe – 2e → Fe2+ K 2H2O + O2 +4e → 4OH-
12. Наибольшую э.д.с. имеет гальванический элемент:
1)Zn / ZnCl2, 1M // CdCl2, 1M /Cd
2)Cd / CdNO3, 1M // AgNO3, 1M / Cd
3)Zn / ZnSO4, 1M // NiSO4, 1M / Ni
4)Mg / Mg(NO3)2, 1M // AgNO3, 1M / Ag
5)Mg / MgSO4, 1M // FeSO4, 1M / Fe
13. В гальваническом элементе Якоби-Даниэля при 298 К установилось равновесие:
Zn + 2Ag+ ←→ Zn2+ + 2Ag
Концентрация ионов Zn2+ составляет 0,01моль/л, концентрация ионов Ag+ составляет 0,001 моль/л. Э.д.с. данного гальванического элемента равна:
1)1,0 В
2)-1,44 В
3)1,44 В
4)1,56 В
5)0,04 В
14. Э.д.с. гальванического элемента
Zn / ZnSO4, 0,000001 M // ZnSO4, 0,01 M /Zn равна:
1)0,76 В
2)0,06 В
В
4)0,24 В
5)0,18 В
15. Краткая схема гальванического элемента Якоби-Даниэля имеет вид:
Zn / ZnSO4, 1M // CuSO4, 1M / Cu
Э.д.с. данного гальванического элемента равна:
1)0,32 В
В
3)-1,1 В
4)-0,32 В
5)0,5 В
16. Процессы, протекающие при контактной коррозии магния и железа в нейтральной водной среде, описываются уравнениями
1)А: Mg – 2e → Mg2+ K: 2H2O + O2 – 4e → 4OH-
2)А: Mg – 2e → Mg2+ K: 2H+ + 2e → H2
3)А: Mg – 2e → Mg2+ K: Fe2+ + 2e → Fe
4)А: Fe – 2e → Fe2+ K: 2H+ + 2e → H2
5)А: Fe – 2e → Fe2+ K: 2H2O + O2 –4e → 4OH-
17.Для протекторной защиты железа от коррозии в нейтральной водной среде применяется:
1)серебро
Цинк
3)медь
4)олово
5)свинец
18. Металлом, наиболее подверженным электрохимической коррозии при контакте с оловом, является:
Магний
2)свинец
3)кобальт
4)железо
5)медь
19. Электрохимическая коррозия железа в нейтральной водной среде описывается уравнением:
1)4Fe + 3O2 + 6H2O = 4Fe(OH)3
2)4Fe + 3O2 = 2Fe2O3
3)Fe + 3Cl2 = 2FeCl3
4)3Fe + C = Fe3C
5)3Fe + Si + Fe3Si
20. Процессы, протекающие при коррозии оцинкованного железа во влажном воздухе, описываются уравнениями:
1)А: Zn – 2e → Zn2+
K: Fe2+ + 2e → Fe
2)А: Zn – 2e → Zn2+
K: 2H+ + 2e → H2
3)А: Zn – 2e → Zn2+
K: 2H2O + O2 – 4e → 4OH-
4)А: Fe – 2e → Fe2+
K: 2H2O + O2 –4e → 4OH-
5)А:Fe – 2e → Fe2+
K: 2H+ + 2e → H2
21. Уравнение, отвечающее электрохимической коррозии металла:
1) 2Mg + O2 = 2MgO
2) Sn + O2 = SnO2
3)2Zn + O2 + 2H2O = 2Zn(OH)2
4) 2Pb + O2 = 2PbO
5) 4Fe + 3O2 = 2Fe2O3
22. Процесс отвода электронов с катодных участков при электрохимической коррозии называется:
Деполяризацией
2)ионизацией
3)диссоциацией
4)аэрацией
5)катодной защитой
23. Металлом, который может служить анодным покрытием на железе, является:
1)свинец
2)олово
3)медь
4)серебро
Магний
24. Процесс коррозии лужёного железа в кислой среде при нарушении целостности покрытия описывается уравнениями:
1)А: Fe – 2ē → Fe2+ K: 2H2O + O2 +4ē → 4OH-
2)А: Fe – 2ē→ Fe2+ K: 2H+ + 2ē → H2
3)А: Sn – 2ē → Sn2+ K: 2H+ + 2ē → H2
4)А: Fe – 2ē → Fe2+ K: Sn2+ + 2ē → Sn
5)А: Sn – 2ē → Sn2+ K: 2H2O + O2 +4ē → 4OH-
25. Атмосферная коррозия лужёного железа (покрытого тонким слоем олова) описывается уравнениями:
1)А: Fe – 2ē → Fe2+ K: 2H2O + O2 +4ē → 4OH-
2)А: Fe – 2ē → Fe2+ K: 2H+ + 2ē → H2
3)А: Sn – 2ē → Sn2+ K: 2H2O + O2 +4ē → 4OH-
4)А: Sn – 2ē → Sn2+ K: 2H+ + 2ē → H2
5)А: Fe – 2ē → Fe2+ K: Sn2+ + 2ē → Sn
