Химические свойства этилена: горение, качественные реакции (обесцвечивание бромной воды и раствора перманганата калия), гидратация, полимеризация.
Реакции присоединения
1. Гидрирование (гидрогенизация – взаимодействие с водородом):
CnH2n + H2 t, Ni → CnH2n+2
2. Галогенирование (взаимодействие с галогенами):
CnH2n + Г2 → СnH2nГ2
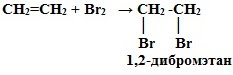
Это качественная реакция алкенов – бромная вода Br2 (бурая жидкость) обесцвечивается.
3. Гидрогалогенирование* (взаимодействие с галогенводородами):
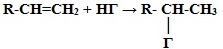
4. Гидратация* (присоединение молекул воды):
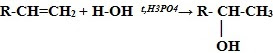
CH2=CH2 + H2O t,H3PO4→ CH3-CH2-OH (этанол – этиловый спирт)
* Присоединение галогенводородов и воды к несимметричным алкенам происходит по правилу Марковникова В.В.
Присоединение водорода происходит к наиболее гидрированному атому углерода при двойной углерод-углеродной связи.
Исключения!!!
1) Если в алкене присутствует электроноакцепторный заместитель, т.е. группа, способная оттягивать на себя электронную плотность:
F3C ← CH=CH2 + H-Br → F3C - CH2 - CH2(Br) 1,1,1- трифтор-3-бромпропан
2) Присоединение в присутствии Н2О2 (эффект Хараша) или органической перекиси (R-O-O-R ):
СH3-CH=CH2 + H-Br Н2О2 → H3C - CH2 - CH2(Br)
5. Реакции полимеризации:
nCH2=CH2 t, p, kat-TiCl4, Al(C2H5)3 → (-CH2-CH2-)n
мономер - этилен полимер – полиэтилен
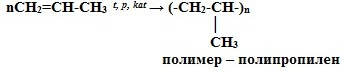
Реакции окисления
1. Горение:
CnH2n + 3n/2O2 t, p, kat → nCO2 + nH2O + Q (пламя ярко светящее)
Частичное окисление этилена

2. Окисление перманганатом калия (р. Вагнера) в нейтральной среде– это качественная реакция алкенов, розовый раствор марганцовки обесцвечивается.
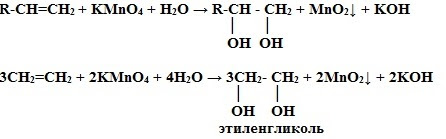
Влияние среды на характер продуктов реакций окисления
1) Окисление в кислой среде при нагревании идёт до а) карбоновых кислот; б) кетонов (если атом углерода при двойной связи содержит два заместителя); в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2):
а) 5CH3-CH=CH-CH3 + 8KMnO4 + 12H2SO4 → 10CH3COOH + 8MnSO4 +4K2SO4 + 12H2O
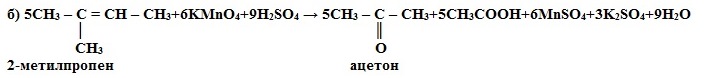
в) CH3 – CH2 – CH = CH2 + 2KMnO4 + 3H2SO4 → CH3CH2COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O
2) Окисление в нейтральной или слабощелочной среде на холоде (см. выше)
Применение этилена на основе свойств
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров (полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Вопросы для самоконтроля
| Задание 1 | Осуществите ряд превращений этан → этен (этилен) → этанол → этен → хлорэтан → бутан. |
| Задание 2 | Вычислите сколько литров и граммов этилена можно получить из 160 мл этанола, плотность которого равна 0,8 г/мл. |
| Решение 1 | Для получения этена (этилена) из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании: С2H6 →C2H4 + H2↑. Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной): С2H4 + H2O = C2H5OH. Для получения этена из этанола используют реакцию дегидротации: C2H5OH →(t, H2SO4) → C2H4 + H2O. Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования: С2H4 + HCl → C2H5Cl. Для получения бутана из хлорэтана используют реакцию Вюрца: 2C2H5Cl +2Na → C4H10 + 2NaCl. |
| Решение 2 | Этилен из этанола можно получить по реакции дегидратации, условием протекания которой является присутствие минеральных кислот (серной, фосфорной). Запишем уравнение реакции получения этилена из этанола: C2H5OH →(t, H2SO4) → C2H4 + H2O. Найдем массу этанола: m(C2H5OH) = V(C2H5OH) × ρ (C2H5OH); m(C2H5OH) = 160×0,8 = 128 г. Молярная масса (молекулярная масса одного моль) этанола, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 46 г/моль. Найдем количество вещества этанола: v(C2H5OH) = m(C2H5OH)/M(C2H5OH); v(C2H5OH) = 128/46 = 2,78 моль. Могласно уравнению реакции v(C2H5OH) : v(C2H4) = 1:1, следовательно, v(C2H4) = v(C2H5OH) = 2,78 моль. Молярная масса (молекулярная масса одного моль) этилена, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 28 г/моль. Найдем массу и объем этилена: m(C2H4) = v(C2H4) × M(C2H4); V(C2H4) = v(C2H4) ×Vm; m(C2H4) = 2,78 × 28 = 77,84 г; V(C2H4) = 2,78 ×22,4 = 62,272 л. |
| Ответ | Масса этилена – 77,84 г, объем этилена – 62,272 л. |
ПЛАН ЗАНЯТИЯ № 7
Дисциплина:Химия.
Тема:Диены и каучуки.
Цель занятия:изучить такой класс непредельных углеводородов как алкодиены, рассмотреть основные способы получения и химические свойства диеновых углеводородов, ознакомиться с такими органическими соединениями как каучуки и резина.
Планируемые результаты
Предметные:владеть основополагающими химическими понятиями: непредельные углеводороды, алкадиены, натуральный и синтетический каучуки, резина, уметь давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
Метапредметные:использовать основные методов познания для выявления причинно-следственных связей;
Личностные: уметь использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности.
Норма времени:2 часа
Вид занятия:Лекция
План занятия:
1) Понятие о диенах как углеводородах с двумя двойными связями. Сопряженные диены.
2) Химические свойства бутадиена-1,3 и изопрена: обесцвечивание бромной воды и полимеризация в каучуки.
3) Натуральный и синтетические каучуки. Резина.
Оснащение:Учебник.
Литература:
13. Химия 10 класс: учеб. для общеобразоват. организаций с прил. на электрон. Носителе (DVD) / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.
14. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель:Тубальцева Ю.Н.
Тема 7. ДИЕНЫ И КАУЧУКИ.
План:
1. Понятие о диенах как углеводородах с двумя двойными связями. Сопряженные диены.
2. Химические свойства бутадиена-1,3 и изопрена: обесцвечивание бромной воды и полимеризация в каучуки.
3. Натуральный и синтетические каучуки. Резина.
