Тема6. Реакционная способность вещества
Строение атома
Пример 1.Один из изотопoв урана имеет массовое число А = 238. Каков заряд ядра его атома? Сколько электронов нахoдится на электронных оболочках атома? Сколько протонов и нейтронов содержит ядро атома этого изотопа?
Решение.Заряд ядра атома Z равен числу протонов в ядре и числу электронов на электронных оболочках и совпадает с порядковым номером элемента. Для урана Z = 92. Ядро состоит из протонов, заряженных положительно, и нейтронов, не имеющих электрического заряда. Массы протона и нейтрона примерно одинаковы. Массовое число A равно сумме числа протонов Z и нейтронов N: А = Z + N. Отсюда число нейтронов в данном изотопе: N = А – Z = 238 – 92 = 146.
Пример 2. Составьте электронные формулы невозбужденных атомов селена и скандия. Приведите графические схемы распределения электронов по квантовым ячейкам (орбиталям). К каким электронным семействам относятся эти элементы? Укажите валентные электроны их атомов. Для каждого из валентных электронов приведите значения всех квантовых чисел.
Решение.Электронные формулы:
34 Se 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4
21 Sс 1s2 2s2 2p6 3s2 3p6 3d1 4s2
Графические схемы распределения электронов по квантовым ячейкам:
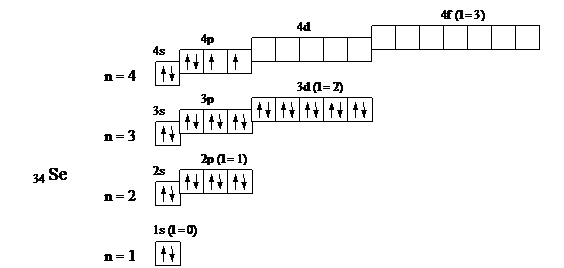
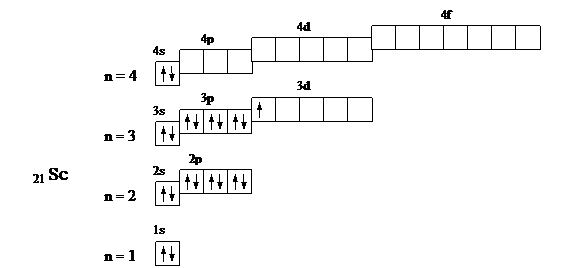
У селена происходит застройка p-подуровня, поэтому он относится к электронному семейству p-элементов; у скандия – застройка d-подуровня, он относится к электронному семейству d-элементов.
Валентными электронами p-элементов являются s и p электроны внешнего квантового уровня. Для селена это 4s2 4p4. Валентными электронами d-элементов являются s-электроны внешнего квантового уровня и d-электроны предвнешнего. Для скандия это 3d1 4s2. Номер группы указывает максимальное число валентных электронов. Значения квантовых чисел, характеризующих валентные электроны, очевидны из выше приведенных графических схем.
34 Se
| Номер электрона | Подуровень | Квантовые числа | |||
| n | e | me | ms | ||
| 4s | +½ | ||||
| –½ | |||||
| 4p | +1 | +½ | |||
| +1 | –½ | ||||
| +½ | |||||
| –1 | +½ |
21 Sc
| Номер электрона | Подуровень | Квантовые числа | |||
| n | e | me | ms | ||
| 4s | +½ | ||||
| –½ | |||||
| 3d | +2 | +½ |
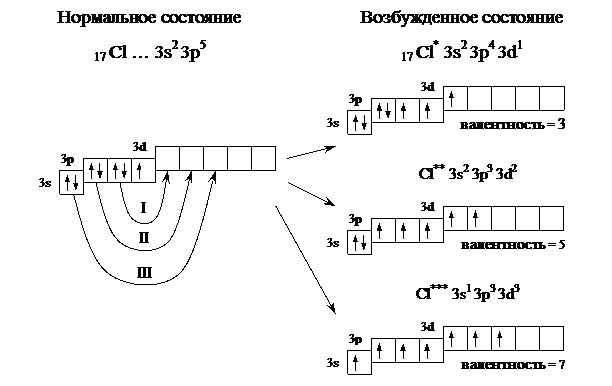
Пример 3. Определить возможные валентные состояния атома хлора (17 Cl).
Решение. Электронная формула 17 Cl – 1s2 2s2 2p6 3s2 3p5.
В нормальном сoстоянии атом хлора содержит один неспаренный электрон и его валентность равна единице. Однако у хлора есть пять свободных орбиталей 3d подуровня, за счет этого число неспаренных электронов, а следовательно и валентность, может увeличиваться. При возбуждении атома спаренные электроны внешнего уровня могут распариваться и переходить на свободные орбитали другого подуровня в пределах того же уровня. При возбуждении атома хлора происходит переход 3p-электронов, затем 3s-электрона на свободные d-орбитали. Число неспаренных электронов становится равным соответственно 3, 5 и 7. Хлор проявляет переменную валентность равную 1, 3, 5, 7. (2).