Химические символы и формулы
В химии, как и в каждой науке, есть своя система условных знаков, знание которой необходимо для понимания этого предмета.
Химическая символика – это своеобразный алфавит, с помощью которого записывают «слова» – формулы соединений и «фразы» – уравнения химических реакций, в той или иной мере отражающие реально происходящие процессы.
Еще в средневековье известные тогда химические элементы обозначали условными символами, такими же, какие использовали для обозначения небесных тел. Дело в том, что, по представлениям алхимиков, каждому из известных в то время элементов соответствовало свое небесное тело.
Некоторые представления алхимиков отражены в стихотворной форме:
Семь металлов создал свет –
По числу семи планет.
Дал нам космос на добро:
Медь, железо, серебро,
Злато, олово, свинец,
Сын мой, сера – их отец.
И спеши, мой сын, узнать:
Всем им ртуть – родная мать.
Обозначения небесных тел и «соответствующих» им химических элементов, принятые в средние века, представлены в таблице 4.
Таблица 4
Символы химических элементов, принятые в средние века
| Элемент | Золото | Серебро | Железо | Медь | Ртуть | Свинец | Олово |
| Небесное тело | Солнце | Луна | Марс | Венера | Меркурий | Сатурн | Юпитер |
| Символ |  | 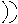 |  |  |  | 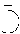 | 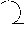 |
Безусловно, такие символы для обозначения химических элементов были не очень удобны. Более того, к 1800 году было известно около 34 химических элементов (правда, некоторые еще не были выделены как простые вещества, а были известны преимущественно в виде оксидов), и использование подобной символики стало невозможным.
Д. Дальтон предложил другие обозначения химических элементов, ниже приведены некоторые примеры этой символики:
Таблица 5
Символы химических элементов, предложенные Д. Дальтоном
| Водород | Азот | Углерод | Кислород | Сера | Фосфор | Железо | Медь | Свинец |
 |  |  |  |  |  |  |  | 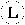 |
Как видно из этих примеров, в некоторых случаях Дальтон использовал начальные буквы английских названий элементов (например: железо – Iron, медь – Copper, свинец – Lead), обведенные кружком. Известный шведский химик XIX столетия Йенс Якоб Берцелиус, внесший большой вклад в разработку атомистической теории Дальтона, предложил совершенно новую символику для обозначения химических элементов. Он решил, что каждому химическому элементу должен соответствовать свой особый знак, который одновременно был бы и символом химического элемента и обозначал бы один атом. В качестве такого символа было предложено использовать начальную букву латинского названия элемента (например, водород – Hidrohenium – символ H, сера – Sulfur – S и т. п.). В тех случаях, когда названия двух элементов начинаются с одной и той же буквы, добавлялась вторая буква, входящая в название этого элемента, например, C – углерод, Cu – медь, Cd – кадмий. Так появились символы химических элементов, которыми пользуются во всем мире и поныне.
Некоторые элементы (например, железо, золото, свинец) известны с глубокой древности, и их названия имеют историческое происхождение.
В основу названий элементов, открытых за последние 300 лет, были положены различные принципы: по минералу, из которого впервые был выделен этот элемент, например, бериллий(по названию минерала – берилла), по названию страны – родины первооткрывателя, например, германий (нем. химик К. Винклер) в честь Германии, по некоторым свойствам, например, хлор (от греч. clwros – зеленый), фосфор (от греч. jws – свет, jerw – несу). Искусственные элементы получили свои названия в честь известных ученых, например, менделевий, эйнштейний.
Если символ химического элемента мысленно вписать в квадрат, то углы этого квадрата используют, при необходимости, для дополнительной информации:
| массовое число изотопа | заряд иона | |
| Э | ||
| Порядковый номер элемента (заряд ядра) | число атомов элемента в соединении |
С помощью химических символов элементов записывают химические формулы веществ. Например, формула серной кислоты H2SO4 показывает, что молекула этого соединения состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода. Используя химические формулы, записывают уравнения химических реакций, например:
C + O2 = CO2
HCl + NaOH = NaCl + H2O
В левую часть уравнения записывают вещества, вступающие в химическую реакцию (исходные вещества), а в правую – вещества, образующиеся в результате реакции (продукты реакции), причем число атомов каждого элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части (закон сохранения массы веществ).
Любая химическая формула – это условная запись, которая несет определенную информацию о данном веществе, и в зависимости от того, какую информацию хотят сообщить, пользуются различными формулами.
1°. Молекулярная формула (или брутто-формула) отражает только качественный и количественный состав соединения, т. е. показывает, атомы каких элементов и в каком количестве входят в состав данного вещества, и ничего не говорит о его строении, например:
| H2O | CH4 | C2H4 | NH3 |
| вода | метан | этилен | аммиак |
2°. Графическая формула (ее ошибочно часто называют структурной формулой) дает дополнительную информацию: кроме качественного и количественного состава она показывает, в какой последовательности атомы связаны друг с другом, а также указывает кратности связей (простая, двойная, тройная):
| H‑O‑H | 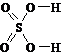 | 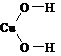 | 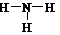 |
Однако эти формулы ничего не говорят о структуре молекул, т. е. не отражают относительное расположение атомов в пространстве.
3°. Электронная формула несет дополнительную информацию по сравнению с графической (хотя, по сути, очень на нее похожа) – показывает, какие из валентных электронов участвуют в образовании связей, а также наличие неспаренных электронов и неподеленных электронных пар:
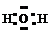 | 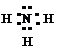 |
4°. Структурная формула изображается в масштабе, в соответствующей проекции, дающей объемное представление о молекуле и показывает относительное расположение атомов в пространстве. При необходимости к структурным формулам прилагаются таблицы, в которых указывают длины связей (расстояния между центрами связанных атомов) и валентные углы (углы между связями).
5°. Возможно использование и других вариантов формул для передачи соответствующей информации о молекуле или облегчающих восприятие информации, например
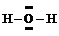 | 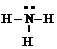 | ÿ BF3 |
ÿ показывает наличие свободной орбитали
Задачи с разбором
1. Сколько атомов водорода содержится в 1 л водорода при н. у.?
Решение. Т. к. 1 моль любого идеального газа занимает при н. у. 22,4 л, то в 1 л водорода (мы можем считать его приближенно идеальным газом) будет содержаться 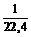 = 0,045 моль молекул водорода. Каждая молекула водорода состоит из двух атомов, значит, количество атомов в два раза больше: 2 × 0,045 = 0,09 моль. Чтобы найти, сколько атомов находится в этом количестве вещества, умножим его на число Авогадро:
= 0,045 моль молекул водорода. Каждая молекула водорода состоит из двух атомов, значит, количество атомов в два раза больше: 2 × 0,045 = 0,09 моль. Чтобы найти, сколько атомов находится в этом количестве вещества, умножим его на число Авогадро:
0,09 × 6,022 × 1023 = 5,4 × 1022 штук.
2. Какова масса 1 молекулы NaOH?
Решение. Рассчитаем сначала молекулярную массу NaOH в единицах а. е. м., исходя из значений атомных масс натрия, кислорода и водорода.
Mr(NaOH) = 23 + 16 + 1 = 40 а. е. м.
А теперь переведем в единицы СИ:
40 × 1,6606 × 10–27 = 6,64 × 10–26 кг.
3. Какая энергия выделяется при образовании атома гелия из элементарных частиц?
Решение. Атомная масса гелия 4,0026 а. е. м. Рассчитаем суммарную массу элементарных частиц, составляющих гелий:
2mp + 2mn + 2me = 2(1,007 + 1,009 + 5,5 × 10–4) = 4,0331 а. е. м.
Дефект массы составляет
4,0331 – 4,0026 = 3,05 × 10–2 а. е. м.
или
3,05 × 10–2 × 1,6606 × 10–27 = 5,1 × 10–29 кг.
Е = Dmc2 = 5,1 × 10–29 × (3 × 108)2 = 4,6 × 10–13 Дж.
4. А г СаО растворили в избытке воды массой В г. Выразите массовую долю вещества в полученном растворе.
Решение. Для решения этой задачи необходимо помнить, что при растворении оксида кальция в воде происходит реакция СаО + Н2О = Са(ОН)2, поэтому растворенным веществом будет гидроксид кальция.
w = 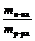 (´ 100%).
(´ 100%).
Массу вещества найдем по уравнению реакции:
m(Са(ОН)2) = М(Са(ОН)2) × 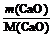 = 74 ×
= 74 ×  = 1,32А.
= 1,32А.
Масса раствора складывается из массы веществ, образовавших этот раствор (поскольку в результате реакции не выпадает осадок и не выделяется газ, ничего вычитать не требуется) A + B. Таким образом, w = 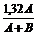 (´ 100%).
(´ 100%).
5. Смешали 11,2 л хлора и 22,4 л водорода. Найдите объемные доли газов в смеси после прохождения реакции.
Решение. Протекает реакция H2 + Cl2 = 2 HCl. Так как объемы газов пропорциональны их количествам веществ, то 1 объем водорода будет реагировать с 1 объемом хлора, при этом образуются 2 объема хлороводорода. Хлор в недостатке, он прореагирует полностью; 11,2 л водорода вступит в реакцию и еще 11,2 л останется. Хлороводорода получится 2 × 11,2 = 22,4 л.
Суммарный объем системы 11,2 + 22,4 = 33,6 л. Объемная доля водорода 11,2 / 33,6 = 0,33 (33%), хлороводорода 22,4 / 33,6 = 0,67 (67%), или
100 – 33 = 67%.
6. В сплаве содержится 40 % K и 60 % Na. Найдите мольные доли компонентов.
Решение. М(K) = 39, M(Na) = 23. Если в 100 г сплава содержится 40 г K, то это составляет 40 / 39 = 1,03 моль. 60 г натрия – это 60 / 23 = 2,61 моль. Общее количество вещества в 100 г сплава 1,03 + 2,61 = 3,64 моль. Отсюда мольные доли: калия 1,03 / 3,64 = 0,28 (28%), натрия 2,61 / 3,64 = 0,72 (72%), или 100 – 28 = 72%.
7. Соединение углерода с водородом содержит 75 % углерода по массе. Найдите формулу этого соединения.
Решение. Напишем формулу в общем виде: СхНу . Масса углерода в молекуле этого вещества пропорциональна 12х, водорода – у. Т. к. массовая доля углерода 75%, получаем: 12х : у = 75 : 25, отсюда х : у = 6,25 : 25 = 1 : 4. Искомая формула СН4.
8. Плотность газа по воздуху 0,55. Что это за газ?
Решение. Средняя молярная масса воздуха 29. Чтобы найти молярную массу газа, умножим 29 на плотность газа: 29 × 0,55 = 16. Эта молярная масса соответствует метану СН4, других вариантов нет.
Задачи для решения
1. Суммарный заряд какого количества электронов составляет 1 Кл? Какова масса 1 моль электронов?
2. Сколько атомов водорода содержится в 3 л воды а) при 20°С и 1 атм; б) при 150°С и 1 атм?
3. Какая энергия выделится при образовании из элементарных частиц 1 моль нуклидов 16О?
4. В избытке воды объемом 1 лрастворили х г калия. Какова массовая доля вещества в полученном растворе?
5. 16,8 л хлороводорода и 5,6 л бромоводорода растворили в 100 мл воды. Найдите массовые доли веществ в растворе.
6. При 2000°С степень термической диссоциации (т. е. мольная доля молекул, распавшихся под действием тепла) воды составляет около 2%. Рассчитайте мольные и объемные доли всех компонентов в равновесной смеси при этой температуре.
7. Рассчитайте массовую долю спирта в водном растворе с объемной долей 40%, если плотность спирта (при 20°С) 0,79 г/мл.
8. Слили два раствора: 10 г 20% хлорида бария и 20 г 10% сульфата калия. Найдите массовые доли всех растворенных веществ.
9. В соединении азота с водородом содержится 87,5% азота по массе. Найдите формулу этого соединения.
10. Некий газ имеет плотность по водороду 8,5. Что это за газ?
11. Изобразите графические формулы азота, оксида железа (III), фосфорной кислоты.
Глава II
Строение атома
Ранние модели атома
Изучение прохождения электрического тока через различные среды (газы, растворы, расплавы), проводившееся в прошлом столетии, дало первые экспериментальные факты, натолкнувшие на мысль о сложном строении атома.
В 30-х годах XIX века английский физик Майкл Фарадей установил, что электрохимические процессы характеризуются определенными соотношениями, которые указывают на то, что электрические заряды, так же как и материя, имеют дискретный характер, и существует некий минимальный заряд.
Эксперименты с газоразрядными трубками, проведенные во второй половине прошлого века, с очевидностью показали, что в состав атомов должны входить отрицательно заряженные частицы, которые впоследствии были названы электронами[3]. Эти опыты с разреженными газами имели достаточно простое оформление. В стеклянную трубку впаивали два электрода, затем трубку вакуумировали до давления примерно 10 мм рт. ст. (0,013 Па). На электроды подавали высокое напряжение (несколько киловольт) и по свечению стенок трубки и остаточных газов наблюдали поток частиц, которые перемещались от отрицательного электрода к положительному. Если на пути этого пучка устанавливали какое-либо препятствие, например, вертушку, то она начинала вращаться, указывая, что частицы имеют конечную массу. Если газоразрядную трубку помещали между пластинами плоского конденсатора, то поток частиц отклонялся к одной из них, а именно к той, которая заряжена положительно, что говорило об отрицательном заряде частиц.
В 1896 году Анри Беккерель, работая с соединениями урана, открыл явление радиоактивности – самопроизвольного распада атомов одного элемента и превращения их в атомы другого химического элемента. При этом было обнаружено, что такие превращения сопровождаются испусканием невидимых глазом излучений.
Несколько позже супруги Пьер Кюри и Мария Склодовская-Кюри обнаружили, что невидимое излучение испускают не только соединения урана, но и другие вещества. В результате кропотливой работы ими были открыты два новых химических элемента, которые были названы “радий” и “полоний”.
В 1899 г. Резерфорд обнаружил, что радиоактивные элементы испускают два вида излучений, которые он назвал a- и b-лучи. Позже было установлено, что радиоактивные вещества могут испускать три вида излучений: a, b и g. a-излучение представляет собой поток ядер атомов гелия и, соответственно, a-частицы имеют массу 4 а. е. м. и электрический заряд +2, b-лучи – это поток электронов, а g-лучи – электромагнитное излучение с очень короткой длиной волны[4].
Все эти экспериментальные факты говорили о том, что атом имеет сложное строение и в его состав должны входить электроны. А т. к. атом в целом является электронейтральной частицей, то отрицательный заряд электронов должен компенсироваться положительным зарядом.
Около 1900 г. Дж. Дж. Томсон предлагает первую модель атома, согласно которой положительный заряд равномерно заполняет весь объем атома, а отрицательный, представленный электронами, вкраплен в эту положительно заряженную сферу. Эта модель получила название «пудинг Томсона». Все полученные к тому времени экспериментальные данные модель объяснить не могла. Она в какой-то мере объясняла опыты Фарадея и эксперименты с газоразрядными трубками, но не могла ответить на самый главный вопрос: «как вообще может существовать такая система электрических зарядов?»[5] Несмотря на это, ученые некоторое время пользовались этой моделью.
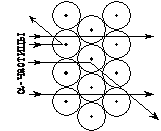
Рис. 1. Опыт по прохождению a-частиц через вещество.
В 1910 г. студенты Резерфорда Ханс Гейгер и Эрнест Марсден проводили эксперименты по бомбардировке a-частицами тонких металлических пластинок. Они обнаружили, что большинство a-частиц проходят через фольгу, не изменяя своей траектории. И это было неудивительно, если принять правильность модели атома Томсона.
Удивительным было как раз то, что некоторые частицы отклонялись от первоначальной траектории и к всеобщему удивлению примерно 1 из 20 000 a-частиц отклонялась на угол близкий к 180°, т. е. отскакивала обратно (см. рис. 1).
Из результатов этого эксперимента можно было сделать следующие выводы:
1) в атоме есть некоторое «препятствие», которое было названо ядром;
2) ядро имеет положительный заряд (иначе положительно заряженные a-частицы не отражались бы назад);
3) ядро имеет очень маленькие размеры по сравнению с размерами самого атома (лишь незначительная часть a-частиц изменяла направление движения);
4) ядро имеет большую массу, по сравнению с массой a-частиц.
Эксперименты по рассеянию a-частиц позволили также оценить размеры ядер и атомов:
‑ ядра имеют диаметры порядка 10–15 – 10–14 м,
‑ атомы имеют диаметры порядка 10–10 м.
Для объяснения полученных результатов Резерфорд выдвинул идею планетарного строения атома. Он рассматривал атом как подобие Солнечной системы: в центре – ядро, содержащее основную массу и весь положительный заряд атома, а вокруг, по разным орбитам, вращаются электроны. Эта модель довольно хорошо объясняла накопившийся к тому времени экспериментальный материал, но страдала двумя недостатками:
1) В соответствии с уравнениями классической электродинамики заряженная частица, движущаяся с ускорением (а электрон в атоме движется с центростремительным ускорением), должна излучать энергию. При этом потеря энергии должна приводить к уменьшению радиуса орбиты и падению электрона на ядро.
2) Непрерывное изменение траектории электрона должно способствовать и непрерывному изменению частоты излучения и, следовательно, непрерывному спектру испускания. Но эксперименты показывали, что спектр испускания водорода, а также других атомов, находящихся в газообразном состоянии, состоит из нескольких полос, т. е. имеет дискретный характер.
Выход из создавшегося положения был найден в 1913 году датским физиком Нильсом Бором, который предложил свою теорию строения атома. При этом он не отбрасывал полностью прежние представления о планетарном строении атома, но для объяснения устойчивости такой системы сделал предположение, что законы классической физики не всегда применимы для описания таких систем, как атомы, и сформулировал два постулата.
Первый постулат Бора. Электроны могут вращаться вокруг ядра по строго определенным стационарным орбитам, при этом они не излучают и не поглощают энергию.
Второй постулат Бора. При переходе с одной орбиты на другую электрон поглощает или испускает квант энергии.
Бор предположил, что момент импульса для электрона в атоме может принимать дискретные значения, равные только целому числу квантов действия 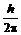 , что математически может быть записано так:
, что математически может быть записано так:
mvr = 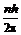 , (7)
, (7)
где m – масса электрона, v – линейная скорость его вращения, r – радиус орбиты, n – главное квантовое число, принимающее целочисленные значения от 1 до бесконечности, а h = 6,625 × 10–34 Дж/с – постоянная Планка. Уравнение (7) представляет собой математическое выражение первого постулата Бора.
Энергия электрона на соответствующей орбите определяется выражением:
E = 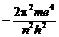 . (10)
. (10)
В этом уравнении, все величины, кроме n, являются константами. Таким образом, энергия электрона в атоме определяется значением главного квантового числа. Для атома водорода при n = 1, E = 2,176 × 10–18 Дж, или 13,6 эВ (1 электронвольт – это энергия, которую приобретает электрон, проходя разность потенциалов в 1 вольт, и равна 1,6 × 10–19 Дж).
Используя приведенные выше уравнения, Бор рассчитал спектр излучения атома водорода.
В атоме водорода электрон имеет минимальную энергию на первой орбите. Такое состояние электрона называется основным, или не возбужденным. Если этому электрону сообщить достаточную энергию, то он может перейти на другую орбиту с большим радиусом, например на орбиту № 2, 3 и т. д., в зависимости от сообщенной энергии. Такое состояние называется возбужденным, оно является неустойчивым. Электрон может находиться на этих орбитах непродолжительное время, а затем переходит на другую орбиту с меньшей энергией, в конечном итоге возвращаясь в основное состояние. При этих переходах происходит испускание энергии в виде электромагнитного излучения.
В 1900 г. Планк предположил, что излучение и поглощение энергии может происходить только строго определенными порциями, названными им квантами. Частота излучения связана с энергией уравнением:
E = hn или E =  , (11)
, (11)
где c – скорость света в вакууме равная 3 × 108 м/с. Поэтому частота этого излучения зависит от разности между энергиями уровней (DE ). В зависимости от длины волны l это излучение может относиться к различным областям спектра: рентгеновской, ультрафиолетовой, видимой или инфракрасной. На рис. 2 схематически показаны переходы электрона в возбужденном атоме водорода, которые вызывают излучение в различных областях спектра.
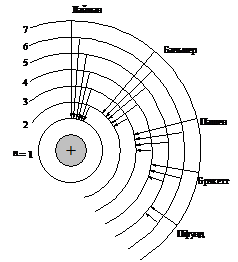
Рис. 2. Электронные переходы в атоме водорода,
соответствующие разным сериям.
Расчеты Бора оказались в великолепном согласии с результатами, полученными экспериментально (см. табл. 6).
Таблица 6
Длины волн спектральных линий в серии Бальмера (видимая область)
| l, нм (эксперимент) | l, нм (расчетные) |
| 656,466 | 656,47 |
| 486,271 | 486,28 |
| 434,171 | 434,17 |
| 410,291 | 410,293 |
| 397,12 | 397,123 |
При детальном изучении спектральных линий оказалось, что некоторые из них представляют собой не одну, а несколько близко расположенных линий. Это указывало на то, что существуют различные орбиты, на которых электроны имеют близкие значения энергий. Для объяснения этого факта Зоммерфельд предположил, что электроны могут вращаться не только по круговым, но и по эллиптическим орбитам.
Однако теория Бора не являлась универсальной. С ее позиций нельзя было описать поведение атома водорода в магнитном поле. Не удается также объяснить образование молекулы водорода, возникают непреодолимые трудности принципиального характера при описании многоэлектронных атомов. Боровская теория в химии практически не используется.
Указанные трудности можно преодолеть, если подходить к описанию строения атома с позиций более широкой теории – квантовой механики, рассматривающей поведение частиц в микромире. Законы, которые описывают явления, происходящие в микромире, существенно отличаются от законов, описывающих поведение макротел. Квантовое число n, которое было искусственно введено в теории Бора, оказывается с точки зрения квантовой теории неизбежным следствием более общих законов.
Двойственная природа микромира была впервые установлена для света. С одной стороны, для света характерны такие явления как интерференция и дифракция, которые могут быть объяснены только с позиций его волновой природы. С другой стороны, явление фотоэффекта с позиций этой теории описать невозможно. Это можно сделать, предположив для света корпускулярную (от лат. corpusculum – частица) природу. В 1905 г. Эйнштейн высказал мысль, согласно которой свет испускается в виде частиц, названных фотонами или квантами. Каждый фотон обладает энергией, определяемой уравнением (11).
Из корпускулярной природы света следовало, что фотоны должны обладать определенной массой. Масса покоя фотона равна нулю, а при движении фотон приобретает динамическую массу. Для вычисления этой массы Эйнштейн предложил уравнение эквивалентности массы и энергии:
E = mc2. (12)
Объединяя уравнения (11) и (12) получим:
m =  ; p = mc =
; p = mc = 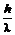
или
l = 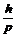 , (13)
, (13)
где p – импульс фотона.
В 1924 г. французский физик де Бройль исходя из представления о двойственной природе микромира, предположил, что электрон имеет определенную длину волны, которая укладывается на орбите целое число раз. Это означает, что 2pr = nl.
Предположение де Бройля в 1927 году получило экспериментальное подтверждение. Американские физики Девисон и Джермер наблюдали дифракцию электронов на кристаллах хлорида натрия.
В теорию Бора принцип квантования был введен произвольно. В ней в основном использовались законы классической механики. Открытие волновых свойств электрона, фотоэффект, опыты с абсолютно черным телом привели к созданию нового раздела физики – квантовой механики. Большую роль в ее создании сыграли Э. Шредингер и В. Гейзенберг.
Квантовомеханическая модель атома не такая наглядная, как модель, предложенная Бором, а математический аппарат квантовой механики несравненно сложнее. Поэтому основные положения квантовомеханической модели строения атома будут рассмотрены чисто качественно, без использования математического аппарата. Многое из того, что будет изложено в следующем разделе, читателю придется принять «на веру», без доказательств. Квантовые числа будут просто введены для описания поведения электрона в атоме, в то время как они являются следствием решения уравнения Шредингера.
