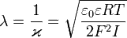Классификация дисперсных систем по агрегатному состоянию фаз , их виды и обозначения .?
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы «газ в жидкости» принято обозначение Г/Ж.
| Обозначение | Дисперсная фаза | Дисперсионная среда | Название и пример |
| Г/Г | Газообразная | Газообразная | Не образуют дисперсные системы |
| Ж/Г | Жидкая | Газообразная | Аэрозоли: туманы, облака |
| Т/Г | Твёрдая | Газообразная | Аэрозоли (пыли, дымы), порошки |
| Г/Ж | Газообразная | Жидкая | Газовые эмульсии и пены |
| Ж/Ж | Жидкая | Жидкая | Эмульсии: нефть, крем, молоко |
| Т/Ж | Твёрдая | Жидкая | Суспензии и золи: пульпа, ил, взвесь, паста |
| Г/Т | Газообразная | Твёрдая | Пористые тела: поролон, пемза |
| Ж/Т | Жидкая | Твёрдая | Капиллярные системы: жидкость в пористых телах, грунт, почва |
| Т/Т | Твёрдая | Твёрдая | Твёрдые гетерогенные системы: сплавы, бетон, ситаллы, композиционные материалы |
78-79
По размерам частиц дисперсные системы делят на три типа: 1. Грубодисперсные системы (суспензии, эмульсии, порошки, грубые взвеси) – размер ча-стиц больше 1 мкм (10 –6 м), а удельная поверхность меньше 1м 2 /г; 2. Системы средней дисперсности – частицы 1 – 0,1 мкм (10 –6 – 10 –7 м); Иногда их объединя-ют с грубодисперсными системами. 3. Коллоидно–дисперсные системы (или золи) имеют размер частиц 100 – 1 нм (10 –7 – 10 –9 м), а удельную поверхность больше 10 м 2 /г. Далее идут истинные (молекулярные и ионные) растворы, которые имеют размер частиц ме-нее 10 –9 м. Здесь уже нет поверхности раздела фаз и их неотносят кдисперсным системам. Таблица1. Отличиядисперсныхсистем и растворов Грубодисперсные системы Коллоидные системы Истинные растворы Непрозрачные Прозрачные,опалесциируют Прозрачные, неопалесциируют Имеют поверхность раздела Имеют поверхность раздела Не имеют поверхности раздела фаз фаз фаз Частицы не проходят через Частицы проходят через бу- Частицы проходят черезбумаж- бумажный фильтр мажный фильтр, нозадержива- ный фильтр и целлофан ются целлофаном Нестойкиекинетически и Относительностойкиекинети- Стойкиекинетически и термоди- термодинамически чески намически Современем стареют Современем стареют Современем не стареют Частицы видны воптический Частицы видны вэлектронный Частицы невидны всовремен- микроскоп микроскоп ных микроскопах
80.Классификация дисперсных систем по характеру взаимодействия ДФ и ДС. Основные отличия лоифобных коллоидов от лиофильных.
Измельченное вещество называют дисперсной фазой, а вещество, в котором распределена дисперсная фаза – дисперсионной средой. Степень раздробленности дисперсной системы можно охарактеризовать величиной, называемой дисперсностью. Она обратно пропорциональна поперечному размеру частиц дисперсной фазы: D = 1/a, где а –поперечный размер частиц. Форма частиц дисперсной фазы может быть различна – сферическая, кубическая, пластинчатая, нитевидная, цилиндрическая и др. Чем меньше размер частиц тем выше степень дисперсности.
Существует несколько видов классификации ДС. гетерогенные системы делят на твердые, жидкие, газообразные
2. По структуре
Выделяют два класса дисперсных систем:
– свободнодисперсные (суспензии, эмульсии, золи) – ДС в которых частицы дисперсной фазы могут свободно перемещаться в дисперсионной среде (майонез)
– связнодисперсные (капиллярно-пористые тела, конц. эмульсии, гели, пасты, студни, пены) – ДС в которых одна из фаз структурно закреплена и не может свободно перемещаться (мусс, самбук, пена пива).
3. По степени дисперсности (по размеру коллоидных частиц):
– грубодисперсные (>10-3 см) – частицы не проходят через фильтр, оседают в гравитационном поле (под действием силы тяжести), видны в обычный световой микроскоп;
– микрогетерогенные (10-5–10-3 см);
– ультрамикрогетерогенные (10-7–10-5 см) – собственно коллоидные частицы.
4. По характеру взаимодействия между частицами
– золи – бесструктурные коллоидные системы, обладающие текучестью, и содержащие частицы свободные от непосредственных связей друг с другом
– гели – структурированные коллоидные системы частично или полностью потерявшие текучесть, содержащие частицы связанные друг с другом межмолекулярными связями.
5. По интенсивности межфазового взаимодействия, т.е. по интенсивности межмолекулярных сил взаимодействия между дисперсной фазой и дисперсионной средой. Характерно только для систем с жидкой дисперсионной средой.
– лиофильные – сильные межмолекулярные взаимодействия между частицами, это все растворы ВМС (бульон паштет, сырковая масса, расплавленный жир с белковыми частицами). Образуются самопроизвольно
– лиофобные – слабые взаимодействия, эмульсии, суспензии и золи. Образуются с затратой энергии и термодинамически неустойчивы (самопроизвольно разделяются на ДФ и ДС).
Дисперсные системы широко распространены в природе и имеют большое значение в быту и технике. В приготовлении пищи широко используют масло, маргарин, майонез сметану, сливки, молоко, представляющие собой дисперсные системы. В основе физико-химических изменений, происходящих при тепловой обработке мяса, рыбы, яиц, при получении соусов, при взбалтывании сливок, белков, муссов, при черствении мучных изделий, отделении жидкостей от киселей и желе, осветлении бульонов и т.п. лежат процессы коллоидной химии. Коллоидные процессы лежат в основе хлебопечения, виноделия, пивоварения, кондитерского и других видов пищевых производств.
Различают 1) лиофильные коллоиды — более стойкие, так как имеют сильноевзаимодействие коллоидных частиц с дисперсионной средой и 2) лиофобные — частицы системы не обнаруживают сильного взаимодействия с растворителем, они легко разрушаются, малоустойчивы. Если в качестве дисперсионной среды используют воду, то коллоиды называют соответственно гидрофильными (растворы белков, клея, крахмала и др.) и гидрофобными (золи металлов, сульфидов и др.). Золи гидроксидов металлов занимают промежуточное положение между ними. [c.129]
Лиофильные и лиофобные коллоидные системы по устойчивости резко различаются между собой. Лиофильные системы, являющиеся молекулярными коллоидами(например, глины), диспергируются самопроизвольно, образуя термодинамическиустойчивые коллоидные растворы, в то время как лиофобные коллоиды не могут диспергироваться самопроизвольно. Формирующиеся при этом дисперсиитермодинамически неустойчивы и характеризуются высоким значением свободной поверхностной энергии на межфазной границе. Диспергирование лиофобных коллоидовосуществляется за счет внешней работы или химических процессов.
. 81-83
Условия и способы полученияколлоидных растворов. Термин “коллоидный” раствор предложил Томас Грем (от латинского слова cоlа – клей), ко-торый заметил их сходство с растворами клеящих веществ. Коллоидные растворы занимают промежуточное место между грубодисперсными системами и истинными растворами. Для приготовления коллоидных растворов необходимо придерживаться определенныхусловий: 1. Размеры частиц должны бытьв пределах10 –7 – 10 – 9 м. 2. Необходимы ионы электролитов, которые образуют ионный слой вокруг коллоидной ча-стицы, придавая ей стабильность. 3. Дисперсная фазагидрофобныхколлоидных растворовдолжна иметь низкую раствори-мостьвводе. Различают 2 группы методов получения коллоидных растворов: Дисперсионный ме-тод заключается в измельчении вещества до мелких частиц: 1) механическим способом (ша-ровые мельницы, гомогенизаторы, ультразвуковые дезинтеграторы); 2) физико-химическим способом – метод пептизации, когда осадок вещества переводиться в коллоидное состояние добавлением поверхностно–активных соединений - мыла, белков. Пептизацией называют переход осадков в коллоидный раствор под действием специальных стабилизирующих добавок (пептизаторов), либо за счет удаления из системы ионов, способствующих агрегации частиц. В роли пептизаторов могут выступать раствор электролита, поверхностно-активного вещества или растворитель. Пептизировать можно только свежеприготовленные осадки, в которых частицы коллоидного размера соединены в более крупные агрегаты через прослойки ДС. По мере хранения осадков происходят явления рекристаллизации и старения, приводящие к сращиванию частиц друг с другом, что препятствует пептизации. Пептизацию относят к методам диспергирования условно, т. к. в ее основе лежит и метод конденсации, т. е. предварительное получение агрегатов из истинных растворов. Метод пептизации, в отличие от другихдиспергационных методов, позволяет также добиться получения коллоидных систем с малым размером частиц (до1 нм),чтохарактерновосновном для методовконденсации. Конденсационный метод направлен на увеличение размеров частиц путем агрегации молекул или ионов. Для этого используют: 1) испарение растворителя, вследствиечего идет конденсация твердой фазы; 2) замена растворителя, например, если спиртовой раствор холе-стеринавылитьвводу; 3) использование реакций, в которых осадки формируются из мелких частиц. Так, получение коллоидного раствора йодидасеребра идет по реакции замещения: + KNO3¯ AgJ ®KJ + AgNO3 Коллоидные растворы можно получатьв реакцияхвосстановления,окисления и гидролиза: + H2O¯ 2Ag®Ag2O + H2 +2Н2О¯ 3 S®2 H2S+SO2 +3 HCl. 3¯ Fe(OH)3®FeCl3 +3H2O
84 Строение мицеллы лиозоля.
Мицелла лиозоля не является раз и навсегда сформированной и может претерпевать различные изменения. Так, при введении в золь индифферентного электролита происходит сжатие диффузной части двойного электрического слоя и радиус мицеллы уменьшается. Противоионы диффузного слоя проникают за плоскость скольжения и (n - x) возрастает, а х уменьшается, и, например, мицелла золя AgJ, для которой стабилизатором является KJ, будет иметь вид
m[AgJ] nJ- nK+
Если вводимый электролит имеет противоионы, отличные от противоионов мицеллы, идет обмен противоионами
85.Правило Панета-Фаянса. Структура дэс. Принципы его формирования
Правило Фаянса — Панета — правило, эмпирически установленное
К.Фаянсом и Ф.Панетом (1913),согласно которому
радиоактивный изотоп, присутствующий в растворе в
микроконцентрациях в формекатиона, тем сильнее сорбируется
выпадающим или заранее полученным осадком, чем меньше
растворимость соединения, которое образует этот катион с анионом
осадка. Правило Фаянса — Панетаприменимо при соосаждении в радиохимии.
Иная формулировка этого правила (также называемая правилом
Фаянса — Пескова Панета) гласит отом, что на поверхности твердого
вещества преимущественно адсорбируются ионы, которые могут
достраивать кристаллическую решетку, то есть входят в ее состав,
изоморфны или образуюттруднорастворимое соединение с ионами,
составляющими кристаллическую решетку. Эта формулировка
применяется для определении знака заряда поверхности
при образовании ДЭС в коллоидной химии.[1]
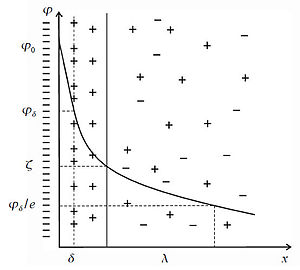
В отсутствие теплового движения частиц строение двойного электрического слоя было бы
подобно строению плоского конденсатора. Но в отличие от идеального случая, ДЭС в
реальных условиях имеет диффузное (размытое) строение. Согласно современной
теории структуру ДЭС составляют два слоя: Слой Гельмгольца или адсорбционный
слой, примыкающий непосредственно к межфазной поверхности. Этот слой имеет
толщину δ, равную радиусу потенциалопределяющих ионов внесольватированном состоянии.
Диффузный слой или слой Гуи, в котором находятся противоионы.
Диффузный слой имеет толщину λ, которая зависит от свойств системы и может достигать
больших значений. Толщина диффузного слоя рассчитывается по формуле: