Работа 3. энергетика химических реакций. термохимия
Основные понятия
Переходы энергии из одной формы в другую и от одной совокупности тел к другой в физико-химических процессах (изменение агрегатного состояния, растворение, химические реакции и т.д.), а также направление и возможность их осуществления в данных условиях изучает химическая термодинамика.
Термодинамической системой называется тело или совокупность тел, физически или мысленно выделенные из окружающей среды. Если система не обменивается с окружающей средой ни веществом, ни энергией, она называется изолированной. Такая идеализированная система является физической абстракцией, и ею пользуются как упрощенной моделью при рассмотрении термодинамических процессов, исключающих влияние внешней среды. Система, обменивающаяся с окружающей средой только энергией, называется закрытой. И, наконец, если осуществляется и энергетический, и материальный обмен - система открытая.
Состояние системы определяется термодинамическими параметрами состояния - температурой, давлением, концентрацией, объемом и т.д. Система характеризуется, кроме того, такими свойствами как внутренняя энергия U, энтальпия Н, энтропия S, энергия Гиббса G. Изменение этих свойств системы в ходе химических реакций характеризуют энергетику ее процессов. Перечисленные свойства системы зависят от температуры, давления, концентрации, поэтому они называются функциями состояния, не зависят от пути процесса и определяются только конечным и начальным состоянием системы.
Внутренняя энергия системы Uскладывается из энергии движения и взаимодействия молекул, энергии связи в молекулах, энергии движения и взаимодействия электронов и ядер и т.п.
Абсолютная величина внутренней энергии не может быть определена, но ее изменение при переходе системы из начального состояния в конечное в результате осуществления химического процесса поддается расчету. Если система получает некоторое количество тепла при постоянном давлении QР, последнее расходуется на изменение внутренней энергии системы DUи совершение работы А = РDV против внешних сил:
Qр= DU + РDV.
Это уравнение выражает закон сохранения энергии или первое начало термодинамики.
При изохорном процессе (V = const) поглощение или выделение тепла (тепловой эффект) связано только с изменением внутренней энергии:
QV = DU
В химии чаще всего рассматривают изобарные процессы (Р = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
│QP│ = │DH│,
DH = DU + PDV. (3.1)
Энтальпия имеет размерность энергии (кДж). Её величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется в кДж×моль–1.
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔН <0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔН >0.
Энтальпия, как и остальные термодинамические функции, для удобства сопоставления отнесена к некому стандартному состоянию веществ (Т=298К, Р=101325 Па, единице количества вещества). В этих условиях изменение термодинамических функций обозначают нижним индексом 298, и верхним индексом 0 (ΔН0298, S0298, ΔG0298). Обычно нижний индекс не указывают, тогда стандартные значения энтальпии, энтропии и энергии Гиббса принимают вид ΔН0, S0, ΔG0.
Уравнения химических реакций с указанием энтальпии процесса называют термохимическими. Численные значения энтальпии ΔН указывают через запятую в кДж и относят ко всей реакции с учетом стехиометрических коэффициентов всех реагирующих веществ. Поскольку реагирующие вещества могут находиться в разных агрегатных состояниях, то оно указывается нижним правым индексом в скобках: (т) - твердое, (к) - кристаллическое, (ж) - жидкое, (г) - газообразное, (р) - растворенное. Например, при взаимодействии газообразных Н2 и Cl2 образуются два моль газообразного НСl. Термохимическое уравнение записывается так
Н2 (г) + Cl2 (г) = 2НСl(г) , ΔН0 = –184,6 кДж.
При взаимодействии газообразных Н2 и О2 образующаяся Н2О может находиться в трёх агрегатных состояниях, что скажется на изменении энтальпии:
Н2 (г) + 0,5 О2 (г) = Н2О(г), ΔН0 = – 241,8 кДж
Н2 (г) + 0,5 О2 (г) = Н2О(ж), ΔН0 = – 286,8 кДж
Для процессов, протекающих в природе, характерно стремление систем перейти в состояние с наименьшей внутренней энергией и выделить теплоту. Так протекают экзотермические процессы. Одновременно со стремлением иметь минимум внутренней энергии система стремится перейти из более упорядоченного состояния к менее упорядоченному. Количественной мерой беспорядка является энтропия S. Возможность протекания эндотермических процессов обусловлена изменением энтропии.
Больцман определил энтропию как вероятность состояния (беспорядок) системы W.
Энтропия пропорциональна натуральному логарифму термодинамической вероятности состояния системы W[2]
S = k ln W,
где k – постоянная Больцмана, равная универсальной газовой постоянной R в расчете на одну молекулу 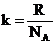 . Размерность энтропии одного моля вещества совпадает с размерностью универсальной газовой постоянной R, Дж∙моль–1∙К–1.
. Размерность энтропии одного моля вещества совпадает с размерностью универсальной газовой постоянной R, Дж∙моль–1∙К–1.
Таблица 3.1
Стандартные энтропии некоторых веществ (Дж∙моль–1 ∙К–1)
| Соединение | S0298 | Соединение | S0298 | Соединение | S0298 |
| С(т) алмаз | 2,37 | О2 (ж) | NO(г) | ||
| С(г) графит | 5,74 | О2 (т) | NO2 (г) | ||
| Н2 (г) | О3 (г) | N2O5 (г) | |||
| D2 (г) | Н2О(г) | СН4 (г) | |||
| О(г) | Н2О(ж) | С2Н6 (г) | |||
| О2 (г) | D2О(ж) | н-С4Н10 (г) | |||
| изо-С4Н10 (г) |
Энтропия кристаллических тел при абсолютном нуле равна нулю (Планк), поскольку W = 1.
Энтропия вещества или системы тел при определенной температуре является абсолютной величиной. В табл. 3.1 приведены стандартные энтропии S0 некоторых веществ.
Из табл. 3.1 следует, что энтропия зависит от:
1. Агрегатного состояния вещества; она увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию Н2О (т, ж, г); I2 (т, г).
2. Изотопного состава (Н2О и D2О).
3. Молекулярной массы однотипных соединений (СН4, С2Н6. н-С4Н10).
4. Строения молекулы (н-С4Н10, изо-С4Н10).
5. Кристаллической структуры (аллотропии) - алмаз, графит.
6. От температуры (рис. 3.1).
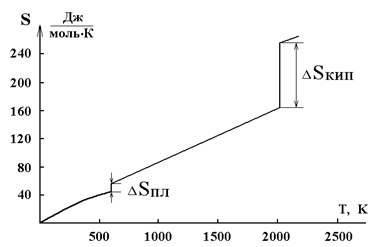
Рис. 3.1 Зависимость энтропии от температуры для свинца:
∆Sпл = 8 Дж∙моль-1 ∙К–1; Тпл = 600,5 К
∆Sкип = 88 Дж∙моль–1 ∙К–1; Ткип = 2013 К
Следовательно, стремление системы к беспорядку проявляется тем больше, чем выше температура. Произведение изменения энтропии системы на температуру ТDS количественно оценивает эту тенденцию и называется энтропийным фактором.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (DH),и энтропийным ТDS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или энергией Гиббса (∆G, кДж) :
DG = DH – ТDS.(3.2)
При ΔG<0 реакция термодинамически разрешена, и система стремится к достижению состояния ΔG=0, при котором наступает равновесное состояние обратимого процесса; ΔG>0 указывает на то, что процесс термодинамически запрещен.
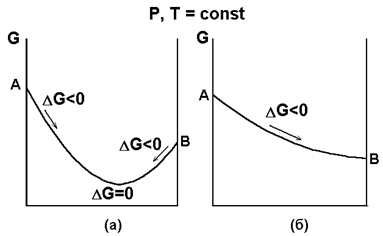
Рис. 3.2. Изменение G системы: (а) – обратимый процесс; (б) – необратимый процесс.
