Представление о белках как важнейшем классе органичских веществ и структурно-функциональном компоненте организма человка.
Представление о белках как важнейшем классе органичских веществ и структурно-функциональном компоненте организма человка.
Белки - высокомолекулярные азотистые органические вещества, построенные из аминокислот. Белки – основная и необходимая составная часть всех организмов. Именно Белки осуществляют обмен веществ и энергетические превращения, неразрывно связанные с активными биологическими функциями. Сухое вещество большинства органов и тканей человека и животных, а также большая часть микроорганизмов состоят главным образом из белков (40-50%)
Микроорганизмы обычно богаче белком. Белковые вещества лежат в основе важнейших процессов жизнедеятельности. Так, например , процессы обмена веществ ( пищеварение, дыхание, выделение, и другие) обеспечиваются деятельностью ферментов , являющихся по своей природе белками. К белкам относятся и сократительные структуры, лежащие в основе движения, например сократительный белок мышц, опорные ткани, покровы, состоящие главным образом из коллагенов, эластинов, кератинов, а также токсины, антигены и антитела, многие гормоны и другие биологически важные вещества.
Энгельс определил, что жизнь есть способ существования белковых тел, заключающийся в постоянном самообновлении химических составных частей этих тел.
В природе существует примерно 1010-1012 различных белков. Белками являются ферменты, антитела, многие гормоны и другие биологические активные вещества. Необходимость постоянного обновления белков лежит в основе обмена веществ. Именно поэтому белки и явились тем исключительным материалом , который послужил основой возникновения жизни на Земле. Ни одно вещество из всех веществ биологического происхождения не имеет столь большого значения и не обладает столь многогранными функциями в жизни организма как белки.
Белки содержат в среднем около 1 6% азота, 50-55% углерода , 21-23% кислорода , 15-17% азота , 6-7% водорода , 0,3-2,5% серы . В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах.
Классификация белков по их биологическим функциям.
Ферменты
Ферменты - специализированные белки, ускоряющие течение химических реакций. Благодаря ферментам в клетке скорости химических реакций возрастают в миллионы раз. Имеют активный центр, они специфически связывают определённый лиганд (или группу похожих лигандов) и катализируют определённый тип химического превращения данной молекулы.(рибонуклеаза)
Регуляторные белки
белковых гормонов, участвующих в поддержании постоянства внутренней среды организма, которые воздействуют на специфические клетки-мишени(гормон инсулин восстанавливает гомеостаз.)
белки, присоединение которых к другим белкам или иным структурам клетки регулирует их функцию.
Регуляторные ДНК-связывающие белки, могут регулировать скорость считывания генетической информации
Рецепторные белки
Сигнальные молекулы (гормоны, нейромедиаторы) действуют на внутриклеточные процессы
через взаимодействие со специфическими белками-рецепторами.
Транспортные белки
5. Структурные белки
Защитные белки
Некоторые белки, в частности иммуноглобулины, обладают способностью узнавать и связывать чужеродные молекулы, вирусные частицы и бактерии, в результате чего происходит их нейтрализация. Кроме того, комплекс чужеродной частицы с иммуноглобулином легко узнаётся и уничтожается клетками иммунной системы.
Сократительные белки
наделяют клетку способностью либо сокращаться, либо передвигаться. К таким белкам относят актин и миозин - фибриллярные белки, участвующие в сокращении скелетных мышц.
Физико-химические свойства белков. Молекулярный вес, размеры и форма, растворимость, ионизация, гидратация. Методы выделения индивидуальных белков.
Различия белков по форме молекул
по форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки
Суммарный заряд белков
Степень ионизации функциональных групп этих радикалов зависит от рН среды. В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО- + Н+ → -СООН. В щелочной среде связывание избытка ОН" с протонами, образующимися при диссоциации NH3+с образованием воды, приводит к уменьшению положительного заряда белков:-NH3+ +ОН- → -NH2 + H2O.
Растворимость белков
Растворимость зависит от всех свойств белков: формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ.
Гидратация -белки растворяются и набухают
получения индивидуальных белков - их очистка от других белков, находящихся в растворе, полученном из данной ткани.
Так как белки обладают конформационной лабильностью, при работе с белками следует избегать денатурирующих воздействий, поэтому выделение и очистка белков происходят при низких температурах.
На первых стадиях очистки белков целесообразно использовать методы, учитывающие какую-либо характерную особенность данного белка, например термостабильность или устойчивость в кислых растворах. Первыми методами очистки необходимо удалить из раствора основную массу балластных белков, которые значительно отличаются от выделяемого белка физико-химическими свойствами. Впоследствии применяют всё более тонкие методы очистки белка.(Очистка белков избирательной денатурацией, Высаливание, Гель-фильтрация, Ультрацентрифугирование, Электрофорез белков)
Транскрипция
Транскрипция – биосинтез иРНК на матрице ДНК. Процесс консервативный.
Ферменты синтеза:
а) РНК-полимераза I – синтезирует р-РНК
б) РНК-полимераза II – синтезирует и-РНК
в) РНК-полимераза III – т-РНК.
Транскрипция наяинается после присоединения фермента РНК-полимеразы к спецефической нуклеотидной последовательности(промотору),отмечающей в ДНК то место,с которого должен начаться синтез РНК. Присоединившись, РНК-полимераза раскручивает примерно один виток спирали ДНК и движется ,связывая между собой нуклеозидтрифосфаты(ЦТФ, ГТФ, УТФ, АТФ), комплементарные нуклеотидам матричной цепи ДНК. Фермент продолжает присоединять нуклеотиды к растущей цепи РНК до тех пор,пока не встретит на своем пути еще одну спец. нуклеотидную последовательность в Цепи ДНК-стоп-сигнал. Обычно в любом уч-ке двойной спирали ДНК транскрибируется только одна из двух цепей(КОДОГЕННАЯ).
На ДНК матрице обр. три вида РНК: мРНК, тРНК, рРНК. В виде мРНК генетическая информация для синтеза полипептида передается от ДНК к рибосомам; тРНК доставляет к рибосомам аминокислоты; Главный компанент рибосом является рРНК
Трансляция
Трансляцией называют осуществляемый рибосомой синтез белка из аминокислот на матрице информационной РНК .
- активация аминокислоты за счет спецефических ферментов=активированная а-та присоединяется к акцепторному стеблю за счет аминоацил-тРНК-синтетаз(-СООН-гр а-ты к 3*-ОН-концу тРНК за счет инергии) и образуется комплекс аминоацил тРНК
- инициация: имеется 2 субъединицы рибосом. К малой субъединице присоединяется комплекс тРНК(мет) с энергией и мРНК в области кэпа и инициирующего кодона АУГ. После связывания антикодона Мет-тРНК(мет) с кодоном АУГ происходит присоединение 60S-субъединицы рибосомы,с выделением энергии. в результате большая субъединица+малая=80S-рибосома(функциональный центр)+где в Р-центре нах Мет-тРНК(мет), А-центр свободен.
- элонгация: Связывание аа-тРНК в А-центре:в рибосому,у кот в Р-центре нах Мет-тРНК(мет), в А-центр присоединяется первая аа-тРНК. Между кодоном мРНК и антикодоном тРНК=комплементарность. аа-тРНК+мРНК=с использованием энргии(при уч-тии ЕF1)
Образование петидной связи: метионин от инициаторной тРНК переносится на альфа –амногруппу аа-тРНК, а в А-центре с обр-м дипептидил-тРНК. Катализируют пептидилтрансферазную р-ю рРНК большой субъединицей рибосомы.
Транслокация:рибосома перемещается на один кодон в направлении 5*3*. Дипептидил-тРНК из А-центра в Р-центр,а в А-центре оказывается след. кодон. тРНК(мет) покидает рибосому.
- Терминация происходит после включения в А-центр одного из кодонов терминации: УАГ, УГА,УАА. За счет факторов терминации происходит гидролитическое отщепление синтезированного полипептида от тРНК.
ВИТАМИНОПОДОБНЫЕ В ВЕЩЕСТВА
В 13 (оротовая кислота),
В 15 (пангамовая кислота),
В 4 (холин),
В 8 (инозит),
В т (карнитин),
Н 1 (Параминбензойная кислота),
F (полинасыщенные жирные кислоты),
U (S=метилметионин-сульфат-хлорид)
Биологические мембраны
Плазматическая мембрана
Плазматическая мембрана, окружающая каждую клетку, определяет её величину, обеспечивает транспорт малых и больших молекул из клетки и в клетку, поддерживает разницу концентраций ионов по обе стороны мембраны. Мембрана участвует в межклеточных контактах, воспринимает, усиливает и передаёт внутрь клетки сигналы внешней среды
Ядерная мембрана
Ядерная оболочка состоит из внешней и внутренней ядерных мембран. Ядерная оболочка имеет поры, через которые РНК проникают из ядра в цитоплазму, а регуляторные белки из цитоплазмы в ядро.
Аппарат Гольджи
Аппарат Гольджи - важная мембранная органелла, отвечающая за модификацию, накопление, сортировку и направление различных веществ в соответствующие внутриклеточные компартменты, а также за пределы клетки. Специфические ферменты мембраны комплекса Гольджи, гликозилтрансферазы, гликозилируя белки по остаткам серина, треонина или амидной группе аспарагина, завершают образование сложных белков - гликопротеинов.
Митохондриальные мембраны
Митохондрии - органеллы, окружённые двойной мембраной, специализирующиеся на синтезе АТФ путём окислительного фосфорилирования. Отличительная особенность внешней митохондриальной мембраны - содержание большого количества белка порина, образующего поры в мембране. Благодаря порину внешняя мембрана свободно проницаема для неорганических ионов, метаболитов и даже небольших молекул белков
Мембрана лизосом
Мембрана лизосом играет роль "щита" между активными ферментами (более 50), обеспечивающими реакции распада белков, углеводов, жиров, нуклеиновых кислот, и остальным клеточным содержимым. Мембрана содержит уникальные белки, например АТФ-зависимую протонную помпу (насос), которая поддерживает кислую среду (рН 5), необходимую для действия гидролитических ферментов (протеаз, липаз), а также транспортные белки, позволяющие продуктам расщепления макромолекул покидать лизосому
св-ва-;жидкостность: Двойной липидный слой мембраны имеет жидкокристаллическую структуру; положение молекул липидов упорядочено, но они сохраняют способность к диффузии в пределах слоя параллельно поверхности мембраны (латеральная диффузия). Поперечная диффузия (обмен молекул между слоями) возможна лишь в ограниченных размерах.
поперечная ассиметрия: Мембранные структуры клетки в норме замкнуты. Каждая мембрана имеет внутреннюю и внешнюю поверхность, которая обладает выраженной ассиметрией в плане расположения различных фосфолипидов. Например, фосфатидилхолин локализуется на внешней стороне мембраны эритроцита, а на внутренней расположены фосфатидилэтаноламины и фосфатидилсерины. В норме анионные фосфолипиды не присутствуют на внешней поверхности биомембран. Появление фосфатидилсерина (ФС) на внешней поверхности мембраны эритроцита является сигналом для выведения его из кровяного русла. Изменение асимметрии мембраны тромбоцита, приводящее к появлению ФС на внешней мембране, вносит свой вклад в развитие локальной реакции свертывания крови.
Цикл лимонной кислоты.
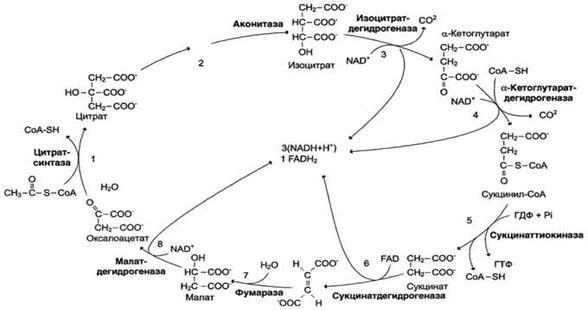
Цифры 1-8 обозначают реакции цитратного цикла. Цикл начинается с того, что ацетильный остаток конденсируется с оксалоацетатом, в результате чего образуется шестиуглеродное соединение - цитрат. На образование цитрата в каждом обороте цикла расходуется одна молекула оксалоацетата; в результате завершения цикла происходит регенерация оксалоацетата. Таким образом, одна молекула оксалоацетата может многократно использоваться для окисления ацетильных остатков.
Обмен и функции углеводов.
57 Основные углеводы животных,их содержание в тканях, биологическая роль. Основные углеводы пищи. Преваривание углеводов.
. Углеводы участвуют во многих метаболических процессах, но прежде всего они являются основными поставщиками энергии. На долю углеводов приходится примерно 75% массы пищевого суточного рациона и более 50% от суточного количества необходимых калорий. Следует отметить и структурную роль углеводов. Так, в виде гликозаминогликанов углеводы входят в состав межклеточного матрикса. Большое число белков (ферменты, белки-транспортёры, белки-рецепторы, гормоны) - гликопротеины, углеводная составляющая которых повышает их специфичность. Например, различия в строении олигосахаридных фрагментов клеточной оболочки эритроцитов обеспечивают групповую принадлежность крови. Из углеводов в процессе метаболизма образуется большое число органических соединений, которые служат исходными субстратами для синтеза липидов, аминокислот, нуклеотидов. Производные углеводов - глюкурониды - участвуют в детоксикации ксенобиотиков и инактивации веществ эндогенного происхождения. Углеводы могут быть синтезированы в организме с использованием других метаболитов: некоторых аминокислот, глицерина, молочной кислоты.
Биосинтез глюкозы.
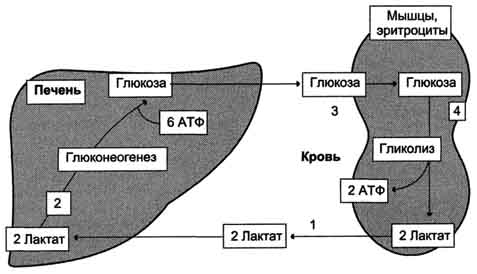
Цикл Кори
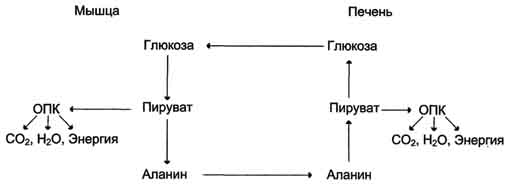
Цикл Кори

Обмен глюкозы в печени
Гликоген - разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Следовательно, точки ветвления в гликогене встречаются примерно через каждые десять остатков глюкозы. Так возникает древообразная структура с молекулярной массой >107Д, что соответствует приблизительно 50 000 остатков глюкозы.
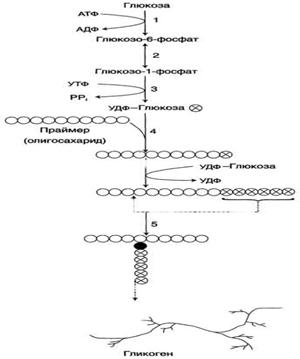 Синтез гликогена
Синтез гликогена
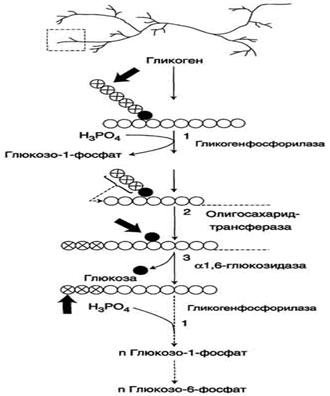 Распад гликогена
Распад гликогена
Таблица 7-5. Нарушения метаболизма фруктозы
| Неактивный фермент | Блокируемая реакция | Локализация фермента | Клинические проявления и лабораторные данные |
| Фруктокиназа | Фруктоза + АТФ → Фруктозе-1-фосфат + АДФ | Печень Почки Энтероциты | Фруктоземия, фруктозурия |
| Фруктозе-1-фосфатальдолаза | Фруктозе-1-фосфат → Дигидроксиацетон-3 -фосфат + Глицеральдегид | Печень | Рвота, боли в животе, диарея, гипогликемия, Гипофосфатемия, фруктоземия, гиперурикемия, хроническая недостаточность функций печени, почек. |
Непереносимость дисахаридов - нарушение переваривания дисахаридов (лактозы, сахарозы, мальтозы и др.) вследствие дефицита в кишечной слизистой ферментов дисахаридаз (лактазы и др.). Подобная интестинальная энзимопатия имеет генетическую природу, нередко встречается у нескольких членов одной и той же семьи. Приобретенная (вторичная) дисахаридазная недостаточность может развиваться при различных заболеваниях органов пищеварения (энтеритах, после резекции кишечника, язвенной болезни двенадцатиперстной кишки и др.). Чаще всего встречается непереносимость лактозы.
Обмен и функции липидов.
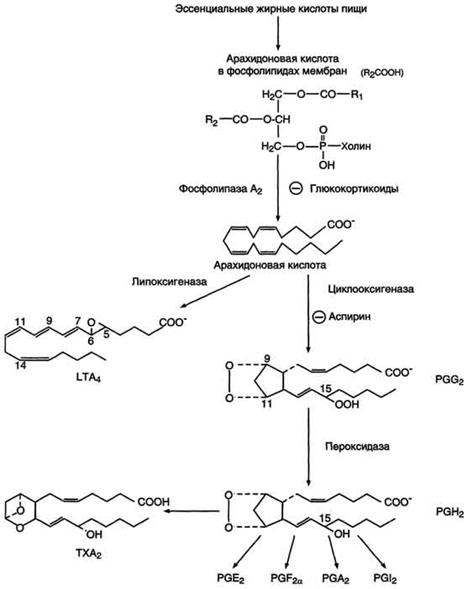
Рис. 8-44. Синтез полиеновых жирных кислот с 20 углеродными атомами в организме человека.
мембран. Под действием ассоциированной с мембраной фосфолипазы А2 жирная кислота отщепляется от глицерофосфолипида и используется для синтеза эйкозаноидов.
Биосинтез жирных кислот.
Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покояилипосле еды.
Условно можно выделить 4 этапа биосинтеза:
1. Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот.
2. Перенос ацетил-SКоА из митохондрий в цитозоль:
- может быть в комплексе с карнитином, также как переносятся высшие жирные кислоты, но здесь транспорт идет в другом направлении,
- обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК.
Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-лиазой до оксалоацетата и ацетил-SКоА.
Оксалоацетат в дальнейшем восстанавливается до малата, и последний либо переходит в митохондрии (малат-аспартатный челнок), либо декарбоксилируется в пируват малик-ферментом ("яблочный" фермент).
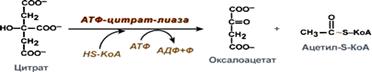
Образование ацетил-SКоА из лимонной кислоты
3. Образование малонил-SКоА из ацетил-SКоА.
Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой, мульферментным комплексом из трех ферментов.
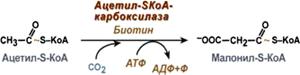
Образование малонил-SКоА из ацетил-SКоА
4. Синтез пальмитиновой кислоты.
Осуществляется мультиферментнымкомплексом "синтаза жирных кислот" (синоним пальмитатсинтаза) в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ).
Ацил-переносящий белок включает производное пантотеновой кислоты – 6-фосфопантетеин (ФП), имеющий HS-группу, подобно HS-КоА. Один их ферментов комплекса, 3-кетоацил-синтаза, также имеет HS-группу в составе цистеина. Взаимодействие этих групп обусловливает начало и продолжение биосинтеза жирной кислоты, а именно пальмитиновой кислоты. Для реакций синтеза необходим НАДФН.
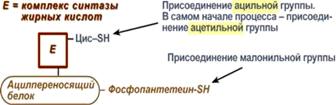
Активные группы синтазы жирных кислот
В первых двух реакциях последовательно присоединяются малонил-SКоА к фосфопантетеину ацил-переносящего белка и ацетил-SКоАк цистеину 3-кетоацилсинтазы.
3-Кетоацилсинтаза катализирует третью реакцию – перенос ацетильной группы на С2 малонила с отщеплением карбоксильной группы.
Далее кетогруппа в реакциях восстановления (3-кетоацил-редуктаза), дегидратации (дегидратаза) и опять восстановления (еноил-редуктаза) превращается в метиленовую с образованием насыщенного ацила, связанного с фосфопантетеином.
Ацилтрансферазапереносит полученный ацил на цистеин 3-кетоацил-синтазы, к фосфопантетеину присоединяется малонил-SКоА и цикл повторяется 7 раз до образования остатка пальмитиновой кислоты. После этого пальмитиновая кислота отщепляется шестым ферментом комплекса тиоэстеразой.
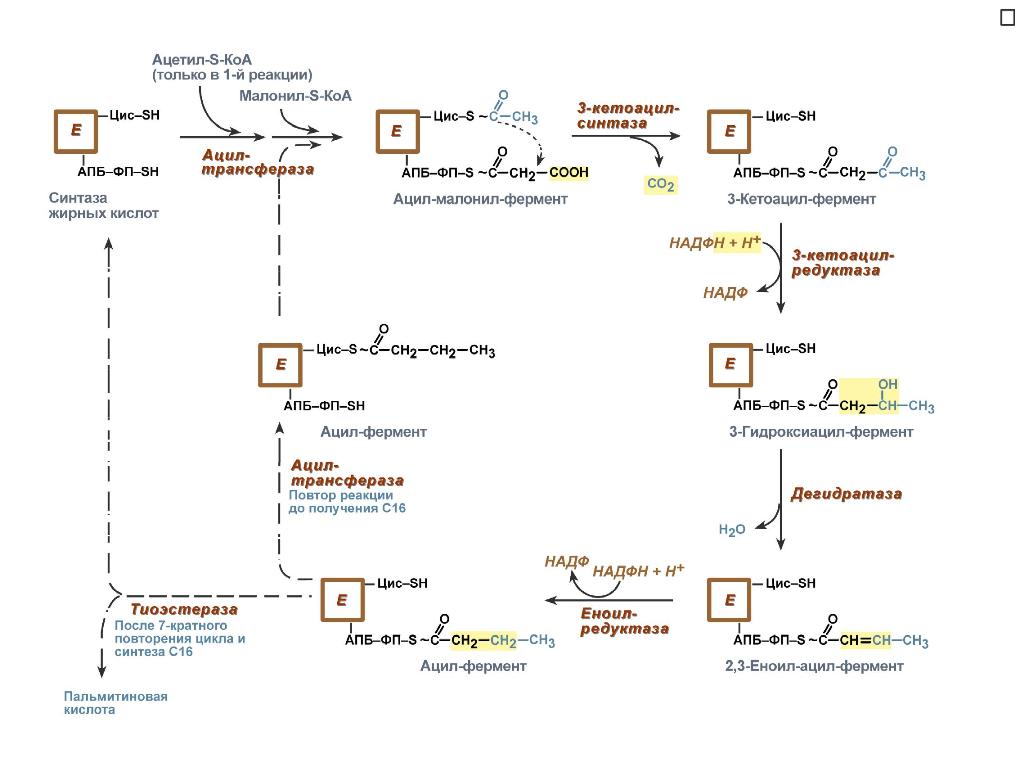
Удлинение цепи жирных кислот
Синтезированная пальмитиновая кислота при необходимости поступает в эндоплазматический ретикулум или в митохондрии. Здесь с участием малонил-S-КоА и НАДФН цепь удлиняется до С18 или С20.
Удлиняться могут и ненасыщенные жирные кислоты (олеиновая, линолевая, линоленовая) с образованием производных эйкозановой кислоты (С20). Но двойная связь животными клетками вводится не далее 9 атома углерода, поэтому ?3- и ?6-полиненасыщенные жирные кислоты синтезируются только из соответствующих предшественников.
Например, арахидоновая кислота может образоваться в клетке только при наличии линоленовой или линолевой кислот. При этом линолевая кислота (18:2) дегидрируется до γ-линоленовой (18:3) и удлиняется до эйкозотриеновой кислоты (20:3), последняя далее вновь дегидрируется до арахидоновой кислоты (20:4). Так формируются жирные кислоты ω6 ряда
Для образования жирных кислот ω3-ряда, например, тимнодоновой (20:5), необходимо наличие α-линоленовой кислоты (18:3), которая дегидрируется (18:4), удлиняется (20:4) и опять дегидрируется (20:5).
Реакции синтеза жирных кислот
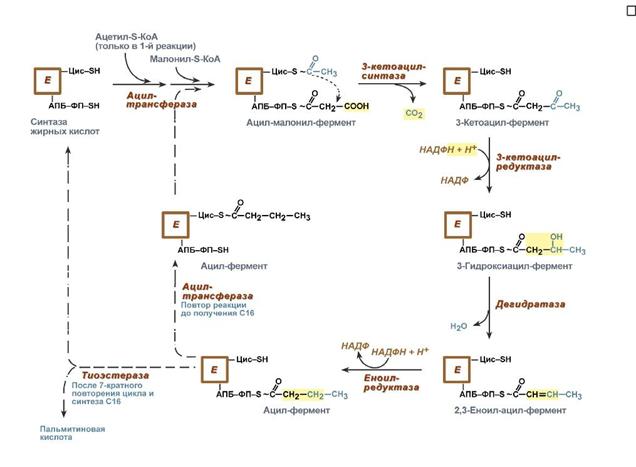
77.β-Окисление жирных кислот
β-Окисление - специфический путь катаболизма жирных кислот, при котором от карбоксильного конца жирной кислоты последовательно отделяется по 2 атома углерода в виде ацетил-КоА.
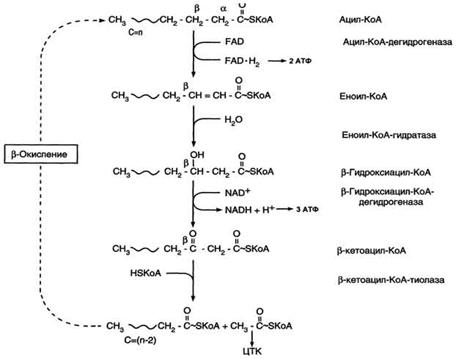
β-Окисление начинается с дегидрирования ацил-КоА FAD-зависимой ацил-КоА дегидрогеназой с образованием двойной связи между α- и β-атомами углерода в продукте реакции - еноил-КоА. Восстановленный в этой реакции кофермент FADH2 передаёт атомы водорода в ЦПЭ на кофермент Q. В результате синтезируются 2 молекулы АТФ В следующей реакции р-окисления по месту двойной связи присоединяется молекула воды таким образом, что ОН-группа находится у β-углеродного атома ацила, образуя β-гидроксиацил-КоА. Затем β-гидроксиацил-КоА окисляется NАD+-зависимой дегидрогеназой. Восстановленный NADH, окисляясь в ЦПЭ, обеспечивает энергией синтез 3 молекул АТФ. Образовавшийся β-кетоацил-КоА подвергается тиолитическому расщеплению ферментом тиолазой, так как по месту разрыва связи С-С через атом серы присоединяется молекула кофермента А. В результате этой последовательности из 4 реакций от ацил-КоА отделяется двухуглеродный остаток - ацетил-КоА. Жирная кислота, укороченная на 2 атома углерода, опять проходит реакции дегидрирования, гидратации, дегидрирования, отщепления ацетил-КоА. Эту последовательность реакций обычно называют "циклом β-окисления", имея в виду, что одни и те же реакции повторяются с радикалом жирной кислоты до тех пор, пока вся кислота не превратится в ацетильные остатки. Продуктами каждого цикла β-окисления являются FADH2, NADH и ацетил-КоА.Хотя реакции в каждом "цикле" одни и те же, остаток кислоты, который входит в каждый последующий цикл, короче на 2 углеродных атома. В последнем цикле окисляется жирная кислота из 4 атомов углерода, поэтому образуются 2 молекулы ацетил-КоА, а не 1, как в предыдущих. Суммарное уравнение β-окисления, например пальмитоил-КоА может быть представлено таким образом:
С15Н31СО-КоА + 7 FAD + 7 NAD+ + 7 HSKoA → 8 СН3-СО-КоА + 7 FADH2 + 7 (NADH + H+).
Если рассчитывать выход АТФ при окислении пальмитиновой кислоты), то из общей суммы молекул АТФ необходимо вычесть 2 молекулы, так как на активацию жирной кислоты тратится энергия 2 макроэргических связей
Ресинтез трацилглицеридов в стенке кишечника. Образование хиломикронов. Транспорт жиров.
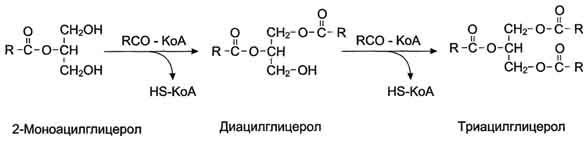
Образование хиломикронов
Жиры, образовавшиеся в результате ресинтеза в клетках слизистой оболочки кишечника, упаковываются в ХМ. Основной апопротеин в составе ХМ - белок апоВ-48. Этот белок закодирован в том же гене, что и белок ЛПОНП - В-100 который синтезируется в печени. В кишечнике в результате посттранскрипционных превращений "считывается" последовательность мРНК, которая кодирует только 48% от длины белка В-100, поэтому этот белок называется апоВ-48. Белок апоВ-48 синтезируется в шероховатом ЭР и там же гликозилируется. Затем в аппарате Гольджи происходит формирование ХМ, называемых "незрелыми". По механизму экзоцитоза они выделяются в хилус, образующийся в лимфатической системе кишечных ворсинок, и через главный грудной лимфатический проток попадают в кровь. В лимфе и крови с ЛПВП на ХМ переносятся апопротеины Е (апоЕ) и С-П (апоС-П); ХМ превращаются в "зрелые". ХМ имеют довольно большой размер, поэтому после приёма жирной пищи они придают плазме крови опалесцирующий, похожий на молоко, вид. ХМ транспортируют жир к различным тканям, где он утилизируется, поэтому концентрация ХМ в крови постепенно снижается, и плазма опять становится прозрачной. ХМ исчезают из крови в течение нескольких часов.
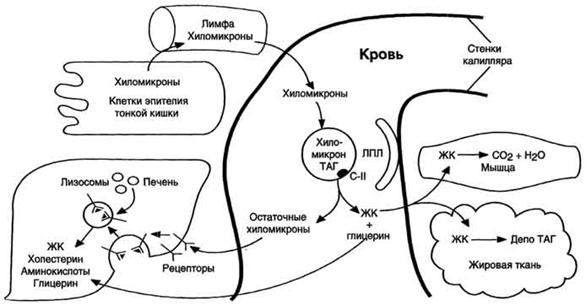
Рис. 8-20. Путь экзогенных жиров и хиломикронов. *ЛПЛ - липопротеинлипаза, ЖК - жирные кислоты.
Распад ГЕМА
Первая реакция катаболизма гема происходит при участии NADPH-зависимого ферментативного комплекса гемоксигеназы.Ферментная сисгема локализована в мембране ЭР, в области электронтранспортных цепей микросомального окисления. Фермент катализирует расщепление связи между двумя пиррольными кольцами, содержащих винильные остатки, - таким образом, раскрывается структура кольца. В ходе реакции образуются линейный тетрапир-рол - биливердин(пигмент жёлтого цвета) и монооксид углерода (СО), который получается из углерода метениловой группы. Биливердин восстанавливается до билирубина NADPH-зависимым ферментом биливердинредуктазой.Дальнейший метаболизм билирубина происходит в печени. Билирубин, образованный в клетках РЭС (селезёнки и костного мозга), плохо растворим в воде, по крови транспортируется в комплексе с белком плазмы крови альбумином. Эту форму билирубина называют неконъюгированным билирубином. Комплекс "альбумин-билирубин", доставляемый с током крови в печеНb, на поверхности плазматической мембраны гепатоцита диссоциирует. Высвобожденный билирубин образует временный комплекс с липидами плазматической мембраны. Облегчённая диффузия билирубина в гепатоциты осуществляется двумя типами белков-переносчиков: лигандина(он транспортирует основное количество билирубина) и протеина Z.Активность поглощения билирубина гепатоцитом зависит от скорости его метаболизма в клетке. В гладком ЭР гепатоцитов к билирубину присоединяются (реакция конъюгации) полярные группы, главным образом от глюкуроновой кислоты.Билирубин имеет 2 карбоксильные группы, поэтому может соединяться с 2 молекулами глюкуроновой кислоты, образуя хорошо растворимый в воде конъюгат - диглюкуронид билирубина (конъюгированный, или прямой, билирубин). Секреция конъюгированного билирубина в жёлчь идёт по механизму активного транспорта, т.е. против градиента концентрации. В норме диглюкуронид билирубина - главная форма экскреции билирубина в жёлчь, однако не исключается присутствие небольшого количества моноглюкуронида. В кишечнике поступившие билирубинглюкурониды гидролизуются специфическими бактериальными ерментами β-глюкуронидазами, которые гидролизуют связь между билирубином и остатком глюкуроновой кислоты. Освободившийся в ходе этой реакции билирубин под действием кишечной микрофлоры восстанавливается с образованием группы бесцветных тет-рапиррольных соединений – уробилиногенов.В норме большая часть бесцветных уробилиногенов, образующихся в толстой кишке, под действием кишечной микрофлоры окисляется в прямой кишке до пигмента коричневого цвета уробилинаи удаляется с фекалиями.
Нарушение обмена билирубина
Причинами гипербилирубинемии могут быть увеличение образования билирубина, превышающее способность печени экскретировать его, или повреждение печени, приводящее к нарушению секреции билирубина в жёлчь в нормальных количествах. Гипербилирубинемию отмечают также при закупорке желчевыводящих протоков печени. Пожелтение тканей из-за отложения в них билирубина называют желтухой.
Гемолитическая (надпечёночная) желтуха - результат интенсивного гемолиза эритроцитов. Она обусловлена чрезмерным образованием билирубина, превышающим способность печени к его выведению. Основная причина надпечёночной желтухи - наследственные или приобретённые гемолитические анемии. При гемолитических анемиях, вызванных сепсисом, лучевой болезнью, дефицитом глюкозо-6-фосфатдегидрогеназы эритроцитов, та-лассемией, переливанием несовместимых групп крови, отравлением сульфаниламидами, количество освобождающегося из эритроцитов гемоглобина за сутки может доходить до 45 г (при норме 6,25 г), что значительно увеличивает образование билирубина. Один из главных признаков гемолитической желтухи - повышение содержания в крови не-конъюгированиого (непрямого) билирубина.
Печёночно-клеточная (печёночная) желтуха обусловлена повреждением гепатоцитов и жёлчных капилляров, например, при острых вирусных инфекциях, хроническом и токсических гепатитах. Причина повышения концентрации билирубина в крови - поражение и некроз части печёночных клеток. Происходит задержка билирубина в печени, чему способствует резкое ослабление метаболических процессов в поражённых гепатоцитах, которые теряют способность нормально выполнять различные биохимические и физиологические процессы, в частности переводить конъюгированный (прямой) билирубин из клеток в жёлчь против градиента концентрации. При печёночно-клеточной желтухе повышается концентрация в крови как общего билирубина, так и обеих его фракций - неконъюгированного (непрямого) и конъюгированного (прямого).
Механическая, или обтурационная (подпечёночная), желтуха развивается при нарушении желчеотделения в двенадцатиперстную кишку. Это может быть вызвано закупоркой жёлчных протоков, например при желчнокаменной болезни, опухолью поджелудочной железы, жёлчного пузыря, печени, двенадцатиперстной кишки, хроническим воспалением поджелудочной железы или послеоперационным сужением общего жёлчного протока .
117.Диагностическое значение определения билирубина
В настоящее время для определения содержания билирубина в сыворотке (плазме) крови используют предложенный в 1916 г. Ван дер Бергом метод определения билирубина в сыворотке крови, основанный на диазореакции. В нормальном состоянии концентрация общего билирубина в плазме составляет 0,3-1 мг/дл (1,7-17 мкмоль/л), 75% от общего количества билирубина находится в неконъюгированной форме (непрямой билирубин). В клинике конъ-югированный билирубин называют прямым, потому что он водорастворим и может быстро взаимодействовать с диазореагентом, образуя соединение розового цвета, - это и есть прямая реакция Ван дер Берга. Неконъюгированный билирубин гидрофобен, поэтому в плазме крови содержится в комплексе с альбумином и не реагирует с диазореактивом до тех пор, пока не добавлен органический растворитель, например этанол, который осаждает альбумин. Неконъюгированный илирубин, взаимодействующий с азокрасителем только после осаждения белка, называют непрямым билирубином. Когда содержание билирубина превышает норму, говорят о гипербилирубинемии. В зависимости от того, концентрация какого типа билирубина повышена в плазме - неконъюгированного или конъюгированного, - гипербилирубинемию классифицируют как неконъюгированную и конъюгированную.
118.Токсичность кислорода:образование активных форм
молекулы кислорода могут принимать по одному электрону из различных реакций и превращаться в активные формы
О2+е---О2минус+е----Н2О2+е и Н---Н2О+ОНминус
к ативным формам относятся гидроксил гр-па,супероксиданион,перекись водорода
неферментативные формы-витамины Е, С, каротиноиды-могут останавливать развитие цепи свободнорадикальных реакций. Е-наиб активен действует в мембран липидах,кот н защищает от окисления
ферментативные-ряд ферментов,кот инактивируют активные формы кислорода,-супероксиддисмутаза,каталаза, глутатионпероксидаза
Биохимия крови.
Синтез билирубина
В клетках РЭС гем в составе гемоглобина окисляется молекулярным кислородом. В реакциях последовательно происходит разрыв метинового мостика между 1-м и 2-м пиррольными кольцами гема с их восстановлением, отщеплением железа и белковой части и образованием оранжевого пигмента билирубина.
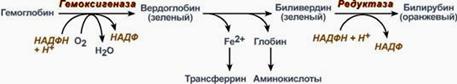
Реакции синтеза билирубина
Билирубин– токсичное, жирорастворимое вещество, способное нарушать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани.
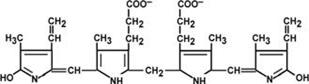
Строение билирубина
Выведение билирубина
Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбуминомплазмы, в гораздо меньшем количестве – в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов не позволяет выделяться билирубину с мочой. Билирубин в комплексе с альбумином называется свободный(неконъюгированный) или непрямойбилирубин.
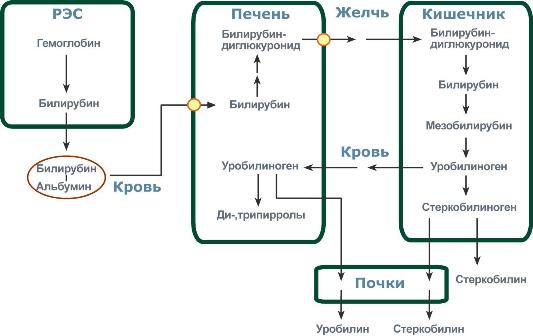
Превращение в кишечнике
В кишечнике билирубин подвергается восстановлению под действием микрофлоры до мезобилирубинаи мезобилиногена (уробилиногена). Часть последних всасывается и с током крови вновь попадает в печень, где окисляется до ди- и трипирролов. При этом в здоровом организме в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами. Оставшаяся в кишечнике часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается достеркобилиногенаи выделяется из организма, окрашивая кал. Незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда в почки и выделяется с мочой. На воздухе стеркобилиноген и уробилиноген превращаются, соответственно, в стеркобилини уробилин.
Биохимия нервной системы.
Представление о белках как важнейшем классе органичских веществ и структурно-функциональном компоненте организма человка.
Белки - высокомолекулярные азотистые органические вещества, построенные из аминокислот. Белки – основная и необходимая составная часть всех организмов. Именно Белки осуществляют обмен веществ и энергетические превращения, неразрывно связанные с активными биологическими функциями. Сухое вещество большинства органов и тканей человека и животных, а также большая часть микроорганизмов состоят главным образом из белков (40-50%)
Микроорганизмы обычно богаче белком. Белковые вещества лежат в основе важнейших процессов жизнедеятельности. Так, например , процессы обмена веществ ( пищеварение, дыхание, выделение, и другие) обеспечиваются деятельностью ферментов , являющихся по своей природе белками. К белкам относятся и сократительные структуры, лежащие в основе движения, например сократительный белок мышц, опорные ткани, покровы, состоящие главным образом из коллагенов, эластинов, кератинов, а также токсины, антигены и антитела, многие гормоны и другие биологически важные вещества.
Энгельс определил, что жизнь есть способ существования белковых тел, заключающийся в постоя<
