Современные представления о строении атома.
Периодическая система элементов Д.И. Менделеева
Периодический закон был открыт в 1869 году Д.И. Менделеевым . Им же была создана классификация химических элементов, выраженная в форме периодической системы. До Менделеева были предприняты попытки классификации и систематизации элементов, но неудачные. Менделеев был уверен, что между элементами существует закономерная связь. Он доказал это, расположив элементы по возрастанию, взяв за основу атомный вес, и обнаружил, что элементы, имеющие аналогичные химические свойства, встречаются через одинаковые интервалы. Эта закономерность была выражена в периодическом законе:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
При анализе периодической системы Менделеева было обнаружено:
Свойства химических элементов по мере возрастания атомного веса не изменяются бесконечно, а имеют периодический характер.
В таблице Менделеева существуют периоды и группы:
Периоды– это ряды элементов, в которых свойства элементов меняются последовательно. В таблице Менделеева 3 малых и 4 больших периода. Группы– это ряды элементов, обладающих сходными свойствами. В таблице Менделеева 8 групп.
Наибольшая валентность каждой группы по кислороду соответствует номеру группы, за некоторыми исключениями. Элементы первой группы образуют оксиды с общей формулой – R2O , второй – RO , третьей – R2O3и т. д.
Группы делятся на подгруппы: главную и побочную.
Значение периодической системы Менделеева.
Периодическая система элементов явилась первой естественной классификацией химических элементов, показавшей, что они взаимосвязаны друг с другом, а также послужила дальнейшим исследованиям.
Когда Менделеев на основе открытого им периодического закона составлял свою таблицу, многие элементы были еще неизвестны. Как, например, три элемента 4-го периода. Предположительно элементы назывались экабор (его свойства должны напоминать бор), экаалюминий, экасилициум. В течение 15 лет предсказания Менделеева подтвердились. Французский химик Лекок де Буабодраноткрыл галлий, обладающий всеми свойствами экаалюминия, Л.Ф. Нильсоноткрыл скандий, и К.А. Винклероткрыл элемент германий, имеющий свойства экасилиция.
Открытие Ga, Sc, Ge – доказательство существования периодического закона. Большое значение имела периодическая система и при установлении валентности и атомных масс некоторых элементов, исправив некоторые из них. На основе периодического закона в настоящее время созданы трансурановые элементы.
Гибридизация атомных орбиталей
При определении геометрической формы химической частицы следует учитывать, что пары внешних электронов центрального атома, в том числе и не образующие химическую связь, располагаются в пространстве как можно дальше друг от друга.
При рассмотрении ковалентных химических связей нередко используют понятие о гибридизации орбиталей центрального атома - выравнивание их энергии и формы. Гибридизация является формальным приемом, применяемым для квантово-химического описания перестройки орбиталей в химических частицах по сравнению со свободными атомами. Сущность гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Такая комбинация называется гибридной (гибридизованной) орбиталью. Как правило, гибридизация затрагивает лишь высшие и близкие по энергии атомные орбитали, занятые электронами.
В результате гибридизации появляются новые гибридные орбитали (рис.24), которые ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары (или неспаренные электроны) оказались максимально удаленными друг от друга, что соответствует минимуму энергии межэлектронного отталкивания. Поэтому тип гибридизации определяет геометрию молекулы или иона.
ТИПЫ ГИБРИДИЗАЦИИ
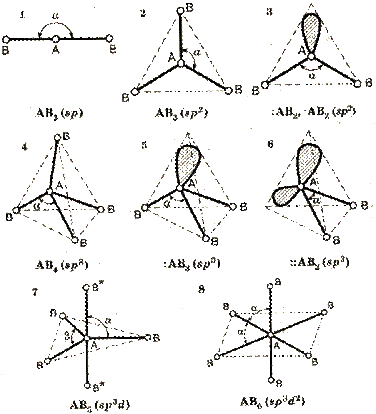
В гибридизации участвуют не только связывающие электроны, но и неподеленные электронные пары. Например, молекула воды содержит две ковалентные химические связи между 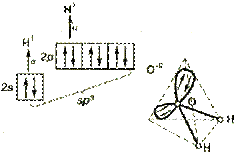 атомом кислорода и двумя атомами водорода.
атомом кислорода и двумя атомами водорода.
Помимо двух пар электронов, общих с атомами водорода, у атома кислорода имеются две пары внешних электронов, не участвующих в образовании связи (неподеленные электронные пары). Все четыре пары электронов занимают определенные области в пространстве вокруг атома кислорода.
Поскольку электроны отталкиваются друг от друга, электронные облака располагаются на возможно большем расстоянии друг от друга. При этом в результате гибридизации меняется форма атомных орбиталей, они вытянуты и направлены к вершинам тетраэдра. Поэтому молекула воды имеет угловую форму, а угол между связями кислород-водород равен 104,5o.
Для предсказания типа гибридизации удобно использовать донорно-акцепторный механизм образования связи: происходит перекрывание пустых орбиталей менее электроотрицательного элемента и орбиталей более электроотрицательного элемента с находящимися на них парами электронов. При составлении электронных конфигураций атомов учитывают их степени окисления − условное число, характеризующее заряд атома в соединении, рассчитанный исходя из предположения ионного строения вещества.
Чтобы определить тип гибридизации и форму химической частицы, поступают следующим образом:
находят центральный атом и определяют число σ-связей (по числу концевых атомов);
определяют степени окисления атомов в частице;
составляют электронную конфигурацию центрального атома в нужной степени окисления;
если это необходимо, проделывают то же самое для концевых атомов;
изображают схему распределения валентных электронов центрального атома по орбиталям, при этом, вопреки правилу Гунда, максимально спаривают электроны;
отмечают орбитали, участвующие в образовании связей с концевыми атомами;
определяют тип гибридизации, учитывая все орбитали, участвующие в образовании связи, а также неподеленные электроны; если валентных орбиталей недостаточно, используют орбитали последующих энергетических уровней;
по типу гибридизации определяют геометрию химической частицы.
Наличие π-связей не влияет на тип гибридизации. Однако наличие дополнительного связывания может привести к изменению валентных углов, поскольку электроны кратных связей сильнее отталкиваются друг от друга. По этой причине, например, валентный угол в молекуле NO2 (sp2-гибридизация) 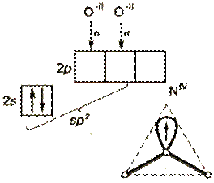 увеличивается от 120o до 134o.
увеличивается от 120o до 134o.
Кратность связи азот−кислород в этой молекуле равна 1,5, где единица отвечает одной σ-связи, а 0,5 равно отношению числа орбиталей атома азота, не участвующих в гибридизации (1) к числу оставшихся активных электронных пар у атома кислорода, образующих π-связи (2). Таким образом, наблюдается делокализация π-связей (делокализованные связи − ковалентные связи, кратность которых не может быть выражена целым числом).
В случае sp, sp2, sp3, sp3d2 гибридизации вершины в многограннике, описывающем геометрию химической частицы, равноценны, и поэтому кратные связи и неподеленные пары электронов могут занимать любые из них. Однако sp3d-гибридизации отвечает тригональная бипирамида, в которой валентные углы для атомов, расположенных в основании пирамиды (экваториальной плоскости), равны 120o, а валентные углы с участием атомов, расположенных в вершинах бипирамиды, равны 90o. Эксперимент показывает, что неподеленные электронные пары всегда располагаются в экваториальной плоскости тригональной бипирамиды. На этом основании делается вывод, что они требуют больше свободного пространства, чем пары электронов, участвующие в образовании связи. Примером частицы с таким расположением неподеленной электронной пары является тетрафторид серы (рис. 27). Если центральный атом одновременно имеет неподеленные пары электронов и образует кратные связи (например, в молекуле XeOF2), то в случае sp3d-гибридизации именно они располагаются в экваториальной плоскости тригональной бипирамиды (рис. 28).
Дипольные моменты молекул
Идеальная ковалентная связь существует лишь в частицах, состоящих из одинаковых атомов (Н2, N2 и т.д.). Если образуется связь между различными атомами, то электронная плотность смещается к одному из ядер атомов, то есть происходит поляризация связи. Характеристикой полярности связи служит ее дипольный момент.
Дипольный момент молекулы равен векторной сумме дипольных моментов ее химических связей (с учетом наличия неподеленных пар электронов). Если полярные связи расположены в молекуле симметрично, то положительные и отрицательные заряды компенсируют друг друга, и молекула в целом является неполярной. Так происходит, например, с молекулой диоксида углерода. Многоатомные молекулы с несимметричным расположением полярных связей (и, следовательно, электронной плотности) являются в целом полярными. Это относится, в частности, к молекуле воды.
 На результирующее значение дипольного момента молекулы может повлиять неподеленная пара электронов. Так, молекулы NH3 и NF3 имеют тетраэдрическую геометрию (с учетом неподеленной пары электронов). Степени ионности связей азот−водород и азот−фтор составляют 15 и 19%, соответственно, а их длины - 101 и 137 пм, соответственно. Исходя из этого, можно было бы сделать вывод о большем дипольном моменте NF3. Однако эксперимент показывает обратное. При более точном предсказании дипольного момента следует учитывать направление дипольного момента
На результирующее значение дипольного момента молекулы может повлиять неподеленная пара электронов. Так, молекулы NH3 и NF3 имеют тетраэдрическую геометрию (с учетом неподеленной пары электронов). Степени ионности связей азот−водород и азот−фтор составляют 15 и 19%, соответственно, а их длины - 101 и 137 пм, соответственно. Исходя из этого, можно было бы сделать вывод о большем дипольном моменте NF3. Однако эксперимент показывает обратное. При более точном предсказании дипольного момента следует учитывать направление дипольного момента
Тепловой эффект
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
§ Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
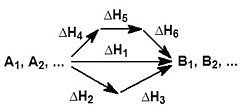

На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
ΔH1 = ΔH2 + ΔH3 = ΔH4 + ΔH5 + ΔH6
Закон открыт русским химиком Г.И. Гессом в 1840 г.; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
Следствия из закона Гесса
§ Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
§ Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
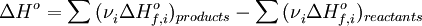
§ Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
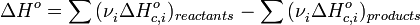
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т.н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры.
§ Если начальное и конечное состояния химической реакции (реакций) совпадают, то ее (их) тепловой эффект равен нулю.
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
§ Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
§ В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если реакцию проводят при стандартных условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHrO. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образования.
Стандартная энтальпия образования (стандартная теплота образования)
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
С(тв) + 2H2(г) = CH4(г) + 76 кДж/моль.
Стандартная энтальпия образования обозначается ΔHfO. Здесь индекс f означает formation (образование), а перечеркнутый кружок, напоминающий диск Плимсоля[1] — то, что величина относится к стандартному состояниювещества. В литературе часто встречается другое обозначение стандартной энтальпии — ΔH298,150, где 0 указывает на равенство давления одной атмосфере[2] (или, несколько более точно, на стандартные условия[3]), а 298,15 — температура. Иногда индекс 0 используют для величин, относящихся к чистому веществу, оговаривая, что обозначать им стандартные термодинамические величины можно только тогда, когда в качестве стандартного состояния выбрано именно чистое вещество[4]. Стандартным также может быть принято, например, состояние вещества в предельно разбавленном растворе. «Диск Плимсоля» в таком случае означает собственно стандартное состояние вещества, независимо от его выбора.
Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K. Например, для йода в кристаллическом состоянии ΔHI2(тв)0 = 0 кДж/моль, а для жидкого йода ΔHI2(ж)0 = 22 кДж/моль. Энтальпии образования простых веществ при стандартных условиях являются их основными энергетическими характеристиками.
Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции (следствие закона Гесса):
ΔHреакцииO = ΣΔHfO (продукты) — ΣΔHfO (реагенты)
Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиеcя выделением тепла в окружающую среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент которого максимален.
Скорость реакции.
Скорость химической реакции — изменение количества вещества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Например для реакции:
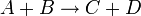
выражение для скорости будет выглядеть так:
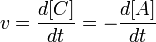 .
.
В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
§ природа реагирующих веществ,
§ наличие катализатора,
§ температура (правило Вант-Гоффа),
§ давление,
§ площадь поверхности реагирующих веществ.
Если мы рассмотрим самую простую химическую реакцию A + B → C, то мы заметим, что мгновенная скорость химической реакции величина непостоянная.
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C).Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
| При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза. |
Уравнение, которое описывает это правило следующее:
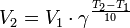
где 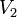 — скорость реакции при температуре
— скорость реакции при температуре 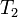 ,
, 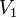 — скорость реакции при температуре
— скорость реакции при температуре 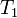 ,
, 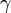 — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа имеет ограниченную область применимости. Ему не подчиняются многие реакции, например реакции, происходящие при высоких температурах, очень быстрые и очень медленные реакции. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
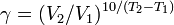
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции 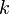 от температуры
от температуры 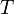 .
.
Согласно простой модели столкновений химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации 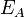 ), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией
), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией 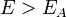 , пропорционально
, пропорционально 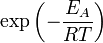 . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
. В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
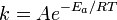
Здесь 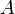 характеризует частоту столкновений реагирующих молекул,
характеризует частоту столкновений реагирующих молекул, 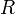 — универсальная газовая постоянная.
— универсальная газовая постоянная.
В рамках теории активных соударений 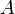 зависит от температуры, но эта зависимость достаточно медленная:
зависит от температуры, но эта зависимость достаточно медленная:
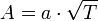
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений A на 10 %.
В рамках теории активированного комплекса получаются другие зависимости  от температуры, но во всех случаях более слабые, чем экспонента.
от температуры, но во всех случаях более слабые, чем экспонента.
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
Действия масс закон — устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии. Закон Действия масс установлен в 1864—1867 гг. К. Гульдбергом и П. Вааге. Согласно Закону Действия масс скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Закон Действия масс широко используется при различных расчетах химических процессов. Он позволяет решить вопрос, в каком направлении возможно самопроизвольное течение рассматриваемой реакции при заданном соотношении концентраций реагирующих веществ, какой выход нужного продукта может быть получен.
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Катализ
. Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость, называются катализаторами. Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции, протекающие под действием катализаторов, называются каталитическими.
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии,' чем без него, причем эти стадии энергетически более доступны.; Иначе говоря, в присутствии, катализатора возникают другие акти вированные комплексы, причем для их образования требуется меньше энергии, чем для образования активированных комплексов, возникающих без катализатора. Таким образом, энергия активации реакции понижается; некоторые молекулы, энергия которых была недостаточна для активных столкновений, теперь оказываются активными.
Соотношения между энергиями активации реакции в присутствии катализатора и без него показаны на рис. 66. Из рис. 66 ясно, что катализатор снижает энергию активации прямой и обратной реакции на одну и ту же величину. Отсюда следует, что катализатор в одно и то же число раз ускоряет и прямую, и обратную реакции.
Соотношение между количеством активных молекул в присутствии и в отсутствие катализатора показано на рис. 67.
Для ряда реакций промежуточные соединения изучены; как правило, они представляют собою весьма активные нестойкие продукты.
В химической промышленности катализаторы применяются весьма широко. Под влиянием катализаторов реакции могут ускоряться в миллионы раз и более. В некоторых случаях под действием катализаторов могут возбуждаться такие реакции, которые без них в данных условиях практически не протекают.
Различают гомогенный и гетерогенный катализ.
В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной фазы.
Примером гомогенного катализа может служить каталитическое разложение пероксида водорода в водном растворе на воду и кислород. Ионы Сг2От~, WO4-» MoOf", катализирующие разложение пероксида водорода, образуют с ним промежуточные соединения, которые далее распадаются с выделением кислорода.
Широкое применение в химической промышленности находит гетерогенный катализ. Большая часть продукции, вырабатываемой в настоящее время этой промышленностью, получается с помощью гетерогенного катализа. При гетерогенном катализе реакция протекает на поверхности катализатора. Отсюда следует, что активность катализатора зависит от величины и свойств его поверхности. Для того чтобы иметь большую («развитую») поверхность, катализатор должен обладать пористой структурой или находиться в сильно раздробленном (высокодисперсном) состоянии. При практическом применении катализатор обычно наносят на носитель, имеющий пористую структуру (пемза, асбест и др.).
Как и в случае гомогенного катализа, при гетерогенном катализе реакция протекает через активные промежуточные соединения. Но здесь эти соединения представляют собой поверхностные соединения катализатора с реагирующими веществами. Проходя через ряд стадий, в которых участвуют эти промежуточные соединения, реакция заканчивается образованием конечных продуктов, а катализатор в результате не расходуется.
В качестве примеров гетерогенно-каталитических реакций можно указать на окисление диоксида серы в триоксид при контактном методе производства серной кислоты, синтез аммиака, окисление аммиака при производстве азотной кислоты.
Очень большую роль играет катализ в биологических системах. Большинство химических реакций, протекающих в пищеварительной системе, в крови и в клетках животных и человека, являются каталитическими реакциями. Катализаторы, называемые в этом случае ферментами, представляют собой простые или сложные белки. Так, слюна содержит фермент птиалин, который катализирует превращение крахмала в сахар. Фермент, имеющийся в желудке, — пепсин — катализирует расщепление белков. В организме человека находится около 30 000 различных ферментов; каждый из них служит эффективным катализатором соответствующей реакции.
Влияние температуры
В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому.
N2 + 3H2 ⇄ 2NH3 + Q
Прямая реакция — экзотермическая, а обратная реакция — эндотермическая.
Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам: При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
Влияние давления
Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам: При повышении давления равновесие сдвигается в сторону уменьшения газовых молей при понижении давления равновесие сдвигается в сторону увеличения числа газовых молей N2 + 3H2 ↔ 2NH3
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
| давление, МПа | 0,1 | |||||
| объемная доля NH3, % | 0,4 |
Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
§ При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
§ При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями,концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Коллоидне растворы
Коллоидные растворы-жидкие коллоидные системы с частицами дисперсной фазы (мицеллами), свободно и независимо друг от друга перемещающимися в процессе броуновского движения. Золи с водной дисперсионной средой называют гидрозолями, с органическими - органозолями. ;
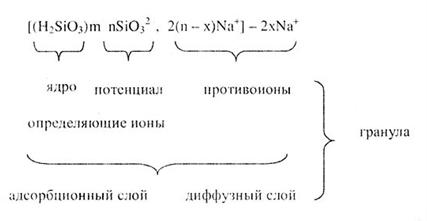
Коллоидные частицы имеют сложное строение. Они состоят из ядер и адсорбированных и притянутых ионов. Рассмотрим строение коллоидной частицы кремниевой кислоты, которая образовалась в результате взаимодействия очень разбавленных растворов силиката натрия и соляной кислоты (Na2Si03 + 2HCl = H2Si03 + 2NaCl). Если Na2Si03находится в избытке, то кремниевая кислота не выпадает в осадок, а образуется прозрачный коллоидный раствор H2Si03. Ядро коллоидной частицы нейтрально, оно состоит из m молекул H2Si03. На поверхности ядра адсорбируются n ионов Si032- , это потенциалопределяющие ионы, так как они обуславливают заряд частицы коллоидного раствора.
Адсорбированные потенциалопределяющие ионы притягивают из раствора ионы противоположного знака — противоионы. В данном случае это ионы Na+, причем часть их 2(n - х) адсорбируется на частице. Адсорбированные ионы Si032- вместе с противоионами Na+ образуют адсорбционный слой. Другая часть противоионов 2xNa+ находится в жидкой фазе и образует подвижный диффузный слой.
Ядро вместе с адсорбционным слоем называется гранулой.
В нашем примере гранула заряжена отрицательно, так как адсорбция ионов Si032- происходит сильнее, чем ионов Na-.
Коллоидная частица вместе с противоионами диффузионного слоя называется мицеллой. Это отдельная частица коллоидного раствора.
Мицелла (коллоидная частица)
Основные свойства
§ Коллоидные частицы не препятствуют прохождению света.
§ В прозрачных коллоидах наблюдается рассеивание светового луча (эффект Тиндаля).
§ Дисперсные частицы не выпадают в осадок за счёт броуновского движения.
Ге́ли (ед.ч. гель, от лат. gelo — «застываю») — дисперсные системы, характеризующиеся структурой, придающей им механические свойства твёрдых тел. Гель — это когерентная система, состоящая из как минимум двух компонентов, как минимум один из которых непрерывно простирается в растворителе. Гели образуются при коагуляции и последующей коалесценции золей. При высушивании гели необратимо разрушаются.
Гели широко используются для производства широчайшего набора продуктов домашнего потребления и бытовой химии, а также для лабораторных исследований методом электрофореза и др. (например, полиакриламидный гель).
Особенно популярен гель для волос, являющийся непременным культурным атрибутом стран Средиземноморья и Латинской Америки, где укладка волос гелем для создания эффекта мокрых волос или контрастного затемнения особенно популярна среди молодых людей.
Золи, коллоидные растворы (нем. sole от лат. solutio — раствор) — это ультрамикрогетерогенные дисперсные системы, размер частиц которых лежит в пределе от 1 до 100 нм (10−9—10−7м).
В зависимости от дисперсионной среды золи бывают твердыми, аэрозолями (газообразная дисперсионная среда) и лиозолями (жидкая дисперсионная среда). В зависимости от природы среды лиозоли называют гидрозолями (вода), органозолями (органическая среда) или, более конкретно, алкозолями (спирты), этерозолями (эфиры) и др. 3оли занимают промежуточное положение между истинными растворами и грубодисперсными системами (суспензиями, эмульсиями). Золи диффундируют медленнее, чем неорганические соли, обладают эффектом светорассеяния (Эффект Тиндаля).
Свойства
§ большая удельная поверхность;
§ адсорбция и плёнкообразование на поверхностях раздела;
§ агрегация, как следствие взаимодействия частиц;
§ частицы на поверхности обладают большей энергией, чем частицы внутри фазы.
Комплексные соединения
В 1893 опубликовал основополагающую работу «О строении неорганических соединений», в которой предложил координационную теорию строения комплексных соединений, основанную на нескольких постулатах (постулаты Вернера). Важнейшие пункты теории Вернера можно суммировать следующим образом:
§ Постулировано различие между первичной и вторичной валентностью атомов;
§ Введено понятие координационного числа центрального атома;
§ Значение координационного числа истолковано как число групп (лигандов), которые непосредственно связаны с центральным атомов (входят в т.н. внутреннюю сферу комплекса);
§ Разработано учение о пространственном расположении лигандов;
§ Разработан вопрос о реакционной способности групп и атомов, связанных с центральным атомом опосредованно (составляющих внешнюю сферу комплекса).
Для обоснования своей теории синтезировал множество комплексных соединений и разработал экспериментальные методы определения их состава и строения, разработал систематику всех известных тогда комплексов. В 1899предсказал существование оптически активных комплексных соединений, не имеющих асимметрического углеродного атома.
ОСНОВНЫЕ ПОНЯТИЯ КООРДИНАЦИОННОЙ ТЕОРИИ ВЕРНЕРА
При взаимодействии частиц наблюдается взаимная координация частиц, которую можно определить как процесс комплексообразования. Например, процесс гидратизации ионов заканчивается образованием аквакомплексов. Реакции комплексообразования сопровождаются переносом электронных пар и приводят к образованию или разрушению соединений высшего порядка, так называемых комплексных (координационных) соединений.
Особенностью ком
