Кулонометрия, теоретические основы метода. Косвенная кулонометрия. Внешняя и внутренняя генерация кулонометрическоготитранта. Определение конечной точки титрования.
.Кулонометрия, теоретические основы метода. Косвенная кулонометрия. Внешняя и внутренняя генерация кулонометрическоготитранта. Определение конечной точки титрования.Кулонометрия- основана на измерении количества электричества, необходимого для полного окисления или восстановления определяемого вещества, и расчете его количества на основе закона Фарадея.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КУЛОНОМЕТРИЧЕСКОГО МЕТОДА АНАЛИЗА Для всех вариантов кулонометрического метода характерен процесс электролиза, когда в электролизере происходит на ано де окисление, а на катоде — восстановление какого-то вещества. Электролиз, и соответственно кулонометрическое определение, можно проводить не только в растворах, но и в расплавах и газах. В растворах электролиз возникает при наложении извне определенного напряжения на оба электрода, вследствие чего в цепи возникает ток /э . При этом электроды приобретают соответствующие потенциалы — Еа и Ек, характерные для участвующих в электролизе веществ. Поскольку концентрация растворителя (обычно воды) всегда намного больше, чем концент рация растворенных в нем веществ, то его разложение (окисление и восстановление) ограничивает число растворенных веществ, способных окисляться и восстанавливаться. Таким об разом, электроактивными (деполяризаторами) являются те растворенные вещества, потенциалы начала разложения которых находятся в рабочей области, ограниченной началом разложения данного растворителя.Косвеннаякулонометрия. или кулонометрическое титрование, заключается в том, что определяемые компоненты X или У, не способные подвергаться электрохимической реакции на электродах, вступают в химическое взаимодействие со вспомогательными реагентами Rили Ri, легко окисляющимися или восстанавливающимися на электродах. В косвенной кулонометрии применяют титрование по методу осаждения, комплексообразования, окисления — восстановления, нейтрализации. Для нахождения момента завершения химической реакции используют визуальный, спектрофотометрический, радиометрический, потенциометрический и биамперометрический методы. Титрант в кулонометрическом титровании обычно получают в электролитической ячейке в результате электрохимической реакции, протекающей на рабочем электроде (внутренняя генерация титранта). Если это по той или иной причине невозможно, электрогенерациютитранта проводят в специальном устройстве, находящемся вне ячейки (внешняя генерация титранта). Конечную точку кулонометрического титрования обнаруживают так же, как и в других титриметрических методах анализа: визуально с помощью индикатора или инструментальными методами (потенциометрически, амперометрически, фотометрически и др.).Для определения конца кулонометрического титрования пригодны практически все способы установления конечной точки в титриметрии. Используют и визуальные индикаторы (крахмал — при титровании йодом или фенолфталеин — при кислотно-основном титровании) и различные инструментальные методы (рН-метрия, амперометрия, спектрофотомет-рия).При 100 %-ной эффективности точки генерации и при большой константе равновесия проводимой химической реакции точность кулонометрического титрования будет зависеть от точности измерения количества электричества, а также от способа обнаружения конечной точки титрования. В принципе все методы, применяемые для определения момента завершения химической реакции в титриметрии, могут быть использованы в кулонометрическом титровании. Наиболее широкое развитие получили потенциометрия и амперометрия в различных вариантах, а также спектрофотометрия. Электрохимические методы индикации конца т.т. основаны на измерении либо потенциала , либо тока , протекающего через индикаторный электрод. В кулонометрическом титровании широко используют ампе-рометрическую индикацию к. т. т. В амперометрии с одним индикаторным электродом на него налагают потенциал, соответствующий потенциалу предельного тока электроактивного вещества, и ведут титрование, фиксируя зависимость предельного тока от времени генерации титранта. При амперометрической индикации к. т. т. используют либо один индикаторный электрод в паре с электродом сравнения, либо пару индикаторных электродов без электрода сравнения. В амперометрической индикации к. т. т. с двумя индикаторными электродами анодные и катодные токи, снимаемые с них, равны. В процессе титрования потенциал каждого из этих электродов будет меняться, способствуя поддержанию равенства токов. В основе спектрофотометрического метода индикации к.т. т. в кулонометрическом титровании с контролируемым током лежит определенная зависимость оптической плотности раствора от концентрации либо определяемого вещества, либо титранта, либо продуктов реакции. Для определения к.т.т. строят график зависимости оптической плотности от продолжительности генерации титранта. Кондуктометрический метод индикации к.т. т. основан на измерении изменения электропроводности раствора в процессе генерации титранта, химически реагирующего с определяемым раствором. Однако этот метод, несмотря на высокую чувствительность, не может быть широко использован из-за высокой концентрации электролитов . Завершая краткое рассмотрение методов индикации к. т. т., необходимо отметить, что их выбор должен быть основан на таких критериях, как допустимая погрешность анализа, экс-прессность, степень завершенности химической реакции, диапазон определяемых концентраций и др.
48. Амперометрическое титрование, сущность метода. Выбор потенциала индикаторного электрода. Виды кривых титрования.
АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ— электрометрический метод титрования, основанный на измерении величины тока в зависимости от объема добавленного титрующего раствора (титранта). При этом точку эквивалентности определяют графически при помощи кривой ампер. титр., к-рая обычно состоит из двух прямых, пересекающихся в точке эквивалентности. Одна прямая соответствует изменению концентрации определяемого вещества в растворе, другая — концентрации титранта в растворе.В процессе титровавния после добавления отдельных порций реактива отмечают силу тока при напряжении соответствующей величине предельного тока и строят кривую в координатах I=f(V(T)),вид кривой зависит от активности и титранта.
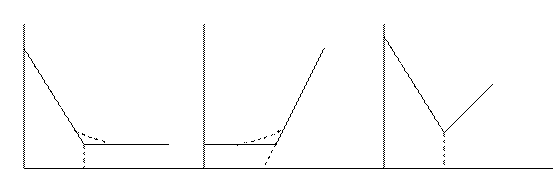 Первая кривая соответствует графику определения электрохимически активного вещества,неэлектрохимически активного титранта.Вторая кривая-определенное вещество электрохим-кинеактивно,атитрант-активен.Третья кривая-определ.вещество и титрантэлектрохим.активны.Выбор потенциала индикаторного электрода .Титрование следует проводить при таком потенциале индикаторного электрода, который соответствовал бы области диффузион-ного тока иона, дающего электродную реакцию . Это значит, что разработка методов амперометрического титрования должна начинаться со снятия соответствующего иона. Полярограмму снимают на том электроде, на котором предполагается в дальнейшем проводить титрование, и в той же среде. Правильность выбора потенциала можно легко проверить следующим образом: в стакан для титрования помещают раствор, который должен служить фоном при предполагаемом титровании; в бюретку помещают раствор, содержащий тот ион, который должен давать электродную реакцию. На индикаторном электроде устанавливают выбранный потенциал. При титровании фона этим раствором никакой химической реакции в растворе не происходит, но концентрация электровосстанавливающегося иона постепенно возрастает и пропорционально ей возрастает диффузный ток.Если потенциал выбран правильно, то прямолинейный ход кривой титрования сохранится в широких пределах концентраций. Если же потенциал не соответствует области диффузионного тока, то на кривой титрования более или менее быстро появится «загиб».
Первая кривая соответствует графику определения электрохимически активного вещества,неэлектрохимически активного титранта.Вторая кривая-определенное вещество электрохим-кинеактивно,атитрант-активен.Третья кривая-определ.вещество и титрантэлектрохим.активны.Выбор потенциала индикаторного электрода .Титрование следует проводить при таком потенциале индикаторного электрода, который соответствовал бы области диффузион-ного тока иона, дающего электродную реакцию . Это значит, что разработка методов амперометрического титрования должна начинаться со снятия соответствующего иона. Полярограмму снимают на том электроде, на котором предполагается в дальнейшем проводить титрование, и в той же среде. Правильность выбора потенциала можно легко проверить следующим образом: в стакан для титрования помещают раствор, который должен служить фоном при предполагаемом титровании; в бюретку помещают раствор, содержащий тот ион, который должен давать электродную реакцию. На индикаторном электроде устанавливают выбранный потенциал. При титровании фона этим раствором никакой химической реакции в растворе не происходит, но концентрация электровосстанавливающегося иона постепенно возрастает и пропорционально ей возрастает диффузный ток.Если потенциал выбран правильно, то прямолинейный ход кривой титрования сохранится в широких пределах концентраций. Если же потенциал не соответствует области диффузионного тока, то на кривой титрования более или менее быстро появится «загиб».
49Растворы электролитов. Классификация электролитов по Бренстеду и Лоури. Константы кислотности и основности. Расчет рН в растворах слабых электролитов.
Электролит – это вещество, которое при определенных условиях способно распадаться на заряженные частицы, называемые ионами.Раствор электролита – это раствор, который способен проводить электрический ток.
Растворы электролитов, содержат в заметных концентрациях ионы-катионы и анионы.образующиеся в результате электролитической диссоциации молекул растворенного вещества. Р-ритель (чистый или смешанный) обычно в сколько-нибудь значит.степени не диссоциирован. Растворы элект. обладают способностью проводить электрич. ток и относятся к проводникам второго рода. Благодаря увеличению общего числа частиц коллигативные свойства бесконечно разбавленных растворы электролитов существенно отличаются от тех же свойств растворов неэлектролитов. Этим, в частности, объясняется увеличение осмотич. давления в сравнении со значением, предсказываемым законом Вант-Гоффа (см. Осмос), понижение давления пара растворителя над раствором в сравнении с предсказываемым Рауля законом и др. Наличием ионов обусловлены также классификация растворы электролитов, особенности теоретич. подходов в сравнении с др. классами растворов. Первой обобщенной теорией кислот и оснований явилась протолитическая теория, созданная в 1923 г. одновременно и независимо друг от друга Бренстедом, Лоури.. Протолитическими называют реакции, протекающие с участием катионов водорода Н+, то есть протонов. Согласно Бренстеду, любая протолитическая реакция является кислотно-основным равновесием. Кислота есть донор протонов, а основание - акцептор протонов. Кислота и основание, связанные между собой протолитическим равновесием, называются сопряженными. Кислоту и её характеристики в протолитической теории принято обозначать буквой А (acidum), а основание - B (base). Количественной характеристикой протолитического равновесия является константа кислотности. Чем больше константа кислотности, тем сильнее кислота. Силу основания характеризуют также константой кислотности данного протолитического равновесия. Чем ниже константа кислотности, тем сильнее сопряженное основание. Иногда для характеристики оснований используют константу основности.На практике в качестве стандартного основания для определения силы кислот используют молекулы растворителя, а приводимые в спра- вочниках характеристики кислот относятся к водным растворам: НА + Н2 О →←Н3 О + + А – . Сильные протолиты нацело подвергаются протолизу: HCl + Н2 О → Н3 О + + Cl – . Слабые протолиты лишь в малой степени подвержены протолизу. Так, в водном растворе фтороводородной кислоты устанавливается равновесие: НF + Н2 О→←Н3 О + + F.
Состояние равновесия этой протолитической реакции является мерой способности молекул HF к передаче протонов молекулам растворителя и характеризует относительную кислотность HF в воде. Константу равновесия реакции НА + Н2 О→←Н3 О + + А – выразим через активности: K = (aн3о * aА-)/aHA * ан2о .Очевидно, что в случае разбавленных водных растворов активность воды можно принять за единицу1 , а активности других участников реакции приравнять к их концентрациям2 . Получаемую при этом константу равновесия называют константой кислотности кислоты НА и обозначают Ка : K=[h3o]*[A-]/[HA] . (1.1) Аналогично, константу протолитического равновесия между основанием и растворителем B + H2 O →← BH + + OH – называют константой основности и обозначают Кb : K=[BH+]*[OH-]/[B].На практике из соображений удобства вместо величин Ка и Кb очень часто пользуются логарифмическими показателями констант, а именно: рКа = – lgKa , pKb = – lgKb . Чем сильнее данная кислота, тем больше ее константа кислотности Ка и меньше величина рКа
.Растворыслабыхкислот:рН= 1/2рКа – 1/2lgСа,,гдеСа –концентрация кислоты
рКа =-lgKa ,гдерКа -показатель константы ионизации кислоты.
Растворыслабыхоснований
рН=14– ½рКb + ½lgСb,гдеСb –концентрация основания
рКв = - lgKb, где pKb - показатель константы ионизации основания
