Строение и обмен хромопротеинов
Хромопротеины (ХП) - это сложные белки, простетическая группа которых придает им окраску.
У человека и высших животных большая часть ХП представлена гемопротеинами, простетическая группа, которых имеет геминовую структуру. Имеется и второй вид ХП - флавопротеины, в составе которых простетическая группа - ФАД или ФМН.
ГЕМОПРОТЕИНЫ делят на две группы:
1. Белки - переносчики кислорода (гемоглобин и миоглобин)
2. Белки-ферменты (цитохромы, каталаза, пероксидаза)
Все геминовые белки содержат в качестве небелковой группы структурно похожие порфирины. Но различаются по структурной организации белковой части молекулы, что обеспечивает разнообразие их функций.
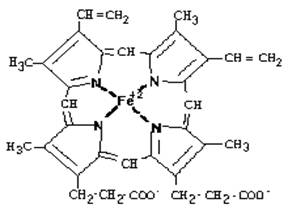 |
Гемоглобин (Hb) имеет молекулярную массу 80000 Да. Это сложный белок с четвертичной структурой: состоит из нескольких субъединиц. У Hb 4 субъединицы. Каждая субъединица состоит из небелковой части - гема и белка глобина (всего 4 гема и 4 глобина в молекуле гемоглобина).
Гем имеет тетрапиррольную структуру, т.е. состоит из 4-х замещенных пиррольных колец, соединенных между собой с помощью метиновых мостиков. Эта структура называется порфирином (без железа). Протопорфирин, в который включено железо, называется ГЕМ.
Железо в Hb имеет степень окисления “+2” и координационное число 6. Двумя ковалентными связями Fe связано с азотами пиррольных колец. Две координационные связи идут на связь с остатками гистидина в молекулах глобина. Белковая часть Hb состоит из 4-х попарно одинаковых протопорфириновых циклов.
Молекула HbA (Hb взрослого человека) содержит- 2 альфа- и 2 бета-полипептидные цепи. Этот тип гемоглобина составляет приблизительно 95-97% от всего количества гемоглобина в крови.
HbA2 (2 альфа- и 2 дельта-цепи) у взрослого примерно 2%.
HbF (2 альфа и 2 гамма-цепи) - примерно 2% у взрослого. HbF - фетальный гемоглобин. В крови новорожденного такого гемоглобина содержится примерно 80%. В отличие от HbA этот тип гемоглобина имеет гораздо большее сродство к кислороду.
Сейчас установлено 5 видов HbA. Все они имеют 2 альфа- и 2 бета-цепи, но в минорных формах HbA присоединяются остатки простых сахаров (глюкозы) - гликозилированные формы гемоглобина.
У больных сахарным диабетом гликозилированных форм гемоглобина больше, чем у здоровых людей. Если снизить уровень сахара крови, то количество гликозилированнных форм снижается.
В крови человека иногда встречаются аномальные формы гемоглобина, которые отличаются от нормального Hb по аминокислотному составу полипептидных цепей. При этом изменяются изоэлектрическая точка, заряд, форма белковой молекулы. Заболевания, которые связаны с изменением структуры полипептидных цепей называются гемоглобинопатиями.
Серповидноклеточная анемия - характеризуется появлением HbS. В бета-цепи глутаминовая кислота заменена на валин вследствие мутации. Это приводит к изменению свойств Hb. Возрастает гидрофобность молекулы. Молекулы агрегируют. Эритроцит под микроскопом выглядит как серп.
В ряде случаев наблюдается одно из нарушений синтеза нормальных цепей Hb. Если нарушается синтез бета-цепей - то заболевание называется: бета-талассемия. Если нарушен синтез альфа-цепи, то альфа-талассемия.
РОЛЬ ГЕМОГЛОБИНА В ОРГАНИЗМЕ ЧЕЛОВЕКА.
Функция - перенос кислорода. В легких происходит связывание с О2 - из дезоксигемоглобина (Hb)образуется оксигемоглобин (Hb*O2):
Hb + O2 ----> HbO 2
Присоединение кислорода идет за счет образования координационных связей. Присоединение кислорода не меняет валентности железа.
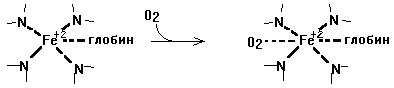 |
Кривая диссоциации оксигемоглобина отражает зависимость между степенью насыщения HbO2 и парциальным давлением О2:
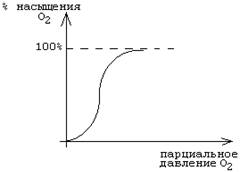 |
Такой характер кривой означает, что присоединение первой молекулы кислорода к молекуле Hb происходит медленно (низкое сродство к кислороду). Затем происходят конформационные изменения в молекуле и присоединение следующих молекул О2 облегчается - сродство становится выше. В данном случае наблюдается положительное кооперационное взаимодействие между отдельными субъединицами Hb.
Hb способен без изменения степени окисления Fe присоединять и СО2. Это соединение называют карбгемоглобином (Hb*CO2). Такая форма не является стойкой и поэтому гемоглобин очень легко отдает СО2. В таком виде из тканей к легким переносится всего от 3 до 10% СО2.
Возможно образование соединения с оксидом углерода (II) - угарным газом (СО). Такое соединение называют карбоксигемоглобин (Hb*CO). Присоединение также происходит за счет координационных связей, но СО обладает высоким сродством к Hb, и, поэтому Hb теряет способность переносить кислород. Вытеснить СО из комплекса с Hb можно только при повышении концентрации кислорода в крови. Например, путем вдыхания чистого кислорода или усиленной вентиляцией легких воздухом.
При отравлении парами нитробензола, окислами азота, а также при поступлении в организм других окислителей может произойти окисление Hb в метгемоглобин (Hb*OH). При этом Fe+2 переходит в Fe+3,а Hb - в Hb*OH (MetHb). Эта форма Hb неспособна переносить кислород и реакция перехода в метгемоглобин необратима.
Миоглобин - белок мышечной ткани. По строению похож на одну субъединицу Hb, т.е. состоит из одного гема и одного глобина. Эта полипептидная цепь (глобин) похожа на полипептидную цепь Hb. Молекулярная масса миоглобина - примерно 17 000 Да).
Миоглобин имеет очень высокое сродство к кислороду, гораздо больше, чем Hb. Это позволяет миоглобину гораздо более эффективно связывать и запасать кислород для обеспечения им митохондрий в работающей мышце.
ОБМЕН ГЕМОГЛОБИНА
Hb содержится в эритроцитах, составляя 95% от их сухой массы. Эритроциты живут 100-120 дней. Ежедневно образуется 250 млрд эритроцитов. Синтез гемоглобина происходит в кроветворных органах, причем гем и глобин синтезируются по отдельности. Затем соединяются, и образуется третичная и четвертичная структура гемоглобина.
СИНТЕЗ ГЕМА
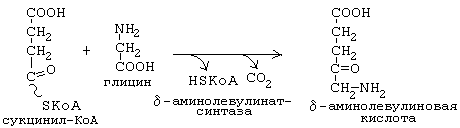
дельта-аминолевулинатсинтаза является ключевым ферментом биосинтеза гема. Коферментом дельта-аминолевулинатсинтазы является пиридоксаль-фосфат (производное витамина В6). Фермент ингибируется по принципу отрицательной обратной связи избытком гема.
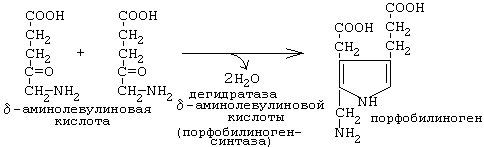
Порфобилиногенсинтаза тоже угнетается избытком гема.
Необходимо знать схему дальнейших реакций, протекающих при синтезе гема:
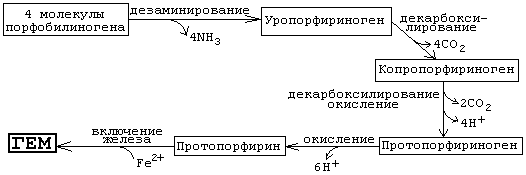
Источник железа - белок ферритин. В комплексе с ферритином в организме хранится (депонируется) резерв железа. Известны генетические дефекты ферментов, участвующих в синтезе гема. При этом происходит накопление в организме предшественников протопорфирина.
Эти болезни называются "порфирии". Есть порфирии, при которых накапливается уропорфириноген. Моча у таких больных имеет красный цвет, а зубы при ультрафиолетовом облучении сильно флуоресцируют, кожа - имеет повышенную чувствительность к солнечному свету. При некоторых порфириях происходит накопление порфобилиногена, что сопровождается нервно-психическими расстройствами.
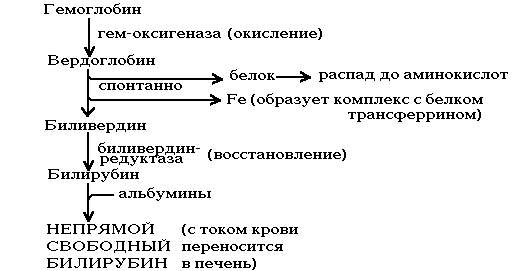 |
РАСПАД ГЕМОГЛОБИНА
Происходит в мононуклеарных фагоцитах (в селезенке и печени). Сначала происходит разрыв связи между I-м и II-м кольцами. Фермент - НАДзависимая оксигеназа. После ее действия образуется пигмент зеленого цвета - вердоглобин. В его составе сохраняется и железо и белок. В дальнейшем вердоглобин распадается на составные части: белок, железо и пигмент-биливердин. Железо образует комплекс с белком трансферрином, и этот комплекс поступает в ткани, где оно снова может быть использовано для синтезов или депонироваться в виде комплекса с белком ферритином.
Билирубин плохо растворим в воде, поэтому он адсорбируется на альбумине крови. Такой комплекс называется СВОБОДНЫМ или НЕПРЯМЫМ БИЛИРУБИНОМ. Он свободный, потому что не связан ни с каким другим веществом ковалентными связями; непрямой, потому что не дает прямой реакции с диазореактивом Эрлиха (для определения этого вида билирубина необходимо предварительно осадить альбумины).
В печени непрямой билирубин подвергается обезвреживанию путем связывания с глюкуроновой кислотой. В реакции расходуется УТФ. При этом к молекуле билирубина присоединяются 2 молекулы глюкуроновой кислоты (образование билирубиндиглюкуронида). Это вещество малотоксично и хорошо растворяется в воде, называется ПРЯМЫМ СВЯЗАННЫМ БИЛИРУБИНОМ, т.к. определяется в прямой реакции с диазореактивом Эрлиха и связан ковалентно с глюкуроновой кислотой. В таком виде билирубин поступает в желчь и вместе с ней выводится из организма.
При определении содержания билирубина используют диазореактив Эрлиха, который дает розовую окраску с билирубином и по ее интенсивности судят о концентрации билирубина в крови.
В крови человека примерно 75% непрямого билирубина от его общего количества. Общее содержание билирубина в норме (прямой+непрямой) от 8 до 20 мкмоль/л.
Билирубин - это конечный продукт распада гемоглобина у человека. Однако, поступив с желчью в кишечник, он превращается под действием ферментов микрофлоры кишечника. Сначала от него отщепляется глюкуроновая кислота, затем происходит частичное восстановление и образуется вещество, называемое "мезобилиноген", а затем стеркобилиноген. Стеркобилиноген в основном выводится с калом и на воздухе (в кале) превращается в стеркобилин, а мезобилиноген частично всасывается из кишечника по системе v.portae, т.е. попадает в печень и там разрушается. Поэтому его нет у здоровых людей в крови. Небольшая часть стеркобилиногена тоже всасывается из кишечника через систему геморроидальных вен, т.е. попадает сразу в большой круг кровообращения, минуя печень, поэтому часть его выводится с мочой.
Значит, стеркобилиноген является компонентом мочи в норме.
В НОРМЕ:
Кровь:
Билирубин (в основном непрямой) - в норме (8-17мкмоль/л)
Гемоглобин - в норме (мужчины - 130-145 г/л; женщины - 110-130 г/л
Моча:светло-желтого цвета, стеркобилиноген - в норме, мезобилиногена нет.
Кал:нормальной окраски, стеркобилиноген - в норме
При некоторых заболеваниях билирубин начинает накапливаться в слизистых оболочках, коже, склерах. Человек "желтеет". Этот симптом называется ЖЕЛТУХА и наблюдается при желчнокаменной болезни, гемолизе, инфекционном или токсическом гепатитах. Определение билирубина в моче, в крови и в кале позволяет выявить причины желтухи.
ГЕМОЛИТИЧЕСКАЯ ЖЕЛТУХА Наблюдается при усилении распада эритроцитов. Билирубина образуется больше, чем в норме и скорость экскреции тоже увеличивается. Непрямой билирубин повышается в крови. В моче билирубина нет, а содержание стеркобилина в кале и в моче повышено.
ОБТУРАЦИОННАЯ ЖЕЛТУХА (механическая) Наблюдается при закупорке желчных протоков (например, при желчнокаменной болезни). Желчь продолжает вырабатываться, но поступает не только в желчные протоки, а также в кровь. В крови повышается уровень билирубина, в основном - прямого билирубина. Наблюдается билирубинурия. Содержание стеркобилина в моче и в кале снижено (кал становится светлым, а моча темнеет за счет прямого билирубина).
ПЕЧЕНОЧНОКЛЕТОЧНАЯ ЖЕЛТУХА (паренхиматозная). Наблюдается при повреждении гепатоцитов (например, при вирусном гепатите). Билирубин не обезвреживается. Желчные пигменты поступают не только в кишечник, но и в кровь. Т.е. в крови повышается содержание не только прямого, но и непрямого билирубина. Наблюдается билирубинурия. В моче обнаруживают мезобилиноген.
