МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ (метод ВС)
Основные положения метода ВС.
1. Одинарную химическую связь образуют два электрона с противоположными спинами, принадлежащие разным атомам. Связь образуется за счет перекрывания их волновых функций и образования общей электронной пары. В результате между ядрами атомов появляется зона повышенного отрицательного заряда, так как в этой области время пребывания электронов больше, чем в других точках молекулярного пространства. Образование общей электронной пары приводит к снижению полной энергии системы в целом и образованию ковалентной связи.
2. Связь является ориентированной в пространстве и располагается в том направлении, где возможность перекрывания волновых функций максимальна.
3. Из двух атомных орбиталей более прочную связь образует та, которая сильнее перекрывается с орбиталью второго атома. Чем больше перекрывание орбиталей, тем больше выделяется энергии при образовании связи, тем она прочнее.
Характеристики ковалентной связи.
1. Энергия связи Есв, кДж/моль.
2. Полярность связи.
3. Насыщаемость связи.
4. Направленность связи.
Рассмотрим их более подробно.
Энергия связи.
Устойчивость двухатомной молекулы к распаду на атомы характеризуется величиной ее энергии диссоциации, или прочностью связи. В молекуле водорода энергия связи численно равна энергии, которая выделяется при образовании молекулы Н2 из атомов Н + Н = Н2 + 432 кДж. Эту же энергию нужно затратить, чтобы разорвать связь H2 = H + H − 432 кДж.
В молекулах состава ABn последовательный отрыв атомов «В» сопровождается неравномерными затратами энергии.
Например, значения энергии (кДж/моль) последовательного отщепления атомов водорода от молекулы метана существенно различаются:
| кДж/моль | ||||||||
| СН4 | → | СН3 | → | СН2 | → | СН | → | С |
При этом энергия связи С-Н определяется как средняя величина затраченной энергии на всех стадиях: СН4=С+4Н; ∑=1660кДж/моль;
Е(С−Н) = 1660 / 4 = 415 кДж/моль.
Энергия связи конкретной пары атомов, например С-Н, зависит от того, в какую молекулу эта пара входит. Однако изменения этой энергии в разных молекулах невелики. Это подтверждает предположение о том, что связывающие атомы электронные пары локализованы между атомами.
Если сравнивать между собой энергии связи С-Н во многих молекулах, то среднее значение окажется равным 413 кДж/моль, что не слишком отличается от вычисленной для связи С-Н в молекуле СН4 (415 кДж/моль).
Чем выше энергия химической связи, тем прочнее связь. Связь считается прочной, или сильной, если ее энергия превышает 500 кДж/моль (например, 942 кДж/моль для N2), слабой – если ее энергия меньше 100 кДж/моль (например, 69 кДж/моль для NO2). Если при взаимодействии атомов выделяется энергия менее 15 кДж/моль, то считают, что химическая связь не образуется, а наблюдается межмолекулярное взаимодействие (например, 2 кДж/моль для Xe2). Прочность связи обычно уменьшается с увеличением ее длины (табл.4.1).
Таблица 4.1
Значения длины и энергии связи у галогеноводородных кислот
| Соединение | HF | HCl | HBr | HI |
| Длина связи, нм | 0,092 | 0,128 | 0,141 | 0,160 |
| Энергия связи, кДж/моль |
Одинарная связь всегда слабее, чем кратные связи – двойная и тройная между теми же атомами.
Полярность связи
Если ковалентная связь образована двумя атомами одного и того же элемента, то общая электронная плотность располагается абсолютно симметрично в поле обоих ядер. Если же общая пара связывает атомы двух различных элементов, то электронная плотность является не симметричной. Она смещена к атому более электроотрицательного элемента. В результате на этом атоме наводится избыточный (частичный) отрицательный заряд, а на противоположном – частичный положительный. В результате в молекуле образуются два разноименно заряженных полюса. Чем больше разница в электроотрицательностях атомов, тем более полярной является связь.
Полярные молекулы, имеющие разделенные в пространстве положительный и отрицательный полюса, называются ДИПОЛЯМИ. Расстояние между полюсами в диполе называют его длинной (L).
Произведение заряда одного из полюсов на длину диполя называют дипольным моментом (Кл∙м).
μ = Z∙L. (4.1)
Дипольный момент является векторной величиной. В химии направление дипольного момента принято от положительного полюса к отрицательному. Например, в молекуле хлористого водорода на атоме водорода сосредотачивается избыточный (+), а на атоме хлора избыточный (-) Hδ+→ Clδ-. Для многоатомных молекул дипольный момент можно рассчитать как векторную сумму дипольных моментов отдельных связей, пренебрегая их взаимным влиянием. Моменты отдельных связей могут либо усиливать, либо компенсировать друг друга, изменяя суммарный момент.
Например, линейные молекулы BeCl2 и CO2 являются неполярными. Хотя каждая из связей полярна. К таким молекулам можно отнести молекулы метана СН4 и гексафторида серы SF6, в которых дипольные моменты отдельных связей
компенсируют друг друга и суммарный дипольный момент молекулы равен нулю.
В предельном случае общая электронная пара полностью локализуется у одного из атомов. В результате образуются два разноименно заряженных иона. Атом, потерявший электрон, превращается в катион (А+), а атом, захвативший чужой электрон, - в анион (А-). В результате взаимного притяжения двух противоположно заряженных частиц возникает ионная связь.
Ионная связь формируется за счет электростатического притяжения между частицами с зарядами противоположного знака, которые образуются за счет переноса одного или нескольких электронов от одного атома к другому. По теории Косселя (1916 г.) атом всякого элемента, вступая в соединение, теряя или присоединяя соответствующее число электронов, стремится приобрести электронную оболочку атома ближайшего (в Периодической системе) благородного газа ns2 или ns2np6. В результате присоединения или потери электронов образуется анион или катион соответственно.
Так, например, для ионного кристалла NaCl образование ионов Na+и Cl - из нейтральных атомов показывает, что атом натрия теряет электрон, а атом хлора его присоединяет. В результате этого образуются Na+ (2s22p6 – оболочка Ne) и Cl- (3s23p6 – оболочка Ar). Эти ионы формируют внутри кристалла правильную трехмерную структуру.
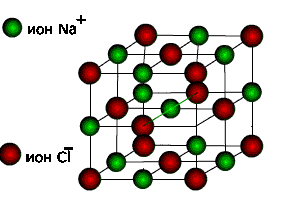 Ионы в кристалле находятся в равновесных положениях, поэтому силы кулоновского притяжения между ними должны компенсироваться силами отталкивания их электронных оболочек.
Ионы в кристалле находятся в равновесных положениях, поэтому силы кулоновского притяжения между ними должны компенсироваться силами отталкивания их электронных оболочек.
Известно, что идеальной ионной связи не существует. Даже в тех соединениях, которые обычно относят к ионным, не наблюдается полного перехода электронов от одного атома к другому. Электроны всегда частично остаются в общем пользовании.
Так, например, связь во фториде лития на 80% ионная, а на 20% – ковалентная. По этой причине правильнее говорить о степени ионности химической связи.
Доминирующая ионная связь появляется только в том случае, если взаимодействующие атомы (например, натрий и хлор) сильно отличаются энергиями ионизации и сродства к электрону (металл-неметалл).
Взаимодействие между катионами и анионами в ионном кристалле не зависит от направления, поэтому об ионной связи говорят, как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. По этой причине ионная связь является ненаправленной и ненасыщенной, а число взаимодействий между ионами в твердом состоянии ограничивается лишь
размерами кристалла. Поэтому «молекулой» ионного соединения следует считать весь кристалл.
По этой причине ионные кристаллы очень твердые и хрупкие и имеют высокие значения энергии кристаллической решетки.
Если попытаться деформировать ионную решетку, то один из слоев будет сдвигаться относительно другого до тех пор, пока одноименно заряженные ионы не окажутся слишком близко друг от друга. Это приводит к резкому возрастанию сил отталкивания, и решетка быстро разрушается.
Насыщаемость связи
Ковалентная связь – наиболее общий вид химической связи, возникающей в соединениях различного типа. Принято выделять два возможных механизма ее образования: обменный механизм, когда каждый из взаимодействующих атомов поставляет по одному электрону, и донорно-акцепторный, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору), имеющему свободную электронную орбиталь.
1. Обменный механизм А∙+ ∙В = А: В
2. Донорно-акцепторный механизм А + :В = А : В
Молекула водорода служит простейшим возможным примером образования ковалентной связи по обменному механизму.
В рамках представлений Льюиса об обменном механизме валентность элемента определяется числом общих электронных пар, образуемых атомом в молекуле.
В некоторых случаях оба электрона при образовании ковалентной связи поставляются только одним из атомов. Это называется донорной валентностью. Если такая связь образована, она становится неотличимой от любой другой ковалентной связи. Донорно-акцепторная связь реализуется во многих молекулах и ионах.
При образовании иона аммония NH4+ и молекулы BF3NH3 атом азота в молекуле аммиака NH3 имеет несвязывающую 2S2 электронную пару. Ион водорода Н+ - свободную 1S орбиталь, а атом бора в молекуле BF3 - свободную 2р орбиталь.
H +
Н+ + :NH3 → H : N H F3B + :NH3 → BF3:NH3
H
В ионе NH4+ акцептором служит ион Н+ , а в молекуле BF3NH3 – атом бора (В). Атом азота, входящего в состав молекулы аммиака, в обоих случаях выступает в качестве донора.
Донорно-акцепторное взаимодействие между разными молекулами может сопровождаться образованием комплексных соединений:
А1С13 +:NH3 = [А1(NH3)]С13
Атом азота в NH3 имеет неподеленную пару электронов и играет роль донора, а атом А1 в молекуле А1С13 – свободную орбиталь и играет роль акцептора.
Все это говорит о том, что валентность атомов зависит не только от количества неспаренных электронов, но и от наличия вакантных орбиталей и количества неподеленных электронных пар соответственно.
В ионе NH4+ все связи центрального атома азота N-Н, несмотря на их различное происхождение, равноценны и не различимы, что наглядно доказывает одинаковую природу ковалентных и донорно-акцепторных связей.
Связи, образуемые по донорно-акцепторному механизму, обычно образуются уже после того, как атом - донор использовал имеющиеся у него неспаренные электроны для образования связей по обменному механизму. Это объясняется тем, что при образовании общих электронных пар с участием электронов другого атома происходит насыщение валентного уровня атома донора, при этом его электроотрицательность снижается и он легче отдает свои несвязываюшие пары для образования связей по донорно-акцепторному механизму.
Свободные орбитали акцепторов характеризуются очень низким значением энергии. Этим объясняется их склонность к заполнению электронами по донорно-акцепторному механизму. Донорно-акцептрное взаимодействие лежит в основе таких процессов, как полимеризация некоторых молекул при переходе из газообразного в жидкое состояние, образование комплексных соединений, гидролиз анионов.
Направленность связи
Образование ковалентной связи является результатом перекрывания валентных электронных облаков (атомных орбиталей АО), которые характеризуются определенными ориентациями в пространстве, и поэтому ковалентная связь имеет строго определенную направленность.
Направление ковалентных связей характеризуется валентными углами – углами между линиями, соединяющими центры связываемых атомов. Сама по себе графическая формула молекулы или иона не несет информации о валентных углах. Например, в ионе [SO4 ]2− валентные углы между связями S-O равны 109,5o, а в ионе [PdCl4]2− Pd-Cl − 90o; молекула ВF3 – плоская треугольная, NF3 – пирамидальная, а С1F3 имеет Т-образную форму, хотя все три последние молекулы имеют состав АF3.
Совокупность длин связей и валентных углов в молекуле определяет ее пространственное равновесное строение, в котором имеет место равенство сил
притяжения и отталкивания и которое обеспечивает оптимальное пространственное строение и минимальное значение энергии молекулы.
Перекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. Между двумя атомами в химической частице возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси.
Фрагменты химических частиц могут вращаться вокруг межъядерной оси без нарушения степени перекрывания атомных орбиталей, образующих σ-связи.
Совокупность направленных, строго ориентированных в пространстве σ - связей создает пространственную структуру частиц.
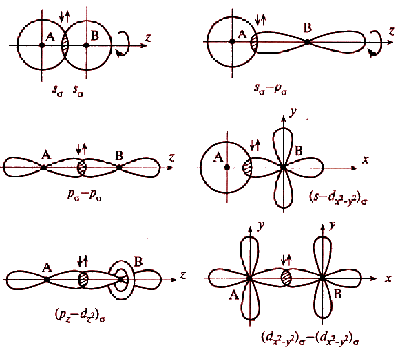
Рис. 4.2. Схемы образования σ-связей с участием электронов различных типов
При дополнительном перекрывании атомных орбиталей, перпендикулярных линии связывающей ядра взаимодействующих атомов, образуются π-связи, в которых могут принимать участие р- р, р - d и d-d-орбитали (рис.4.3).
С появлением π-связи, не имеющей осевой симметрии, свободное вращение фрагментов химической частицы вокруг σ-связи становится невозможным, так как оно должно привести к разрыву π-связи.
Число связей, образующихся между атомами, называется кратностью, или порядком связи, и определяется числом общих электронных пар.
Установлено, что среднее расстояние между связанными атомами (длина связи) уменьшается с возрастанием числа обобществленных электронных пар.
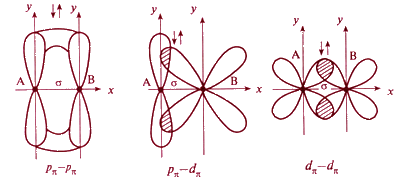
Рис. 4.3. Схемы образования π-связей с участием электронов различных типов
Это связано с тем, что электронная плотность между двумя положительно заряженными ядрами возрастает, вследствие чего увеличивается и притяжение между ядрами, а следовательно, возрастает и энергия связи (табл. 4.2).
Таблица 4.2.
