Поляризация и перенапряжение
При наложении электрического тока от внешнего источника потенциалы электродов смещаются: катода - в отрицательную, анода - в положительную стороны. Электроны по внешней цепи перетекают быстрее, чем происходят электродные реакции.В результате на катоде электроны накапливаются, а на аноде накапливаются положительные заряды. Изменение потенциала от равновесного при протекании внешнего тока называется электрохимической поляризацией электродов:
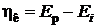 (катодная поляризация), (катодная поляризация), | (9.10) | |
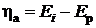 (анодная поляризация). (анодная поляризация). | (9.11) |
Электродная поляризация – функция плотности тока, чем выше плотность – тем больше поляризация.
Электродный процесс под током – гетерогенная реакция, состоящая из стадий:
1. Транспорт реагирующих веществ из объема раствора к поверхности электрода и обратный транспорт продуктов.
2. Электрохимическая реакция – переход электронов и ионов через границу раздела раствор – металл (разряд, ионизация).
3. Фазовые превращения. Образование или разрушение кристаллической решетки, формирование и выделение газов.
4. Химические реакции, предшествующие или последующие электрохимической стадии.
Первая и вторая стадии присущи всем электродным процессам, остальные – отдельным процессам.
Скорость электродного процесса определяется скоростью наиболее медленной стадии, которая называется лимитирующей. Если природа лимитирующей стадии известна, то вместо «поляризация» употребляют термин «перенапряжение»: перенапряжение диффузии (hд), перенапряжение электронного перехода или электрохимическое перенапряжение (hэ), перенапряжение фазового перехода (hф), перенапряжение реакции (hр).
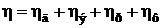 . . | (9.12) |
Хотя в каждом конкретном случае определяющим может быть один вид перенапряжения.
Перенапряжение выделения водорода. При электролизе водных электролитов часто выделяется водород.
а) в кислой среде: 2Н+ +2ē → Н2;
б) в нейтральной и щелочной: 2Н2О +2ē → Н2 + 2ОН–.
Выделение водорода сопровождается значительным перенапряжением, зависящим от природы электрода. На металлах перенапряжение водорода убывает в последовательности: Hg – Pb – Zn – Al – Sn – Cu.
Для осуществления электролиза к электролизеру необходимо приложить рабочее напряжение:
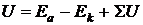 , , | (9.13) |
где Еа и Ек – потенциалы анода и катода при рабочей плотности тока; SU – падение напряжения на преодоление омического сопротивления цепи (контактов, раствора, электродов); 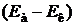 – напряжение разложения электролита, которое в свою очередь равно сумме обратимого напряжения разложения и перенапряжения на электродах:
– напряжение разложения электролита, которое в свою очередь равно сумме обратимого напряжения разложения и перенапряжения на электродах:
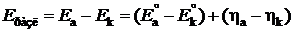 , , | (9.14) |
где 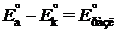 – обратимое напряжение разложения электролита, численно равное ЭДС реакции, которое можно рассчитать по термодинамическим данным:
– обратимое напряжение разложения электролита, численно равное ЭДС реакции, которое можно рассчитать по термодинамическим данным: 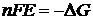 ;
; 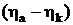 – перенапряжение на электродах.
– перенапряжение на электродах.
Применение электролиза
Электролиз находит широкое применение в технике для решения важных задач.
1. Получение металлов. Активные металлы получают электролизом расплавов их природных соединений. К ним относят щелочные, щелочно-земельные металлы, а также алюминий, магний и др. Менее активные, такие как цинк, никель, кобальт, свинец и др. – электролизом растворов их солей. Электролиз применяют для очистки (рафинирования) металлов, например получение электролитической меди.
2. Электрохимическая очистка поверхностей металлов от загрязнений – электрохимическое травление.
3. Электрополировка металлов. Заменяет трудоемкую операцию доводки металлических поверхностей, что особенно важно при сложных конфигурациях деталей.
4. Анодное оксидирование поверхностей изделий для защиты металлов от коррозии и декоративных целей, например: оксидирование стали, алюминия, медных сплавов.
5. Гальванические покрытия (гальваностегия) одного металла другим с целью защиты от коррозии, упрочнения поверхности (твердое хромирование), а также получения декоративного покрытия (никелирование, хромирование).
6. Получение точных металлических копий (гальванопластика) с рельефных предметов путем осаждения металла (обычно меди). Этот метод используется для изготовления матрицы в производстве тисненой кожи и бумаги, печатных радиотехнических схем, типографских клише и др.
7. Получение химических веществ, например растворов щелочей NaOH и KОН соответственно из растворов NaCl и KCl, фтора, хлора, водорода, перекиси водорода и др.
Контрольные вопросы
1. Опишите механизм возникновения электродного потенциала на границе раздела металл – раствор электролита.
2. Опишите катодный и анодный процессы в гальваническом элементе Даниэля-Якоби. Дайте определение электродвижущей силе (ЭДС) гальванического элемента.
3. Опишите стандартный водородный электрод и хлорсеребряный электрод.
4. Дайте определение стандартным электродным потенциалам металлов. Охарактеризуйте электрохимический ряд напряжений металлов.
5. Охарактеризуйте факторы, влияющие на величину электродного потенциала. Приведите уравнение Нернста для расчета электродного потенциала.
6. Дайте определение окислительно-восстановительным (редокси) электродам. Приведите уравнение Нернста для расчета потенциала редокси-электрода. Что характеризует величина редокси-потенциала?
7. Охарактеризуйте электролиз как электрохимический процесс. Опишите катодный и анодный процессы при электролизе как гетерогенные реакции.
8. Дайте формулировку законов Фарадея.
9. Охарактеризуйте электролиз расплавов солей как метод получения активных металлов.
10. Охарактеризуйте электролиз растворов солей на инертных и активных электродах.
11.Что такое перенапряжение водорода? Опишите последовательность разряда катионов и анионов на инертных электродах.
12. Охарактеризуйте коррозию металлов, как результат термодинамической неустойчивости металлов в окружающей среде.
13. Дайте определение химической и электрохимической коррозии.
14. Охарактеризуйте процесс электрохимической коррозии металла как результат работы микрогальванопар. Покажите влияние рН среды на этот процесс.
15. Опишите явление пассивации металла.
16. Охарактеризуйте различные методы защиты металлов от коррозии.
Примеры выполнения заданий
Пример 1. Какая из приведенных реакций возможна?
Sn + ZnCl2 ®? Fe + AgCl ®? Al + Pb(NO3)2 ®? Li + CaCl2 ®?
Решение.
В задании предложены реакции между металлами и солями. В соответствии с правилом металлы, начиная с магния, вытесняют правее стоящие в ряду напряжений металлы (т.е. имеющие более положительный потенциал) (приложение 8) из растворов их солей.
1) Олово в ряду напряжений расположен правее цинка, т.е. имеет более положительный потенциал, и, следовательно, не может вытеснить цинк из раствора его соли.
2) Железо расположено левее серебра, но данная реакция невозможна, т.к. хлорид серебра нерастворимая соль.
3) Реакция между алюминием и нитратом свинца возможна, т.к. алюминий активнее свинца, а соль свинца растворима и может находиться в растворе:
2Al + 3Pb(NO3)2 = 2Al(NO3)3 + 3Pb
| Al0 – 3ē ® Al3+ | окисление | |
| Pb2+ +2ē ® Pb0 | восстановление |
4) Литий стоит в ряду напряжений до кальция, но и до магния, а следовательно будет вытеснять водород из воды, а не металл из соли.
Пример 2. В соединении, с каким из полуэлементов: Mn/Mn2+, Pb/Pb2+, электрод Zn/Zn2+ будет анодом? Напишите уравнения соответствующих полуреакций.
Решение.
Анодом в электрохимии принято называть электрод, на котором идет процесс окисления. Анодом будет электрод, у которого более отрицательный электродный потенциал, а катодом – электрод с более положительным потенциалом (таблица приложения 8). Таковым в данном случае является свинец (см. ряд напряжений металлов).
Zn0 –2ē ® Zn2+ – анод
Pb2+ +2ē ® Pb0 – катод.
Пример 3. Допишите предложенную схему реакции. Оцените вероятность протекания процесса в заданном направлении при стандартных условиях. Ответ подтвердите расчетом:
Решение:
KMnO4 + H2S + H2SO4 ® MnSO4 + S + ….
| О-ль | MnO4– + 8H+ + 5ē ® Mn+2 + 4H2O | восстановление | |
| В-ль | H2S – 2ē ® S + 2H+ | окисление |
2MnO4– + 16H+ + 5H2S = 2Mn2+ + 8H2O + 5S + 10H+
2MnO4– + 6H+ + 5H2S = 2Mn2+ +5S + 8H2O
2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 5S + K2SO4 + 8H2O
ЭДС°р = Е°о-ля – Е°в-ля
Е°(MnO4–/Mn2+) = +1,52 B
E°(S/Н2S) =+0,14 B
ЭДСpо = 1,52 – 0,14 = 1,38 В
Ответ: ЭДС°p > 0, следовательно, при стандартных условиях процесс возможен.
Пример 4. Вычислите электродный потенциал алюминия в 0,01М растворе AlCl3.
| Дано: Е° = –1,662 В [Al3+] = 10–2 моль/л | Решение: Воспользуемся уравнением Нернста: 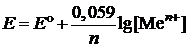 , , 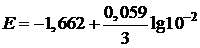 (B) (B) |
| Найти: Е(Al/Al3+) | Ответ: Е(Al/Al3+) = –1,702 В. |
Пример 5. Вычислите электродный потенциал свинцового электрода в насыщенном растворе PbSO4 (ПР = 2×10–8), содержащего 0,001 моль/л ионов SO42–.
| Дано: Е° = –0,126 В [SO42–] = 10–3 моль/л | Решение: ПР = [Pb2+][SO42–]; 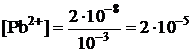 (моль/л) (моль/л) |
| ПР = 2×10–8 | 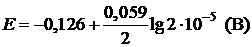 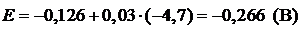 |
| Найти: Е(Pb/Pb2+) | Ответ: Е(Pb/Pb2+) = –0,266 B. |
Пример 6. Рассчитайте ЭДС элемента, составленного из медного и кадмиевого электродов в 0,01 М растворах их солей.
| Дано: Е°(Cd/Cd2+) = –0,40 B E°(Cu/Cu2+) = 0,34 B | Решение: 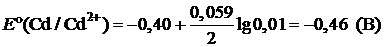 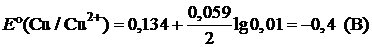 ЭДС = ЕК – ЕА ЭДС = ЕК – ЕА |
| [Cd2+] = 0,01 моль/л [Cu2+] = 0,01 моль/л | |
| Найти: ЭДС |
ЭДС = –0,4 – (–0,46) = 0,06 (В)
Ответ: ЭДС = 0,06 В.
Пример 7. Какие реакции протекают при электролизе на графитовых электродах расплава бромида калия?
Решение.
В расплаве соль диссоциирует на ионы: KВr ® K+ + Br–. Электроды из графита являются инертными, поэтому при электролизе не изменяются.
| Катод | K+ +ē = K | |
| Анод | 2Br– –2ē = Br2 | |
| Реакция электролиза | 2KBr = 2K + Br2 |
Ответ: в результате реакции образуется металлический калий и пары брома.
Пример 8. Написать уравнения реакций электролиза растворов солей NiCl2, Ba(NO3)2 на инертных электродах.
Решение.
а) Соль NiCl2 растворима, в воде диссоциирует на ионы: NiCl2 ® Ni2+ + 2Cl–. Т.к. никель имеет значение стандартного электродного потенциала меньше, чем у водорода, но больше, чем у марганца, то на катоде будут восстанавливаться ионы никеля одновременно с водой. А на аноде будут разряжаться простые анионы хлора.
| Катод | Ni2+ +2ē = Ni | |
| Анод | 2Cl– –2ē = Cl2 | |
| Реакция электролиза | NiCl2 = Ni + Cl2 |
б) Ba(NO3)2 ® Ba2+ + 2NO3–. Катионы бария не будут восстанавливаться на катоде, т.к. стандартный электродный потенциал бария меньше потенциала марганца, поэтому на катоде будут восстанавливаться молекулы воды. На аноде будет происходить окисление молекул воды, т.к. кислородсодержащие анионы азотной кислоты в водных растворах не окисляются.
| Катод | 2Н2О +2ē = Н2 + 2ОН– | |
| Анод | 2Н2О –4ē = О2 + 4Н+ | |
| Реакция электролиза | 2Н2О = 2Н2 + О2 |
Пример 9. Какие из имеющихся в растворе ионов и в какой последовательности будут разряжаться на инертных катоде и аноде: Ag+, Cl–, Br–, Co2+, NO3–, K+?
Решение.
На катоде: 1) Ag+ (как металл с наиболее положительным потенциалом); 2) Со2+ (будет восстанавливаться одновременно с молекулами воды). Катион К+из раствора не восстанавливается, т.к. имеет большое отрицательное значение потенциала (левее Mn).
На аноде: 1) Br– (неметалл с более отрицательным равновесным потенциалом), 2) Cl–, 3) кислородсодержищий анион NO3– из растворов не восстанавливается.
Пример 10. Какова масса металлической меди, выделившейся при электролизе раствора CuSO4 током 2 А в течении получаса?
| Дано: I = 2 A | Решение: 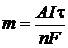 , где A(Cu) = 64 г/моль, n = 2 (ион Cu2+ присоединяет 2ē) , где A(Cu) = 64 г/моль, n = 2 (ион Cu2+ присоединяет 2ē) |
| t = 30 мин = 1800 с | |
| Найти: m(Cu). |
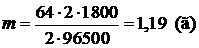
Ответ: m(Cu)=1,19 г.
Пример 11. Определите выход потоку, если при электролизе раствора сульфата никеля в течении 1 часа при силе тока 4 А на катоде выделилось 4,5 г никеля.
| Дано: I = 4 A | Решение: Найдем mтеор по формуле 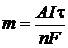 , где А(Ni) = 59 г/моль, n = 2 (число принимаемых никелем ē) , где А(Ni) = 59 г/моль, n = 2 (число принимаемых никелем ē) |
| t = 1 ч = 3600 с m(Ni) = 4,2 г | |
| Найти: h(%) |
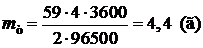 ,
,
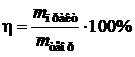 ,
,
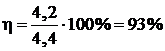
Ответ: h = 93%
Пример 12. Какой из находящихся в контакте металлов Zn-Co будет подвергаться коррозии в агрессивной среде? Напишите уравнения катодного и анодного процессов в а) кислой, б) нейтральной средах.
Решение:
При наличии контакта между металлами коррозии подвергается более активный из них, т.е. имеющий более низкое значение электродного потенциала. Этот металл будет анодом. В данном случае анодом является Zn, а катодом – Co. В зависимости от характера среды коррозия будет происходить с водородной или кислородной деполяризацией.
а) в кислой среде:
| Анод | Zn –2ē = Zn2+ | |
| Катод | 2Н+ +2ē = Н2 | |
| Zn + 2H+ = Zn2+ + H2 |
б) в нейтральной среде:
| Анод | Zn –2ē = Zn2+ | |
| Катод | O2 + 2H2O +4ē = 4OH– | |
| 2Zn + 2H2O + O2 = 2Zn(OH)2 |
Задачи для самостоятельного решения
Задание 1. Приведите уравнения и электронный баланс возможных реакций.
| Вариант | Схемы реакций |
| BaCl2 + Cd ®, AgNO3 + Fe ®, CuSO4 + Zn ® | |
| AlCl3 + Cr ®, FeSO4 + Zn ®, CoSO4 + Mn ® | |
| Mg(NO3)2 + Ca ®, NiSO4 + Al ®, SnCl2 + Mg ® | |
| Hg(NO3)2 + Cu ®, Cr2(SO4)3 + Sr ®, ZnCl2 + Al ® | |
| MnSO4 + Mg ®, CuCl2 + Co ®, NaCl + Fe ® | |
| Cd(NO3)2 + Al ®, K2SO4 + Li ®, FeSO4 + Mn ® | |
| ZnCl2 + K ®, NiCl2 + Mg ®, Cr(NO3)3 + Mn ® | |
| NiSO4 + Ag ®, Pb(NO3)2 + Sn ®, SnCl2 + Fe ® | |
| Na2SO4 + Al ®, CrCl3 + Zn ®, Cu(NO3)2 + Pb ® | |
| MnSO4 + Mg ®, SnSO4 + Cr ®, CaCl2 + Mg ® | |
| ZnCl2 + Fe ®, Cd(NO3)2 + Cr ®, NiCl2 + Co → | |
| AgNO3 + Pb ®, MgSO4 + Ba ®, CoSO4 + Zn ® | |
| Pb(CH3COO)2 + Sn ®, BaCl2 + Li ®, ZnSO4 + Mg ® | |
| AuCl3 + Ag ®, AlCl3 + Mn ®, MnCl2 + Mg ® | |
| Mg(NO3)2 + Ca ®, Cr(NO3)2 + Al ®, SnCl2 + Zn ® |
Задание 2. Составьте схемы гальванических элементов, в которых предложенный электрод был бы анодом, а в другом - катодом.
| Вариант | Электрод |
| Fe/Fe2+ | |
| Sn/Sn2+ | |
| Zn/Zn2+ | |
| Cr/Cr3+ | |
| Mn/Mn2+ | |
| Cd/Cd2+ | |
| Co/Co2+ | |
| 8 | Ni/Ni2+ |
| Pb/Pb2+ | |
| Cu/Cu2+ | |
| Al/Al3+ | |
| Ag/Ag+ | |
| Hg/Hg2+ | |
| Fe/Fe2+ | |
| Co/Co2+ |
Задание 3. В приведенных схемах реакций расставьте коэффициенты. На основании рассчета ЭДС реакций определите, возможно ли ее протекание в указанном направлении.
| Вариант | Схема реакции |
| NaBr + K2Cr2O7 + H2SO4 ® Cr2(SO4)3 + Br2 + K2SO4 + Na2SO4 + H2O | |
| NaBr + MnO2 + H2SO4 ® MnSO4 + Br2 + Na2SO4 + H2O | |
| KMnO4 + FeSO4 + H2SO4 ® MnSO4 + Fe2(SO4)3 + K2SO4 + H2O | |
| K2CrO4 + KCl + H2O ® Cr(OH)3 + KOH + Cl2 | |
| NaClO3 + KI + H2O ® NaCl + I2 + KOH | |
| KBrO3 + KBr + H2SO4 ® Br2 + K2SO4 + H2O | |
| KClO3 + FeCl2 + HCl ® FeCl3 + KCl + H2O | |
| H2SeO3 + HI ® I2 + Se + H2O | |
| NaClO4 + KI + H2SO4 ® NaCl + I2 + K2SO4 + H2O | |
| SnCl2 + HNO2 + HCl ® SnCl4 + NO + H2O | |
| KClO3 + FeCl2 + HCl ® FeCl3 + KCl + H2O | |
| KBr + KСlO + H2O ® KCl + Br2 + KOH | |
| K2Cr2O7 + KNO2 + HNO3 ® Cr(NO3)3 + KNO3 + H2O | |
| Cr(OH)3 + Cl2 + NaOH ® Na2CrO4 + NaCl + H2O | |
| HCl + MnO2 ® MnCl2 + Cl2 + H2O |
Задание 4. Решите расчетную задачу.
1. Определите электродный потенциал цинка в растворе его соли с концентрацией ионов Zn2+ 0,05 моль/л.
2. Рассчитайте электродный потенциал магния в 0,001 М растворе его соли.
3. Определите электродный потенциал железа в 0,001 М растворе FeSO4.
4. Рассчитайте электродный потенциал марганца в 0,001 М растворе его соли.
5. Рассчитайте электродный потенциал хрома в 0,1 М растворе Cr2(SO4)3.
6. Вычислите потенциал свинцового электрода в насыщенном растворе PbBr2 (ПР = 9×10–6), при [Br–] = 1 моль/л.
7. Каков потенциал водородного электрода при рН 3,5?
8. Вычислите потенциал серебряного электрода в насыщенном растворе AgBr (ПР = 6×10–13), содержащем 0,001 моль/л NaBr.
9. Рассчитайте электродный потенциал цинка в 0,1 М растворе Zn(NO3)3.
10. Вычислите концентрацию ионов водорода в растворе, в котором потенциал водородного электрода равен –82 мВ.
11. Рассчитайте электродный потенциал кобальта в 0,01 М растворе CoCl2.
12. Рассчитайте электродный потенциал марганца в 0,01 М растворе соли марганца.
13. Каков потенциал медного электрода в 0,001 М растворе CuSO4?
14. Рассчитайте электродный потенциал ртути в растворе, концентрация ионов Hg2+в котором равна 0,001 моль/л.
15. Рассчитайте потенциал серебряного электрода в насыщенном растворе AgCl (ПР = 1,6×10–10), если концентрация ионов хлора в растворе равна 0,1 моль/л.
Задание 5. Решите расчетную задачу.
1. Вычислете ЭДС элемента, состоящего из Zn в 0,1 М растворе ZnSO4 и Pb в 0,05 М растворе Pb(NO3)2. Составьте схему элемента.
2. При какой концентрации ионов хрома ЭДС элемента, составленного из хромового и стандартного цинкового электродов, будет равна 0?
3. Чему равна ЭДС гальванического элемента, составленного из серебряного электрода в 0,001 М растворе AgNO3 и стандартного водородного электрода?
4. ЭДС элемента, составленного из стандартного H2/2H+ и свинцового электрода в 1 М растворе соли свинца, равна 126 мВ. Каков потенциал свинцового электрода?
5. Рассчитайте ЭДС элемента, составленного из медного и свинцового электродов в 0,01 и 0,1 М растворах их солей соответственно.
6. Рассчитайте ЭДС гальванического элемента, состоящего из нормального водородного электрода и водородного электрода в растворе с рН = 10.
7. Рассчитайте ЭДС элемента, составленного из марганца в 0,01 М растворе его соли и серебра 0,1 М растворе AgNO3.
8. Вычислите ЭДС элемента, состоящего из цинка в 0,01 М растворе ZnSO4 и стандартного водородного электрода.
9. Вычислите ЭДС медно-цинкового элемента, если металлы погружены в 0,1 и 0,01 М растворы их солей соответственно.
10. Рассчитайте ЭДС элемента сотоящего из стандартного водородного и хромового электрода в 0,01 М растворе соли хрома (II).
11. Рассчитайте ЭДС элемента, составленного из марганцевого и медного электродов в 0, 001 и 0,1 М растворах их солей соответственно.
12. Рассчитайте ЭДС элемента, составленного из магния в 0,1 М растворе его соли и свинца в 0,01 М растворе Pb(NO3)2.
13. Чему равна ЭДС свинцово-цинкового элемента, если металлы погружены в 0,01 и 0,1 М растворы своих солей соответственно?
14. ЭДС элемента, состоящего из стандартного водородного и свинцового электродов, составляет –160 мВ. Какова концентрация соли свинца?
15. Рассчитайте ЭДС элемента, составленного из кобальта в 0,1 М растворе хлорида кобальта (II) и меди в 0,01 М растворе сульфата меди.
Задание 6.Определите, какой из находящихся в контакте металлов, будет подвергаться коррозии в агрессивной среде? Напишите уравнения катодного и анодного процессов в а) кислой, б) нейтральной средах.
| Вариант | ||||||||
| Металлы | Cu-Hg | Pb-Sn | Cd-Co | Zn-Fe | Ni-Sn | Co-Mn | Co-Cr | |
| Вариант | ||||||||
| Металлы | Cd-Sn | Fe-Al | Ni-Zn | Pb-Cu | Co-Fe | Cr-Mn | Zn-Al | Al-Ni |
Задание 7. Напишите уравнения реакций электролиза расплава соли на инертных электродах:
| Вапиант | ||||||||
| Соль | K2S | MgCl2 | CuCl2 | CaCl2 | NaCl | NaI | BaBr2 | CuBr2 |
| Вариант | ||||||||
| Соль | MgBr2 | SrCl2 | Na2S | K2Se | RbCl | BaI2 | MnBr2 |
Задание 8. Напишите уравнения реакций электролиза растворов солей на инертных электродах:
| Вариант | |||||
| Соли | CuCl2 NaNO3 | MgCl2 Ba(NO3)2 | CuSO4 Na2СO3 | Cr2 (SO4)3 K2CO3 | BaCl2 LiNO3 |
| Вприант | |||||
| Соли | AgNO3 KC1O3 | Na2S Ca(NO3)2 | NiSO4 K2CO2 | MgI2 К2SO4 | FeCl3 LiClO4 |
| Вариант | |||||
| Соли | Pb(NO3)2 CaCl2 | Cu(NO3)2 Al(NO3)3 | BaS KNO3 | K2Se Rb2SO4 | Ca(ClO)2 Pb(CH3COO)2 |
Задание 9. Определите какие из ионов, из имеющихся в растворе, и в какой последовательности будут разряжаться на инертных катоде и аноде?
| Вариант | Ионы в растворе | Вариант | Ионы в растворе |
| Cl–, NO3–, Al3+, Sn4+, Ni2+ | Mg2+, I–, Cr3+, SO42–, Cu2+ | ||
| K+, CH3COO–, Pb2+, Cl–, Ni2+ | SO42–, Hg2+, Co2+, NO3–, Na+ | ||
| Pb2+, Be2+, ClO2–, H+, I– | S2–, H+, Cl–, PO43–, Na+ | ||
| Mg2+, Cl–, Ni2+, NO3–, K+ | NO3–, Fe2+, H+, Cl–, Br– | ||
| Zn2+, ClO3–, Na+, Br–, H+ | Ni2+, SO42–, Al3+, Rb+, Br– | ||
| Co2+, NO3–, Cl–, Al3+, Rb+ | SO42–, Cu2+, Li+, Br–, H+ | ||
| S2–, Br–, H+, CH3COO–, K+ | ClO4–, Na+, Br–, Zn2+, Cu2+ | ||
| SO42–, K+, Fe2+, Cl–, Cu2+ |
Задание 10. Решите расчетную задачу.
1. Как изменятся массы медных катода и анода, если через раствор сульфата меди пропускать электрический ток силой 2,5 А в течение двух часов?
2. Из раствора платиновой соли за 20 минут ток силой 2,5 А выделил 1,517 г металла. Определите молярную массу эквивалента платины.
3. Сколько времени потребуется для осаждения 10 г свинца из раствора Pb(CH3COO)2 током силой 2 А?
4. Какое количество электричества потребуется для выделения из раствора серной кислоты двух молей водорода?
5. Чему равна эквивалентная масса кадмия, если для выделения 1 г его из расплава соли надо пропустить через раствор 1717 Кл электричества?
6. Сколько времени потребуется для получения 11,2 л кислорода электролизом раствора NaOH при силе тока 2 А?
7. Сколько времени потребуется для полного разложения трех молей воды током силой 5 А?
8. Какое количество электричества потребуется для получения 6,4 кг чистой меди из раствора ее соли?
9. Ток силой 2 А выделяет из раствора хлорида золота (III) в течение 1 часа 4,905 г золота. Вычислите эквивалент этого металла.
10. Через раствор AgNO3 пропускали ток силой 6 А в течении 30 минут. Какова масса выделившегося серебра?
11. При прохождении через раствор NaOH в течение двух минут выделилось 200 см3 водорода при н.у. Найдите силу тока.
12. При прохождении тока силой 0,5 А за 1 час из раствора CuSO4 выделилось 0,5927 г меди. Определите молярную массу эквивалента меди.
13. Через раствор BiCl3 проходит ток силой 2 А в течение 10 минут. Найдите массу разложившегося электролита.
14. Какой объем кислорода (н.у.) выделится при пропускании тока силой 3 А в течение 30 минут через водный раствор KOH?
15. Через раствор сульфата натрия в течение 10 минут пропускали ток силой 2 А. Какие продукты и в каких количествах образуются на платиновых катоде и аноде, если электродные пространства разделены диафрагмой?
Задание 11. Решите задачу на расчет выхода по току.
1. При прохождении 4000 А×ч электричества выделилось 2,24 кг кальция из расплава CaCl2. Вычислите выход кальция по току
2. Из раствора AuCl3 в течение 1 часа при силе тока 2 А выделилось 4,5 г золота. Вычислите выход золота по току.
3. Из раствора CdSO4 за 40 минут ток силой 1,5 А выделил 2 г кадмия. Вычислите выход по току.
4. Рассчитайте массу серебра выделяющегося при пропускании тока силой 3 А через раствор AgNO3 в течение 30 минут, если выход по току составляет 98%?
5. При прохождении 18000 Кл электричества через подкисленный раствор сульфата никеля на катоде выделилось 5 г никеля. Вычислите выход по току для процесса выделения никеля.
6. Сколько меди выделится на катоде, при пропускании тока силой 1,5 А в течение 3 часов, если выход по току составляет 95%?
7. Вычислите выход по току, если в ванне при силе тока 400000 А в течение 5 ч выделилось 72,6 кг магния из расплава MgCl2.
8. Какое количество электричества потребуется для получения 2 молей водорода электролизом воды, если выход по току составляет 85%?
9. Какая масса свинца выделится при электролизе Pb(NO3)2 в течение 1 часа при силе тока 3 А, если выход по току составляет 75%?
10. Ток силой 1,5 А выделяет из раствора соли кадмия за два часа 6 г металла. Рассчитайте выход по току.
11. При прохождении тока силой 0,5 А за 30 минут из раствора CuSO4 выделилось 0,27 г меди. Определите выход по току.
12. Какой объем водорода выделится при пропускании через раствор серной кислоты тока силой 2 А в течение трех часов, если выход по току составляет 93%?
13. При пропускании тока силой 2,5 А через раствор ZnSO4 в течение 2 часов на катоде выделилось 5,1 г цинка. Определите выход по току.
14. Вычислите массу никеля выделившегося при электролизе NiCl2 током 1 А в течение часа, если выход по току составляет 90%.
15. При рафинировании меди из раствора соли выделяется 338 г меди при прохождении 300 а×ч электричества. Вычислите выход потоку.
Тестовые задания для самоконтроля
1. ЭДС гальванического элемента определяется по формуле:
1) Еэ = Ек – Еа;
2) Еэ = Ек + Еа;
3) Еэ = Еа – Ек.
2. При электролизе расплава соли CaCl2 ионы хлора будут:
1) восстанавливаться на катоде;
2) окисляться на аноде;
3) окисляться на катоде.
3. При электролизе раствора соли Cr2(SO4)3 на инертных электродах будут образовываться продукты:
1) Cr, O2;
2) Cr, H2SO4;
3) Cr, H2SO4, O2.
4. Продуктами электролиза раствора Na2SO4 на инертных электродах являются:
1) Na, H2SO4, O2;
2) H2, O2;
3) H2, NaOH.
5. Электродный потенциал металла в растворе с единичной концентрацией его собственных ионов, измеренный относительно водородного электрода, – это:
1) катодный потенциал;
2) анодный потенциал;
3) стандартный электродный потенцал.
6. Коррозионный процесс, протекающий в растворах неэлектролитов:
1) электрохимическая коррозия;
2) газовая коррозия;
3) химическая коррозия.
7. На аноде из раствора, содержащего ионы: Al3+, Zn2+, NO3–, Cl–, Na+, I–, будут разряжаться ионы в последовательности:
1) NO3–, Cl–, I–;
2) Zn2+, Al3+, H2O;
3) I–, Cl–, H2O.
8. Продукты электролиза раствора СоСl2 на инертных электродах:
1) Co, Cl2;
2) H2, O2;
3) H2, Co(OH)2.
9. Продукты электролиза раствора соли Cu(NO3)2 на инертных электродах:
1) H2, O2;
2) Cu, O2;
3) Cu, O2, HNO3.
10. В концентрированной азотной кислоте и в растворе щелочи будет пассивироваться металл…
1) Al;
2) Fe;
3) Cr.
11. Продукты коррозии контакта металлов Mg-Cu в нейтральной среде:
1) Mg2+, H2;
2) Cu2+, H2;
3) Mg(OH)2.
12. Продукты коррозии контакта Mg-Cu в кислой среде:
1) Mg2+, H2;
2) Cu2+, H2;
3) Сu(OH)2.
13. Для защиты днищ судов от коррозии используют:
1) катодную;
2) анодную;
3) катодную протекторами.
Ответы к тестовым заданиям
| № вопроса | |||||||||||||
| № ответа |
Лабораторная работа № 8
Ряд напряжений металлов и электрохимическая коррозия
Цель работы:изучение электрохимической активности металлов; рассмотрение механизма электрохимической коррозии металлов, как работы гальванического элемента; исследование влияния природы металла, среды и внешних условий на процессы коррозии; ознакомление со способами защиты от коррозии; рассмотрение некоторых процессов электролиза в растворах электролитов.
Реактивы: металлы: Zn, Pb, Cu; растворы Cu(NO3)2 (0,01 М, 1 М), Zn(NO3)2 (0,01 М), ZnCl2 (0,1 M), PbCl2 (0,1 M), CuCl2 (0,1 M); индикаторы: фенолфталеин, лакмус, универсальная индикаторная бумага, гальванопары: Zn-Fe, Al-Cu; растворы: K3[Fe(CN)6] (0,5 М), H2SO4 (2 M), HNO3 (конц.); ингибитор уротропин.
Оборудование: промывалка с дистиллированной водой, фильтровальная бумага, штатив с пробирками, выпрямитель, микрошпатель, пипетки, U-образный сосуд, газовая горелка или спиртовка и спички.
Ход работы
Опыт 1. Сравнение электрохимической активности металлов
В две пробирки налейте по 10 капель растворов солей свинца (II), меди (II). Опустите в пробирки по кусочку цинка. Отметьте измерения, наблюдаемые в пробирках, напишите уравнения реакций. Повторите опыт еще два раза, опуская свинец и медь в пробирки с растворами не содержащими их ионы. Напишите уравнения наблюдаемых реакций. Опытные данные занесите в таблицу 9.4, поставив знак «+» под ионами металлов в тех случаях, когда эти металлы вытеснялись из их солей, и знак «0», когда вытеснения не происходило.
Таблица 9.4
Способность металлов восстанавливать друг друга из растворов их солей
| Металл | Ионы металла в растворе | |||
| Zn2+ | Pb2+ | Cu2+ | ||
| Zn | ||||
| Pb | ||||
| Cu | ||||
В выводе охарактеризуйте восстановительную способность изученных металлов и расположите их в ряд по уменьшению этого свойства. Соответствует ли расположение металлов в этом ряду их положению в ряду электрохимической активности металлов?
Опыт 2. Контактная коррозия
На кусочке цинка закрепите канцелярскую железную скрепку, сцепите между собой железную и медную скрепки так, чтобы между металлами был тесный контакт. В пробирки внесите по 2-3 мл 2 М раствора серной кислоты. Добавьте в каждую пробирку по две капли раствора 0,5 М раствора K3[Fe(CN)6] (реактив на ион Fe2+). Что наблюдаете? Объясните процессы, происходящие в каждой пробирке.
Напишите схему медно-железного и железно-цинкового гальванических микроэлементов, схемы анодного и катодного процессов при работе гальвано-пар.
Опыт 3.Взаимодействие цинка с кислотой в присутствии ионов меди (II)
Налейте в две пробирки по 5-6 капель 2 М раствора серной кислоты. В одну из пробирок добавьте несколько капель раствора сульфата меди. В обе пробирки поместите по кусочку цинка. В какой пробирке водород выделяется более интенсивно и почему?
Опыт 4.Защита металла от коррозии химическим пассивированием
Очистите наждачной бумагой два стальных гвоздя или разогнутые канцелярские скрепки. Одну из них опустите в пробирку с концентрированным раствором азотной кислоты. Запишите наблюдения. Ополосните проволоку водой и вновь опустите в пробирку с раствором серной кислоты. Для сравнения опустите вторую необработанную проволоку в тот же раствор серной кислоты. Сравните скорость выдел
