Взаимодействие алюминия с разбавленными кислотами.
Выполнение работы.В три пробирки внести по 5-8 капель 2 н. растворов кислот: хлороводородной, серной, азотной. В каждую пробирку опустить по маленькому кусочку алюминиевой фольги. Во всех ли случаях протекает реакция на холоду? Нагреть пробирки на водяной бане. Что наблюдается? Написать уравнения реакций. Какой газ выделяется при взаимодействии алюминия с разбавленной азотной кислотой? С разбавленными серной и хлороводородной?
Восстановительные свойства тиосульфата натрия.
Выполнение работы.В две пробирки внести раздельно по 5-6 капель бромной и иодной воды. В обе пробирки добавить по несколько капель раствора тиосульфата натрия до обесцвечивания содержимого пробирок.
Запись данных опыта.Написать уравнения протекающих реакций, учитывая, что бром окисляет тиосульфат до сульфата, при этом в реакции участвует вода. Иод окисляет тиосульфат до тетратионата Na2S4O6. В какую степень окисления переходит при этом бром и иод? Может ли хлорная вода окислить тиосульфат натрия? Ответ мотивировать.
КОНТРОЛЬНЫЕ ВОПРОСЫ ДЛЯ ЗАЩИТЫ РАБОТЫ
1. Какие элементы относят к s- и р-семействам? По какому признаку определяют семейство элементов?
2. Как изменяют металлические и неметаллические свойства элементов в периодах и главных подгруппах Периодической системы?
3. Как изменяют кислотные и основные свойства оксидов и гидроксидов s- и p-элементов в периодах и в главных подгруппах?
4. Охарактеризуйте свойства элементов IA-VIIIA групп Периодической системы и их основных соединений.
5. Напишите уравнения всех реакций, упомянутых в разделах 1 и 2.
D-элементы
ВВЕДЕНИЕ
К d-элементам относят элементы, в электронных конфигурациях которых заполняется d-подуровень. На внешнем электронном ns-слое находится по два электрона (4s-, 5s-, 6s-), а на предвнешнем – от 1 до 10. Но это положение выполняется не всегда. У элементов подгруппы меди электронные конфигурации имеют вид (n-1)d10ns1,а не (n-1)d9ns2. Кроме того, и некоторые другие элементы периодической системы имеют электронные конфигурации, не подчиняющиеся названному правилу (табл.1).
Таблица 1
Электронные конфигурации некоторых d-элементов
| Элемент | Электронная конфигурация | |
| Ожидаемая | Реальная | |
| Cr | 3d44s2 | 3d54s1 |
| Mo | 4d45s2 | 4d55s1 |
| Ru | 4d65s2 | 4d75s1 |
| Rh | 4d75s2 | 4d85s1 |
| Pd | 4d85s2 | 4d105s0 |
| Pt | 5d86s2 | 5d96s1 |
Причины появления таких структур следующие. Атомы стремятся приобрести наиболее устойчивые структуры наполовину (Cr, Mo) или полностью заполненных орбиталей (Cu, Ag, Au). Но этого еще недостаточно для объяснения структур атомов. У технеция и рутения должны быть электронные конфигурации 4d55s2 (Tc) и 4d65s2 (Ru), а у них конфигурации 4d66s1 и 4d75s1 соответственно.
Из электронных конфигураций видно, что ns-электроны заполняют подуровни перед (n-1)d-орбиталями, Но это не значит, что ns-орбитали устойчивее, чем (n-1)d-орбитали. На самом деле в реакциях сначала отрываются ns-электроны, а только после них вступают во взаимодействие (n-1)d-электроны. Так, у атома марганца электронная конфигурация 3d54s2, а у иона марганца Mn2+ – 3d54s0.
Все d-элементы в свободном виде являются металлами, обладающими высокой твердостью, прочностью, высокими температурами плавления и кипения, высокими значениями тепло- и электропроводности. Высокая прочность и твердость кристаллических решеток d-металлов объясняется большой долей ковалентной связи. Высокие тепло- и электропроводность объясняются наличием слабо связанных внешних s-электронов.
Многие d-элементы растворяются в минеральных кислотах-неокислителях, в ряду стандартных потенциалов (Приложение, табл. П.1) стоят до водорода. Но есть и устойчивые (благородные) металлы, которые с кислотами не реагируют (Pt, Au и др.).
За некоторым исключением все d-элементы проявляют переменную валентность (и степень окисления).
| Группа | I | II | III | IV | V | VI | VII | VIII |
| Степень окисления | ||||||||
В этих подгруппах сверху вниз увеличивается устойчивость высших степеней окисления. Электроны (n-1)d-слоя все больше экранируются от ядра внутренними электронными слоями, их связь с ядром ослабевает, d-электроны становятся более подвижными.
По подгруппам d-элементов сверху вниз несколько растут первые и вторые потенциалы ионизации. Но после отрыва s-электронов потенциалы ионизации сверху вниз уменьшаются. Вследствие этого для второго и третьего рядов d-элементов высшие степени окисления становятся более устойчивыми. Для 3d-элементов по ряду степени окисления растут до марганца, то есть у элементов от Sc до Mn высшие степени окисления равны номеру группы. После марганца элементы не проявляют характеристичные валентности вследствие заполнения 3d-орбиталей спаренными электронами.
Для d-элементов характерны следующие степени окисления: 4-8 – высшие; 3-4 – средние; 2-3 – низшие. В высших степенях окисления связи ковалентные. Элементы по своим свойствам похожи на p-элементы главных подгрупп, оксиды их проявляют кислотные свойства. В средних степенях окисления связи ковалентные. Соединения имеют амфотерный характер, проявляют окислительно-восстановительную двойственность. В низших степенях окисления характер связи преимущественно ионный. Гидроксиды и оксиды проявляют преимущественно основный характер. Для соединений d-элементов в низших степенях окисления характерны восстановительные свойства. Таким образом, по мере повышения степени окисления повышается кислотный характер оксидов и окислительная способность соединений:
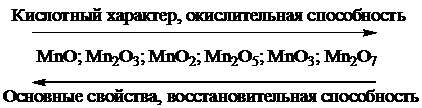
По подгруппам d-элементов увеличивается координационное число атомов и становится разнообразнее стереохимия их соединений. Ионы MoO42–, WO42–, TeO42–, ReO4– не проявляют окислительных свойств, в отличие от CrO42– и MnO4–.
Тяжелые d-элементы часто образуют такие соединения, как RuO4, OsO4, WCl6, PtF6, KOsF9, KReH9, которых нет для легких d-элементов. Большинство соединений d-элементов окрашены. Так, соединения V(V) – желтые, V(IV) – синие, V(III) – зеленые, V(II) –фиолетовые. Окраска обусловлена легкой деформируемостью d-орбиталей под действием лигандов. Расщепление d-орбиталей полем лигандов требует различных затрат энергии, зависящей от состояния окисления центрального атома и природы самого лиганда, что и обусловливает различную окраску.
