Указания к выполнению контрольных работ
Курс органической химии распределен в соответствии с программой на две контрольные работы. Каждая контрольная работа состоит из трех заданий.
Номера задач контрольных работ студенты находят по таблице, где номер первого задания стоит против начальной буквы его фамилии, номер второго задания − против начальной буквы его имени, номер третьего − против начальной буквы его отчества. Например, студент Петров Иван Николаевич выполняет в контрольных работах задачи: 1, 11, 21; 35, 45,55; 69, 79, 89.
Таблица 1
Варианты контрольных заданий
| Обозначение варианта | Задания | ||||||||
| I | II | III | |||||||
| А, Б, П | |||||||||
| В, Г, Ч | |||||||||
| Д, Е, Р | |||||||||
| Ж, З, Ш | |||||||||
| И, Т,С | |||||||||
| К,У, Я | |||||||||
| Л,Ф, Ю | |||||||||
| М, Э | |||||||||
| Н, Х, Щ | |||||||||
| О, ,Ц |
При ответе на вопросы задачи следует избегать длинных описаний, решение должно обязательно содержать формулы и химические уравнения. Все смещения электронов (эффекты индуктивный, мезомерный) необходимо обозначить стрелками. Ниже приводится примеры решения и оформления задачи.
Примеры решения задач
Задача 1. Установите строение соединения состава С8Н18, которое может быть получено в качестве единственного органического продукта по реакции Вюрца из первичного галоидного алкила; нитрование же исследуемого углеводорода по Коновалову приводит к образованию третичного нитросоединения.
Ответ. Реация Вюрца практически используется только для синтеза симметрично построенных алканов; при этом лучшие выходы получаются при использовании первичных галоидных алкилов (при использовании вторичных алкилгалогенидов имеет место побочное протекание реакции дегидрогалогенирования; при работе с третичными алкилгалогенидами дегидрогалогенирование становится практически единственным направлением реакции:
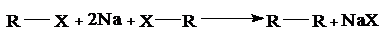 |
Нитрование по Коновалову − реакция радикального замещения (SR) − протекает селективно, через стадию образования наиболее устойчивого радикала. Устойчивость радикалов уменьшается в ряду: третичный > вторичный > первичный > радикал СН3.
При наличии в углеродной цепи третичных атомов углерода нитрование по Коновалову всегда приводит к образованию третичного нитропроизводного.
Из вышесказанного следует, что алкан состава С8Н18 − 2,5-диметилгексан
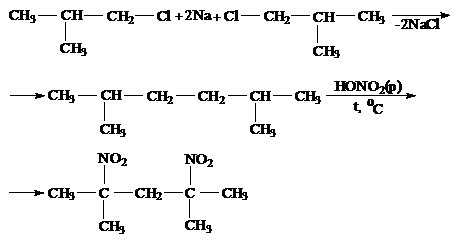 |
Задача 2. Рассмотрите механизм реакций
СH3-CH2-CH2Br  CH3-CH=CH2 + CH3-CH2-CH2X
CH3-CH=CH2 + CH3-CH2-CH2X
Какой реагент: NaOH, C2H5ONa, C6H5ONа, C2H5OH следует выбрать для проведения реакции, чтобы выход алкена был наибольшим?
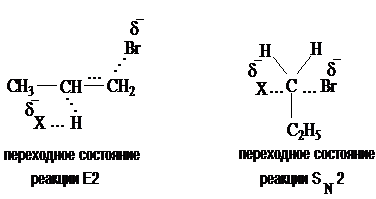 Ответ. При действии нуклеофильного агента, проявляющего основные свойства, в среде спирта имеет место дегидрогалогенирование первичного галогеналкана по Е2 реакции. Одновременно может протекать замещение по SN2 реакции:
Ответ. При действии нуклеофильного агента, проявляющего основные свойства, в среде спирта имеет место дегидрогалогенирование первичного галогеналкана по Е2 реакции. Одновременно может протекать замещение по SN2 реакции:
 Выход алкена тем выше, чем более сильным основанием является нуклеофил. Основность нуклеофилов уменьшается по ряду:
Выход алкена тем выше, чем более сильным основанием является нуклеофил. Основность нуклеофилов уменьшается по ряду:
Этилат-анион является наиболее сильным основанием из числа, предложенных в задаче. Выход алкена в этом случае будет наибольшим.
Задача 3. Определить строение вещества состава С7Н9N, которое: 1) образует соли с кислотами; 2) при диазотировании и последующем нагревании с водой дает п-крезол.
Ответ. Способность к реакции диазотирования, а также получения в результате ряда превращений п-крезола дает основание считать, что исследуемое соединение является первичным ароматическим амином. Из рассмотрения молекулярной формулы соединения можно сделать заключение, что в ароматическом ядре имеется также в качестве заместителя метильная группа. На основании этого, строение исследуемого соединения может быть изображение следующей формулой:
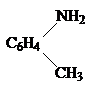 |
Получение п-крезола при диазотировании и последующем нагревании с водой показывает, что NH2- и CH3 - группы находятся в пара-положение друг к другу. Следовательно, исследуемое вещество имеет строение:
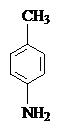
Эта формула удовлетворяет всем условиям задачи.
1) Образование солей с кислотами:
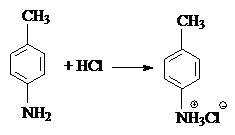 |
2) Образование п-крезола при диазотировании и последующем нагревании с водой:
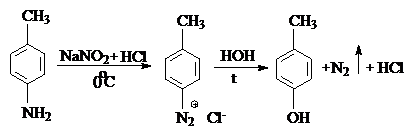 |
Задача 4.
Напишите реакции гидролиза пара-хлортолуола и 2,4-динитрохлортолуола. Разберите их механизм.
Ответ. Гидролиз галогенпроизводных углеводородов протекает по механизму нуклеофильного замещения, где нуклеофильной частицей является ион
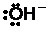
 Хлор, связанный с бензольным кольцом, является малореакционноспособным:
Хлор, связанный с бензольным кольцом, является малореакционноспособным:
Это объясняется его двоесвязанностью с бензольным кольцом за счет сопряжения р-электронов атома хлора с р-орбиталями ароматического ядра (+М). Группа -СН3, являющаяся электронодонором, увеличивает электронную плотность на кольце и не облегчает замещение галогена.
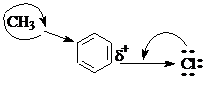 |
Поэтому нуклеофильное замещение атома хлора в п-хлорутолуоле протекает в очень жестких условиях при высоких температурах (300оС) либо при более низких температурах в присутствии катализаторов (200оС, медь, реакция Ульмана). Реакция протекает через отщепление хлорводорода и промежуточное образование чрезвычайно реакционно способного кольца дегидробензола:
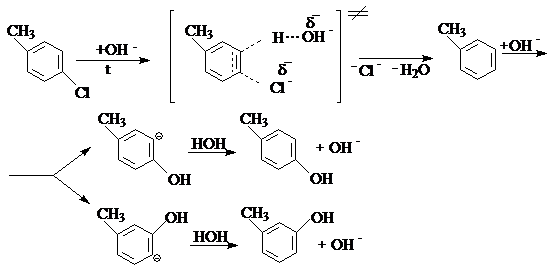
Подход группы ОН- к каждому из атомов углерода тройной связи дегидробензола равновероятен. Поэтому, в продуктах реакции оказывается одинаковое количество м- и п-изомера.
В 2,4-динитрохлорбензоле две нитрогруппы значительно понижают электронную плотность на ароматическом ядре. Это обусловливает протекание реакции по карбоанионному механизму: образующийся в результате присоединения нуклеофила к ароматическому ядру, s-комплекс значительно стабилизирован за счет электронно-акцепторных свойств двух нитрогрупп и атома хлора:
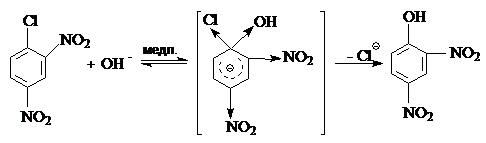
Задача 5. Сравните легкость протекания реакции электрофильного замещения ряда соединений: бензол, фенол, фенолят натрия, нитробензол, бромбензол.
Ответ. В бензоле электронная плотность кольца распределена равномерно. Электронодонорные заместители в производных бензола способствуют стабилизации образующихся s-комплексов и поэтому ускоряют процесс. Электроноакцепторные − оказывают противоположное влияние. В соответствии с этими данными определяем стратегию решения задачи.
1 этап. Группируем сравниваемые заместители на электронодонорные (-ОН, ONa) и электроноакцепторные (-NO2, -Br).
2 этап. Сравниваем влияние электроноакцепторных и электронодонороных заместителей между собой.
Группа -О- обладает положительным индуктивным эффектом, а сравниваемая с ней группа -ОН - отрицательным индуктивным эффектом. По этой причине, при равенстве мезомерных эффектов группа -О- оказывает более сильное стабилизирующее действие на образующийся s-комплекс, чем группа ОН.
 |
Это обусловливает более высокую реакционную способность фенолята натрия по сравнению с фенолом.
Нитрогруппа обладает сильным суммарным электроноак-
цепторным эффектом, поскольку ее действие связано со сложением сильных −М и −I-эффектов. В то же время электроноакцепторные свойства брома связаны со сложением умеренного −I-эффекта и слабого +М-эффекта, и результирующий электроноакцепторный эффект не очень велик. Это обусловливает более сильное дестабилизирующее действие нитрогруппы на образующиеся при электрофильном замещении s-комплексы по сравнению с атомом бора. Таким образом, нитробензол менее реакционноспособен в реакциях электрофильного замещения по сравнению с бромбензолом.
Окончательный ряд реакционных способностей выглядит следующим образом:
C6H6ONa > C6H5OH > C6H6 > C6H6Br > C6H5NO2
8. Контрольные задания
Контрольная работа № 1
1. Что называют индуктивным эффектом? Приведите примеры атомов и атомных групп, проявляющих отрицательный (-I) и положительный (+I) индуктивные эффекты. Индуктивный эффект какого атома принят равным нулю?
2. Напишите структурные формулы изомеров состава С6Н12, назовите их, укажите первичные, вторичные, третичные атомы углерода. Какой тип связи существует в этих соединениях? Объясните понятие "sp3-гибридизация".
3. На примере предельных углеводородов объясните, что называется гомологическим рядом, гомологической разностью? Объясните принцип построения названий по систематической номенклатуре (IUPAC) на примерах CH3-C(CH3)2-CH2-C(CH3)2-CH2-CH(CH3)-CH3 и CH3-CH2-CH(CH3)-CH2-CH(C4H9)-CH2-CH(C3H7)-CH2-CH3. Какой тип связи существует в этих соединениях?
4. В соединениях CH3-NO2, C2H5-I, (CH3)3C-OH укажите группы, имеющие положительный и отрицательный индуктивные эффекты. Что такое индуктивный эффект?
5. Каким образом происходит разрыв связей при хлорировании
2-метилпропана? Укажите наиболее стабильный радикал:
CH3-(CH3)CH-CH2 или CH3-(CH3)C-CH3. Обоснуйте ряд реакционных способностей С-Н связей в алканах (трет. С-H > втор. С-Н > перв. С-H) в реакциях радикального замещения.
6. Гомология и гомологические ряды в органической химии на примерах углеводородов (алканов, алкенов, алкинов, диенов). Укажите, какие из представленных ниже соединений являются гомологами, какие изомерами: а) 2,4-диметилбутан; б) гексан; в) 2-метилпропен, г) бутен-2; д) 2-метилпентен-1; е) 2,3-диметилбутен-1; ж) пентин-1; з) 2-метилбутадиен-1,3.
7. Напишите структурные формулы изомеров состава С4Н9Cl. Назовите их по систематической номенклатуре. Какие типы связей существуют в этих соединениях?
8. Изомерия скелета и изомерия, вызванная положением заместителя. Напишите изомеры гексана и ароматического углеводорода состава С9 Н12 . Назовите их и укажите разновидности изомерии.
9. Официальная номенклатура органических соединений – номенклатура ИЮПАК. Назовите по международной номенклатуре следующие соединения и радикалы:
CH3 ––CH=CH––CH2 ––CН(CH3 )––CH3 ; C3 H7 CH3; C2 H5; C4 H9.
10. Какие углеводороды получаются при электролизе натриевой соли пропионовой кислоты и при сплавлении этой кислоты с твердой щелочью? Разберите механизмы обеих реакций. Что такое индуктивный эффект?
11. Напишите уравнение реакции хлорирования 2,2,4-триметилпентана. Разберите ее механизм. Что образует образовавшийся продукт галогенирования в присутствии спиртового раствора щелочи?
12. Официальная номенклатура органических соединений – номенклатура ИЮПАК. Назовите по международной номенклатуре следующие соединения и радикалы:
CH3 ––CH2 ––CH(СН3)––CH2 —CH(С2Н5)––CH3; CH3 ––C(СН3) ––CH3 ; C2 H5 CH3 ; C4 H9 CH3; (СН3) 2СН.
13. Из каких алкилгалогенидов можно получить бутан и 4,5-диметилоктан реакцией Вюрца? Разберите механизм этой реакции.
14. Какие углеводороды получаются при электролизе натриевой соли пропионовой кислоты и при сплавлении этой кислоты с твердой щелочью? Разберите механизмы обеих реакций. Что такое индуктивный эффект?
15. Напишите уравнение реакции хлорирования 2,2,3-триметилбутана. Разберите ее механизм. Что образует образовавшийся продукт галогенирования в присутствии спиртового раствора щелочи?
16. Углеводород С8Н18 можно получить по реакциям Вюрца и Кольбе без побочных продуктов. При его бромировании и нитровании получаются третичные продукты замещения, а при хлорировании − три изомерных хлоралкана. Установите строение С8Н18, назовите углеводород и напишите все реакции.
17. Определите строение углеводорода С6Н14, при бромировании которого получается третичное бромпроизводное. Углеводород можно получить по реакции Вюрца без побочных продуктов. Напишите уравнения реакций и назовите углеводород. Каков механизм реакции бромирования?
18. Приведите уравнения реакций окисления циклогексана и циклопентана. Какое промышленное значение имеют образовавшиеся дикарбоновые кислоты? Напишите уравнения реакций их промышленного использования.
19. Напишите реакцию метилциклопропана с бромоводородом. Приведите ее механизм.
20. Напишите уравнения реакций гидрирования, галогенирования, гидрогалогенирования и окисления циклопропана, циклобутана и циклопентана. Объясните причину различного поведения этих циклов в данных реакциях.
21. Основные положения теории химического строения органических соединений А. М. Бутлерова. Напишите все изомеры гептана, назовите их по международной номенклатуре.
22. Напишите уравнение реакций окисления 2-метилпропена и 2,3,3-триметилбутена-1 разбавленным водным раствором перманганата калия и концентрированным раствором перманганата калия. Назовите полученные продукты.
23. Какие продукты образуются при окислении бутена-2: а) разбавленным раствором КМnО4; б) концентрированным раствором КМnО4; в) кислородом воздуха в присутствии Ag; г) кислородом воздуха без катализатора? Напишите уравнения реакций и назовите образовавшиеся соединения.
24. Напишите уравнение реакции электрофильного присоединения HBr к бутену-2. Что образует полученный продукт в условиях реакции Вюрца? Назовите образовавшиеся соединения.
25. Установите структуру углеводорода С5Н10, если он обесцвечивает бромную воду и окисляется в уксусную и пропионовую кислоты. Напишите все реакции. Объясните механизм первой реакции.
26. Напишите уравнение реакций окисления 2-метилпропена и 2,3-диметилбутена-1 разбавленным водным раствором перманганата калия и концентрированным раствором перманганата калия. Назовите полученные продукты
27. Заполните схему превращений:
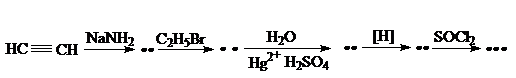
Приведите уравнения реакций.
28. Заполните схему превращений:
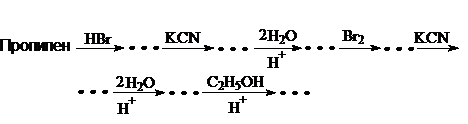
Приведите уравнения реакций. Назовите соединения.
29. Из каких бромпроизводных при действии спиртового раствора едкого кали можно получить 2,3-диметилбутен-2 и 2,.5.-диметилгексен-2.? Назовите эти олефины по рациональной номенклатуре.
30. Каково строение углеводорода С8Н8, обесцвечивающего бромную воду, легко полимеризующегося и образующего при окислении бензойную кислоту? Получите этот углеводород из бензола. Укажите его техническое применение.
31. Назовите соединение и проведите с ним реакции: 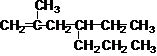
гидратации, гидрирования , бромирования, гидрохлорирования
32. Получите пентен-I и проведите реакцию с СI2, полученное соединение обработайте спиртовым раствором едкого кали. Напишите уравнения реакций.
33. Какие соединения образуются при каталитическом гидрировании
пропилена, бутилена и изопрена? Напишите уравнения реакций.
34. Дегидратацией каких спиртов можно получить 2-метилбутен-2 и
4-метилпентен-1? Назовите эти алкены по рациональной номенклатуре.
35. Напишите уравнения реакций электрофильного присоединения к изобутилену следующих реагентов: а) НI , б) Н2SО4 , в) Н2О. Назовите электрофильные и нуклеофильные частицы, образующиеся при распаде молекул этих реагентов.
36. Напилите уравнения реакций электрофильного присоединения к изобутилену следующих реагентов: а) Н2О, б) НОС1, в) НNO3. Назовите электрофильные и нуклеофильные частицы, образующиеся при распаде молекул этих реагентов.
37. Подействуйте на 2-метилбутен-1 бромистым водородом и затем металлическим натрием. Напишите уравнения реакций, назовите соединения.
38. При окислении в жестких условиях углеводорода С7Н14 образовалась уксусная кислота (СН3СООН) и изовалериансвая кислота (СН3)2СНСН2СООН. Какова формула исходного олефина? Назовите его.
39. Установите формулу олефина, зная, что при его окислении образовалась пропионовая кислота (СН3СН2СООН) двуокись углерода и вода.
40. Вещество состава С6Н13I было обработано спиртовым раствором едкого кали. Полученный продукт подвергнут озонолизу, в результате чего образовалась смесь уксусного и изомасляного (СН3)2СНСНО альдегидов. Какова структура исходного иодистого алкила?
41. Из ацетилена получите диэтилкетон и уксусный альдегид. Напишите уравнения реакций. Разберите механизм реакции Кучерова.
42. Углеводород С6Н10 присоединяет 2 молекулы брома, с аммиачным раствором полухлористой меди дает осадок; при окислении образует изопропилуксусную и угольную кислоты. Напишите формулу углеводорода и уравнения указанных реакций.
43. Напишите структурную формулу соединения состава С5Н12, если известно, что при его бромировании образуется преимущественно третичное бромпроизводное, а при нитровании (по Коновалову) − третичное нитросоединение. Разберите механизм первой реакции.
44. Какое соединение образуется в результате следующих превращений:
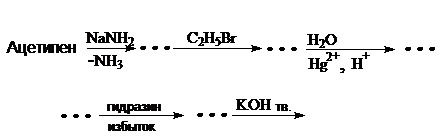
Напишите уравнения реакций. Назовите соединения.
45. С помощью каких реакций можно получить из бензола стирол? Разберите механизм реакции электрофильного замещения в ароматическом ряду. Какое применение находит стирол в промышленности?
46. Напишите уравнения реакций получения ароматических углеводородов: а) из бензола и хлористого ацетила; б) из толуола и пропионового ангидрида. Разберите механизм SE-реакций.
47. Приведите уравнения реакций гидрирования, бромирования, гидробромирования и гидратации стирола. Объясните механизм присоединения брома к винильной группе стирола.
48. Объясните правило ориентации при электрофильном замещении в ароматическом ряду. Приведите примеры групп, ориентирующих в орто- и пара-положения. Покажите направление индуктивного и мезомерного эффектов для этих заместителей.
49. Приведите примеры групп, ориентирующих электрофильную атаку в мета-положение ароматического кольца. Покажите направление индуктивного и мезомерного эффектов.
50. Из бензола получите бензойную кислоту. Объясните, почему бензойная кислота является более сильной, чем уксусная.
51. Как влияет отрицательный индуктивный эффект атома хлора на протекание реакций электрофильного замещения хлорбензола? Напишите уравнения реакций SE и разберите механизм.
52. Приведите уравнения реакций получения фенола из бензола. Как ароматическое кольцо влияет на кислотные свойства фенола? Обоснуйте этот факт.
53. Приведите способы получения бензойного альдегида из бензола. Ориентантом какого рода является альдегидная группа? Что образует этот альдегид в присутствии 50 %-ного раствора щелочи (реакция Канниццаро)?
54. Напишите уравнения реакций сульфирования бензола и этилбензола. Поскольку сульфирование является обратимой реакций, объясните, в каких условиях ее осуществляют. Разберите механизм.
55. Из бензола получите о-, м- и п-хлорбензойные кислоты. Как влияет введение атома хлора на силу кислоты (сравните с бензойной кислотой)?
56. Из соответствующих галогенпроизводных углеводородов получите фенол и бензиловй спирт. Напишите уравнения и приведите механизм обеих реакций.
57. Как получить бензол: а) из циклогексана; б) из бензойной кислоты; в) из бензосульфокислоты; г) из фенола? Напишите уравнения реакций. Укажите промышленные способы получения бензола и толуола.
58. Напишите структурную формулу вещества состава С5Н11Br, которое при гидролизе дает третичный спирт, а при дегидробромировании − триметилэтилен. Напишите эти реакции. Поясните механизм первой реакции.
59. Установите строение соединения, которое после обработки цинковой пылью превращено в вещество, обесцвечивающее бромную воду и образующее при окислении в жестких условиях ацетон. Напишите эти реакции и объясните механизм второй реакции.
60. Приведите схему распределения электронной плотности в хлорбензо- ле. Почему введение галогена уменьшает подвижность атома водорода в бензольном ядре?
61. Определите строение соединения С5Н11Br, при реакции которого с водным раствором NaOH получается первичный спирт, а при нагревании со спиртовым раствором NaOH и последующем действии бромоводорода получается 2-бром-2-метилбутан. Каковы механизмы этих реакций? Назовите С5Н11Br.
62. 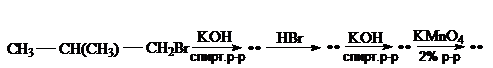 Заполните схему превращений:
Заполните схему превращений:
Приведите уравнения реакций. Каков механизм первых двух реакций? Назовите соединения.
63. Заполните схему превращений:
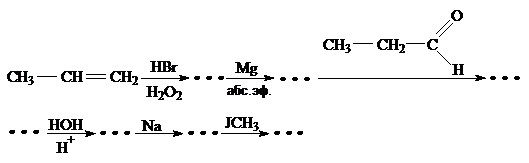
Приведите уравнения реакций. Назовите соединения.
64. Заполните схему превращений:
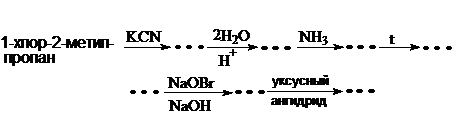
Приведите уравнения реакций. Назовите соединения.
65. Заполните схему превращений:

Приведите уравнения реакций. Назовите соединения.
66. Укажите реагенты и условия следующих превращений:

Приведите уравнения реакций. Назовите соединения.
67. Заполните схему превращений:
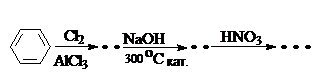
Приведите механизмы реакций первой и второй стадий.
68. Напишите строение соединений, образующихся на каждой стадии схемы:

Приведите механизм первой и второй стадий. Назовите соединения.
69. Назовите несколько способов получения хлористого винила. Разберите механизм радикальной полимеризации винилхлорида.
70. Напишите структурные формулы всех изомеров одновалентных
радикалов С3Н5- и С4Н7-. Назовите эти радикалы.
71. Напишите структурные формулы следующих соединений и реакции гидролиза с ними: 1) 3-метилпентен-1; 2) 4-метилпентен-1;
3) 2,6-диметилгептен-3.
72. Перечислите способы получения этилена и пропилена. Какие из них являются промышленными? Объясните, почему одни способы применимы в промышленности, а другие − только в лаборатории?
73. Дегидратацией каких спиртов можно получить 2-метилбутен-2
и 4-метилпентен-1?
Назовите эти алкены по рациональной номенклатуре.
74. Напишите уравнения последовательных реакций получения мета-нитрофенола из бензола (через м-динитробензол).
75. Получите метилциклопропан методом дегалогенирования соответствующего дигалогенпроизводного.
76. Каково строение углеводорода С8Н8, обесцвечивающего бромную воду, легко полимеризующегося и образующего при окислении бензойную кислоту? Получите этот углеводород из бензола. Укажите его техническое применение.
77. Приведите уравнения реакций получения гомологов из бензола: толуола, о-изопропилтолуола.
78. Классификация, изомерия и номенклатура галогенпроизводных. Получите изопропилбензол и подействуйте на него спиртовым раствором щелочи.
79. Стирол (фенилэтилен) – продукт многотоннажного промышленного производства. Опишите его свойства. Напишите для него уравнения реакций: а) с хлористым водородом; б) с хлором; в) исчерпывающего гидрирования; г) полимеризации.
80. Напишите уравнения реакций электрофильного присоединения к изобутилену следующих реагентов: а) НI , б) Н2SО4 , в) Н2О. Назовите электрофильные и нуклеофильные частицы, образующиеся при распаде молекул этих реагентов.
81. Напишите уравнения реакций электрофильного присоединения к пропену
следующих реагентов: а) Н2О, б) НОС1, в) НОВг. Назовите электрофильные и
нуклеофильные частицы, образующиеся при распаде молекул этих реагентов.
82. Подействуйте на 2-метилбутен-1 бромистым водородом и затем металличес-
ким натрием. Напишите уравнение реакций.
83. Как протекает реакция присоединения 1 моль брома к 1,3-бутадиену?
Разберите механизм ионного присоединения к диену.
84. Какие продукты образуются в результате взаимодействия 2 моль изопрена между собой? Разберите радикальный механизм этой реакции.
85. Предложите способ получения гексаметилендиамина из бутадиена-1,3. Где в промышленности используют гексаметилендиамин?
86. Какие вещества получатся при взаимодействии трет-бутилетилена со сле -
дующими реагентами: а) НОС1, б) Н2SО4 , в) щелочной раствор КМпО4 на холо-
ду?
87. Приведите уравнения реакций образования ароматических углеводородов. Что такое "ароматизация" нефти?
88. Какие соединения называют ароматическими? Каковы природные источники ароматических соединений? Что такое "ароматизация" нефти, "каталитический риформинг"? Приведите уравнения реакций.
89. Приведите уравнения реакций получения гомологов бензола (толуола, изопропилбензола). Разберите механизм реакции Фриделя-Крафтса.
90. Напишите уравнения реакций бензола, протекающие по механизму электрофильного замещения. Разберите механизм. Как было доказано образование s-комплекса?
Контрольная работа № 2
1. Из бензола получите о-, м- и п-хлорбензойные кислоты. Как влияет введение атома хлора на силу кислоты (сравните с бензойной)?
2. Из соответствующих галогенпроизводных углеводородов получите фенол и бензиловй спирт. Напишите уравнения и приведите названия соединений.
3. Классификация, изомерия и номенклатура галогенпроизводных. Напишите изомеры состава С6 Н4 С12 , назовите их.
4. Общие способы получения галогенпроизводных: галогенирование углеводородов, замещение гидроксила на галоген, присоединение галогенов и галогенводородов по кратным связям. Получите дихлорэтан всеми возможными способами.
5. Химические свойства моногалогенпроизводных алканов: замещение галогена на водород, гидроксил, амино- и нитрильную группы. Отщепление галогеноводорода. Реакция Вюрца. Получите 2,3-диметилбутан из соответствующего галогенпроизводного по реакции Вюрца.
6. Химические особенности галогенпроизводных с несколькими атомами галогена у одного углеродного атома. Напишите реакцию взаимодействия 1,2,3-трихлопропана со щелочью (водный раствор).
7. Для 2-хлорпропана напишите реакции нуклеофильного замещения со следующими реагентами: а) натриевая соль муравьиной кислоты; б) этиламин; в) нитрит натрия. Какие реагенты называются нуклеофильными?
8. Химические свойства галогенпроизводных непредельных углеводородов. Хлористый винил, его полимеризация и значение. Напишите уравнение реакции присоединения НВг к винилбромиду.
9. Объясните причину низкой реакционной способности атома галогена в бензольном ядре по сравнению с атомом галогена в боковой цепи. Сравните свойства хлорбензола и хористого бензила.
10. Напишите изомеры состава С4 Н7 Cl. Какой изомер более реакционно- способен в реакции замещения? Осуществите для него все известные вам реакции замещения.
11. Предельные одноатомные спирты. Гомологический ряд, изомерия и номенклатура. Напишите изомеры спирта С4 Н9 ОН и укажите первичные, вторичные и третичные спирты.
12. Способы получения спиртов из предельных и этиленовых углеводородов, галогенпроизводных, сложных эфиров, карбонильных соединений. Получите этанол всеми указанными выше методами.
13. Химические свойства одноатомных спиртов: реакции с металлами, галогенными соединениями фосфора, спиртами и кислотами. Напишите уравнение реакций пропанол-2 с уксусной кислотой.
14. Окисление первичных, вторичных и третичных спиртов. Дегидратация и дегидрирование. Напишите реакции окисления бутанол-1 и
бутанол-2, назовите продукты реакции.
15. Двухатомные спирты (гликоли). Изомерия и номенклатура. Получение из галогенпроизводных и непредельных углеводородов. Получите этиленгликоль указанными выше способами.
16. В чем заключается основное различие химических свойств одноатомных и многоатомных спиртов? Напишите соответствующие уравнения реакций. Как можно, исходя из пропилена, получить глицерин?
17. Напишите уравнение реакций взаимодействия 3-метилбутанола с PCl5 , с уксусной кислотой, бромистым водородом, хлорангидридом уксусной кислоты. К какому типу реакций принадлежат данные превращения?
18. Фенолы. Строение, номеклатура и изомерия. Напишите изомеры вещества, имеющего состав С7 Н8 О, назовите их и укажите, к какому классу соединений они принадлежат.
19. Природные источники и способы получения фенолов из аминов, галогенпроизводных и углеводородов. Предложите схему получения фенола из бензола.
20. Химические свойства фенолов. Взаимное влияние радикала и функциональной группы. Отличие фенолов от спиртов. Покажите это на примере бензилового спирта и фенола.
21. Номенклатура и изомерия альдегидов и кетонов. Напишите формулы всех изомерных альдегидов и кетонов состава С6 Н10 О, назовите их.
22. Способы получения альдегидов и кетонов. Напишите уравнения реакций получении пропионового альдегида и ацетона всеми известными методами.
23. Химические свойства альдегидов. Ответ проиллюстрируйте на примере уксусного альдегида и бензальдегида.
24. Опишите свойства кетонов. Получите из метилэтилкетона: а) бутан; б) бутанол-2; в) гидразон.
25. Приведите примеры реакций с участием α-водородного атома для альдегидов и кетонов. Напишите уравнение альдольной конденсации для пропионового альдегида и диэтилкетона.
26. Получите ацетон окислением соответствующего спирта. Напишите для него уравнения реакций с гидразином, цианистым водородом, хлором, пятихлористым фосфором.
27. Ароматические альдегиды и кетоны, получение, свойства. Напишите уравнения реакций окисления бензойного альдегида и взаимодействия его с анилином.
28. Какие карбонильные соединения можно получить при каталитической гидратации: а) ацетилена, б) метилпропилацетилена, в) диэтилацетилена ? Напишите уравнения реакций.
29. Напишите уравнения реакций гидролиза следующих ароматических дигалогенпроизводных: а) хлористый бензилиден, б) 2,2-дихлор-1-фенилбутан. Назовите полученные соединения.
30. Напишите структурную формулу соединения состава С8Н8О, если известно, что оно дает реакцию серебряного зеркала, а при окислении хромовой смесью − бензойную кислоту.
31. Электронное строение карбоксильной группы. Мезомерия аниона. Водородная связь в кислотах. Свойства муравьиной кислоты. Напишите уравнения диссоциации муравьиной, щавелевой и акриловой кислот.
32. Бензойная кислота, свойства, получение. Напишите уравнения реакций взаимодействия бензойной кислоты с аммиаком на холоду и при нагревании с РС15, пропиловым спиртом. Продукты реакции назовите.
33. Производные карбоновых кислот: соли, галогенангидриды, ангидриды, амиды. Напишите уравнения реакций взаимодействия уксусной кислоты с Na2 СО3 , РС15 . Продукты реакции назовите.
34. Сложные эфиры, их получение из кислот (этерификация), ангидридов и хлорангидридов. Физические и химические свойства. Напишите уравнения реакций взаимодействия уксусного ангидрида с этиловым спиртом. Продукт реакции подвергните щелочному омылению.
35. Фталевые кислоты. Терефталевая кислота и синтетическое волокно на ее основе (лавсан). Напишите уравнения реакции образования кислого сложного эфира из изофталевой кислоты и метанола.
36. Непредельные кислоты: акриловая кислота, ее эфиры, нитрил. Метакриловая кислота. Пластмассы на их основе. Получите акриловую кислоту из уксусного альдегида, метакриловую из ацетона. Превратите их в метиловые эфиры и напишите реакции полимеризации последних.
37. Фумаровая и малеиновые кислоты. Различие свойств геометрических изомеров. Получите из ацетилена малеиновую кислоту. Проведите реакции с Вr2 , НВr, Н2О.
38. Олеиновая, линолевая и линоленовая кислоты. Коричные кислоты. Напишите уравнение реакции взаимодействия олеиновой кислоты с Вr2 и глицерином.
39. Жиры. Распространение в природе, состав, строение. Классификация жиров. Химические свойства: омыление, гидрогенизация. Напишите уравнение реакции образования глицерида тристеарина.
40. Напишите реакции омыления и гидрогенизации триолеата глицерида. Укажите условия протекания указанных реакций.
41. Приведите пример различных органических соединений серы: тиолы, тиоэфиры, дисульфиды, тиокетоны, сульфоксиды, сульфокислоты.
42. Сравните физические свойства спиртов и меркаптанов (температура кипения, растворимость в воде). Как объяснить наблюдаемые различия? Напишите уравнение реакции получения бутилмеркаптида калия. Применение этого соединения.
43. Напишите уравнения реакций получения трет.-бутантиола (трет-бутилмеркаптана), исходя из соответствующего алкилгалогенида или алкена.
44. Сравните отношение к окислителям тиолов RSН и спиртов ROH .Что получится при окислении С2Н5SH и С2Н5ОН?
45. Какие веществе получатся при энергичном окислении: а) бутантиола, б) ди- бутилсульфида?
46. К какому типу реакций относится реакция сульфохлорирования алканов? Напишите ее механизм на примере сульфохлорирования утлеводорода С8Н18. Какова формула соответствующего сульфоната натрия. Напишите уравнение реакции его получения.
47. Какие моносульфокислоты могут образоваться при сульфировании: а) бромбензола, б) нитробензола, в) бензойной кислоты?
48. .Какие моносульфокислоты предпочтительно образуются при сульфировании
а) п-нитротолуола, б) м-дихлорбензола, в) n-крезола?
49. Какое строение имеет вещество состава С8
