Важнейшие минералы морских эвапоритов
| Класс | Состояние | Минералы | Кристаллическая формула |
| Сульфаты | Безводные | Ангидрит | CaSO4 |
| Барит | BaSO4 | ||
| Целестин | SrSO4 | ||
| Водные | Кизерит | MgSO4 . 2H2O | |
| Гипс | CaSO4 . 2H2O | ||
| Полигалит | Ca2K2MgSO4 . 4H2O | ||
| Астраханит | Na2MgSO4 . 4H2O | ||
| Гексагидрит | MgSO4 . 6H2O | ||
| Эпсомит | MgSO4 . 7H2O | ||
| Каинит | K4Mg4[ClSO4] . 11H2O | ||
| Галоиды | Безводные | Галит | NaCl |
| Сильвин | KCl | ||
| Флюорит | CaF2 | ||
| Водные | Бишофит | MgCl2 . 6H2O | |
| Карналит | KCl ∙ MgO2 . 6H2O |
На континентах важнейшими системами галогенеза были соленосные озера, в меньшей мере – солонцы и солончаки. Соленые озера делятся на содовые, сульфатные и хлоридные.
В содовом или карбонатном типе озер главные компоненты – CO32–, (HCO3)–, SO42–, Na+, K+, Ca2+, Mg2+.
Сульфатный тип озер представлен SO42–, Cl–, Na+, (K +), Mg2+, встречаются ионы CO32–, (HCO3)–. Среди сульфатных рассолов выделяются два подтипа: сульфатно-натриевый и сульфатно-магниевый.
Главные компоненты хлоридного типа озер – Cl–, Na+, (K +), Mg2+, Ca2+, реже встречаются CO32–, (HCO3)–, SO42–.
Последовательность фиксации отдельных элементов при образовании солей может быть представлена следующим рядом (слева направо):
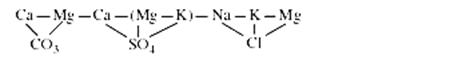
Для каждого из них характерна своя парагенетическая ассоциация макро- и микроэлементов. Вначале осаждаются менее растворимые, затем более растворимые соли (рис. 20).
Калийные соли выпадают в конце процесса В ходе галогенеза некоторые редкие элементы замещают главные в соляных минералах на основе законов изоморфизма (Br– → Cl–; Rb+ → K+).
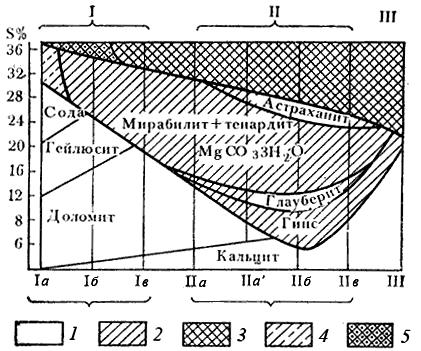
Рис. 20. Общая схема галогенеза в современных озерах
засушливой зоны (по Н. М. Страхову)
I – содовые озера (а – сильно содовые – Kc > 30 %, б – умеренно содовые – Kc 30 –3 %, в – слабо содовые – Kc <3 %), II – сульфатные озера (а – натриево-магниевые, б –натриево-магниево-кальциевые, в – магниево-кальциевые), III – хлоридные озера с NaCl, MgCl2 и CaCl2;1 – карбонатная стадия, 2 – сульфатная стадия, 3 – хлоридная стадия, 4 – сульфатные осадки, сильно загрязненные примесями соды, 5 – галит, сильно загрязненный примесями сульфатов натрия. Кс – процентное содержание Na2CO3 в солевой массе.
Тяжелые металлы, по И. Ф. Костенко, накапливаются в рассолах (Mo, W, Ag и др.). Галофобные элементы связаны главным образом с нерастворимым остатком и областью сноса. В наиболее концентрированных рассолах накапливаются B, Li, Rb, Cs, Br. В континентальных рифтах в зоне аридного климата разгрузка и испарение термальных вод в депрессиях рельефа приводят к образованию промышленных месторождений B, Li, W, соды (солончак Серлз в Калифорнии). В районах рудных месторождений на испарительном геохимическом барьере накапливаются Zn, Mo, U, Sr, Ba, Li и др. Особенности испарительных аномалий необходимо учитывать при геохимических методах поисков рудных месторождений.
Таким образом, химический состав осадочных пород варьирует больше, чем изверженных, так как они формируются в разнообразных условиях температуры, увлажнения, кислотно-щелочных и окислительно-восстановительных величин.
Геохимия атмосферы
На Земле газы образуют самостоятельную оболочку – атмосферу. В земной коре они встречаются в трех формах: свободной; растворимой в воде, расплавах и нефти; адсорбированной и окклюдированной горными породами. Общая масса газов оценивается величиной 8,38 · 1015 т, из них на массу атмосферы приходится 5,15 ∙ 1015 т. Относительно массы всей Земли газы составляют всего лишь 9 · 10–5 %.
Образование и классификация газов. А. И. Перельман (1989) выделил три основные группы процессов образования газов: физико-химическую, биогенную и техногенную.
Физико-химические процессы включают реакции, которые приводят к образованию CO2, H2S, водяного пара и других газов. Радиоактивный распад генерирует инертные газы, радиолиз воды создает химически активные H+ и ОН–, космические лучи приводят к образованию 14С, 3Н и других радиоактивных изотопов.
Биогенные процессы (фотосинтез, биохимический) участвуют в образовании O2, CO2, N2, H2S, CH4 и других газов.
С техногенными процессами связано поступление в атмосферу CO2, CO, оксидов азота, серы, органических летучих соединений (диоксин, бензапирен и др.).
В. В. Белоусов выделял в земной коре газы воздушного, биохимического, химического и радиоактивного происхождения. По этой классификации одни и те же газы могут быть разного происхождения. Например, СO2образуется в ходе химических реакций, под воздействием бактерий, в недрах Земли или техногенным путем.
Наиболее удачная классификация А. И. Перельмана, в которой каждый газ занимает свою нишу:
A. Активные газы.H2O2, NO
1. Неорганические газы:
· окислители (некоторые влияют на рН): O2, O3, NO2, I2, H2O2, NO
· восстановители (некоторые влияют на рН): H2, H2S, N2, NH3, N2O, CO, Hg, H2Se.
— полярные газы (влияют на рН, некоторые – на Eh): CO2, H2O, HCl, HF, SO2, SO3.
2. Органические газы:
· углеводороды и их производные: CH4, C2H6, C4H10, C2H4 .
В. Пасивные (инертные) газы: Ar, He, Ne, Kr, Xe, Rn.
Для магматических и гидротермальных систем необходима особая классификация, так как при высоких температурах увеличивается число газообразных соединений.
Атмосферные газы. Происхождение состава современной атмосферы связано в основном с биогенной миграцией. Тропосфера относится к биокосной системе, однако ведущую роль в ней играют физико-химические и механические процессы, связанные с круговоротом воды и движением воздушных масс.
Основу атмосферы составляют N2, O2, Ar, CO2 (99,99 % сухого воздуха). Незначительную примесь в атмосфере составляют углеводороды, озон, водород, инертные газы, пыль различного генезиса, аэроионы, органические летучие соединения (фитонциды, эфирные масла), микроорганизмы. Особое место в циркуляции атмосферы, изменении ее состава выполняет водяной пар.
Общая сумма растворенных веществ в атмосферных водах колеблется в пределах 12 – 550 мг/л. Наиболее минерализованы осадки в аридных зонах. Главные компоненты осадков (Na, Ca, Mg, HCO3, Cl, SO4) отличаются по содержанию в зависимости от физико-географических условий.
Состав атмосферных осадков определяют следующие факторы: первичный состав водяных паров, количество примесей в воздухе, количество и частота выпадаемых осадков (высота, направление ветра, погода, температура, форма воды – жидкая, твердая).
В стратосфере и мезосфере под воздействием фотолиза образуется озон (O2 + O → O3), который задерживает коротковолновую радиацию Солнца и создает возможность развития жизни на Земле. Общая масса озона невелика и при нормальном давлении (105 Па) составила бы слой мощностью 1,7 – 4,0 мм.
Газы земных недр. Химический состав газов земных недр связан с составом горных пород и термодинамическими условиями их нахождения. В. И. Вернадский отнес их к «подземной атмосфере» и разделил на газы, образование которых связано с высокой температурой, и газы, проникающие в земную кору из атмосферы и мантии. В магматических расплавах многие элементы и соединения переходят в газообразное состояние (летучие компоненты). Через вулканизм происходит дегазация недр.
По оценке В. А. Соколова, общая масса газов осадочных пород 2,1 · 1014 т, что примерно на порядок меньше, чем масса атмосферы. Основная масса газов сосредоточена в мантии. Содержание газов можно выразить следующим соотношением: атмосфера : литосфера и гидросфера : верхняя мантия как 1:2: 80.
Основные газы осадочных пород: CH4 – 39 %, CO2 – 27,4, N2 – 26, тяжелые углеводороды – 6,4, H2 – 0,2, H2S + SO2 – 0,3 %. В кислой магме гранитного слоя преобладает СO2 – 83,8 %, далее следуют N2 – 11, H2 – 3, H2S + SO2 – 2, CH4 – 0,2%.
С повышением температуры растворимость большинства газов понижается, с увеличением давления – растет. На глубинах, начиная с 2 – 3 км ведущим фактором при растворении газов выступает давление. Если в поверхностных водах растворяется примерно 13 см3/л N2 и 3 см3/л О2, то в подземных водах на глубине 1–4 км содержится около 500 см3/л газов, достигая величин 1000 – 1500 см3/л за счет СН4. Углеводороды лучше растворяются в нефти. В подземных водах формируются залежи нефтяных газов, поэтому они часто выполняют роль геохимического барьера.
При растворении в газах жидких и твердых веществ образуются газовые растворы при условии высокого давления, когда плотность газов сравнима с плотностью жидкости. В сжатых газах механизм растворения практически не отличается от растворения в жидкости, т. е. происходит взаимодействие с молекулами растворителя. В углеводородных газах растворяется нефть и формируются газоконденсатные залежи. При выходе этого газа на поверхность из него выделяются жидкие углеводороды.
Водяной пар в недрах Земли хорошо растворяет соединения Zn, W, Cu, Mo и других рудных элементов.
Газы, содержащиеся в закрытых порах и кристаллической решетке минералов, называются окклюдированными. Кроме того, горные породы содержат сорбированный газ. Его количество может колебаться от десятых долей до нескольких кубических сантиметров на 1 кг осадочных пород (CO2, N2, CH4). Максимальной сорбционной емкостью обладают каменные угли (n ∙ 103 – n ∙ 104 см3/кг). Другие осадочные породы сорбируют не более 600 см3/кг газов, глины удерживают больше, чем пески и известняки. Органическое вещество увеличивает сорбционную емкость осадочных пород. Более низкая емкость изверженных и метаморфических пород. Сорбция газов растет с увеличением их молекулярной массы: C3H8 сорбирует в 10 раз больше, чем CH4. С ростом температуры сорбция уменьшается, однако на глубинах существенно влияние давления, поэтому с глубиной ее интенсивность увеличивается. В ходе геологического времени миграция газов изменялась. В эпохи прогибания осадочных толщ в геосинклинальных зонах, передовых прогибах, синеклизах платформ в связи с ростом давления свободные газы растворялись в воде и нефти. В подземных водах возрастала роль диффузии и уменьшалась роль фильтрации. Развивались термокаталитические процессы, формировавшие жидкие и газообразные углеводороды.
В эпохи поднятий в складчатых областях с ростом трещиноватости и тектонических подвижек, с формированием и подновлением разломов резко возрастало значение фильтрации газов. Усиливалось выделение свободных газов из подземных вод и нефти, а жидких и твердых веществ – из газовых растворов. С рифтогенезом связана миграция газов к земной поверхности.
Газы используются как индикаторы месторождений полезных ископаемых, поэтому разработаны атмогеохимические методы поисков газов и некоторых металлов. Таким образом, изучение геохимии газов дает возможность решать теоретические и прикладные аспекты возникающих проблем.
Геохимия биосферы
Живые организмы в системе сфер Земли образуют биосферу. Это понятие было введено французским натуралистом Ж. Б. Ламарком (1744–1829) для обозначения мира живых организмов Земли. Геологическое определение термина биосферы как оболочки Земли было дано Э. Зюссом (1875). Учение о биосфере разработал В. И. Вернадский: это пространство, где присутствуют живые организмы от единичных бактерий до мощных экваториальных лесов с его обитателями. Совокупность организмов, выраженная в единицах массы и энергии, В. И. Вернадский назвал живым веществом. Основу живого вещества составляет углерод, обладающий способностью давать бесконечное множество разнообразных химических соединений. Вместе с ним О, N, H образуют основные органические соединения: белки, жиры, углеводы. Если углеводы разных растений имеют одинаковый химический состав, то белки разных организмов никогда не бывают одинакового состава даже у представителей одного и того же вида. Эта специфичность белков определяется тем, что их строение зависит от наследственных свойств клеток организма. Лишь у близнецов состав и строение белковых молекул одинаковы.
В состав живых организмов входят все природные химические элементы. Их делят на структурные (C, H, O, N, P, S, Cl, Na, K, F, Mg, Si, Ca) и биокатализаторы (Fe, Cu, B, Mn, Zn, I, Mo, Co и др.). Несмотря на организационную роль углерода (18 %), живое вещество кислородное (70 %). Роль углерода велика в химических реакциях. Некоторые элементы менее исследованы и их роль в живых организмах не определена.
Живое вещество состоит из преобладающей фитомассы, меньше зоомасса и еще меньше масса микроорганизмов. Зоомасса суши составляет 2–10 % от фитомассы, а фитомасса океана – 1,7 ∙ 108 т (0,007 % от всей фитомассы), зоомасса и микробиомасса – 3,3 ∙109 т. По количеству живого вещества на 1 га океан близок к пустыням, за исключением зон концентрации коралловых рифов, Саргассова моря и зон апвелинга – подъема поверхностных глубинных вод, богатых биоэлементами.
По образному выражению В. М. Гольдшмидта, если литосферу по массе представить в виде каменной чаши в 13 фунтов, то масса современной гидросферы составит один фунт, атмосферы – вес медной монеты, живого вещества – вес почтовой марки. Однако благодаря ежегодному приросту и отмиранию живое вещество в геохимическом отношении за геологическое время является ведущей силой в концентрации, круговороте и миграции химических элементов.
Кларки живого вещества впервые привел В. И. Вернадский, затем уточнил А. П. Виноградов и дополнил В. В. Добровольский и др.
Обнаружены в организмах без учета точной количественной величины: He, Ne, Ar, Sc, Kr, Nb, Rh, Pd, In, Te, Xe, Ta, Tl, Bi, Th. Не обнаружены в организмах Ru, Hf, Re, Os, Ir, Po, Ac и в земной коре Tc, At, Fr.
Живое вещество состоит в основном из химических элементов, подвижных в земной коре и почвах. Их кларки уменьшаются с ростом атомной массы, хотя и не отмечено прямой зависимости.
Согласно В. И. Вернадскому, главной особенностью истории живого вещества является образование из газов и превращение после отмирания снова в газы (CO2, NH3, N2, H2O– водяной пар). Слабоподвижные элементы в земной коре поступают в организм в незначительном количестве. Например, кларк алюминия в литосфере 8 %, а в живом веществе он присутствует в микроколичестве (5 ∙10–3 %).
Для оценки концентрации элементов в живом веществе А. И. Перельман рекомендует использовать коэффициент биофильности. Это отношение кларка элемента в живом веществе к его кларку в земной коре. Наиболее биофильны С (780), N (160), H(70), O (1,5) и Cl (1,1). Остальные элементы имеют биофильность менее единицы. Очень низкая биофильность Fe, Al, Ti.
Растительные организмы в зависимости от семейства и вида концентрируют отдельные химические элементы. Количественно это можно выразить через коэффициент биологического поглощения (Ах), который представляет собой отношение содержания элемента в золе к его содержанию в почве (породе). Такие расчеты впервые осуществил Б.Б. Полынов, которые дополнил А.И. Перельман.
Эти средние данные для растений будут отличаться для отдельных видов растений. Например, картофель концентрирует калий, лютик едкий – литий и т.д. Элементы с Ах более единицы относятся к элементам накопления. Микрофлора некоторых рудных месторождений обогащается Cu, Zn, Pb. На этом основан биогеохимический метод поисков месторождений ряда элементов.
В процессе роста и развития живых организмов некоторые элементы концентрируются в телах в виде минералов, которые называют биолитами. Таким путем образуется опал диатомовых водорослей, кальцит и арагонит в раковинах, оксалаты и фосфаты в почках и т. д. В больших количествах они дают начало известнякам, доломитам и другим породам биогенного происхождения.
С разложением органических веществ в почве связаны биогеохимические функции живого вещества: углекислотная, углеводородная, сероводородная, азотная, окислительная, восстановительная. Основная роль в выполнении этих функция принадлежит микроорганизмам.
Среди органических соединений в осадочных породах насчитывается более 500 видов. Согласно А. Б. Ронову, рассеянное органическое вещество в 200 раз превышает запасы горючих ископаемых. При миграции по порам органическое вещество концентрируется как месторождение. Чем длительнее срок концентрации нефти и газа, тем крупнее месторождение.
Суммарный эффект живого вещества за геологическую историю привел к формированию биогенных (каустобиолитов) и металлических месторождений полезных ископаемых.
ЛИТЕРАТУРА
Основная
Алексеенко, В. А. Геохимические методы поисков месторождений полезных ископаемых: учебник / В. А. Алексеенко. 2-е изд., переработ. и доп. М.: Высшая школа, 2000.
Барабанов, В. Ф. Геохимия / В. Ф. Барабанов. М.: Недра, 1985.
Бордон, В. Е. Геохимия и металлоносность осадочного чехла Белоруссии / В. Е. Бордон. Мн.: Наука и техника, 1989.
Бордон, В. Е. Петрология и геохимия кристаллических пород докембрия Беларуси / В. Е. Бордон, Е. Т. Ольховик. Мн.: Наука и техника, 1977.
Войткевич, Г. В. Краткий справочник по геохимии / Г. В. Войткевич [и др.]. М.: Недра, 1974.
Жариков, В. А. Основы физической геохимии: учебник / В. А. Жариков. 2-е изд., испр. и доп. М.: Изд-во Моск. ун-та, 2005.
Иванов, В. В. Экологическая геохимия элементов: Справочник в 6 кн. / В. В. Иванов. М.: Недра. Кн. 1–6, 1994–1997.
Интерпретация геохимических данных: учеб. пособие / под ред. Е. В. Склярова. М.: Интернет Инжиниринг, 2001.
Овчинников, Л. Н. Прикладная геохимия / Л. Н. Овчинников. М.: Недра, 1990.
34.Соловов, А. П. Геохимические методы поисков месторождений полезных ископаемых: учебник / А. П. Соловов. М.: Недра, 1985.
Перельман, А. И. Геохимия: учебник / А. И. Перельман. М.: Высшая школа, 1989.
Дополнительная
Белыбердин, В. Тайны зарождения Вселенной / В. Белыбердин. М.: Рипол Классик, 2002.
Бордон, В. Е. Геохимическая зональность платформенного чехла Беларуси / В. Е. Бордон, Л. И. Матрунчик. Минск: Наука и техника, 1990.
Борисов, М. В. Термодинамика геохимических процессов / М. В. Борисов, Ю. В. Шваров. М.: Изд-во МГУ, 1992.
Вернадский, В. И. Труды по геохимии / В. И. Вернадский. М.: Наука, 1994.Геология Беларуси / А.С. Махнач, Р.Г. Гарецкий, А.В. Матвеев и др. Минск: Ин–т геол. наук НАН Беларуси, 2001.
Геншафт, Ю. С.Г Геохимия глубинного вещества Земли / Ю.С.Геншафт и др. М.: Наука, 1989.
Голубев В. С. Динамика геохимических процессов / В. С. Голубев. М.:Недра, 1981.
Горбунов, Н. И. Минералогия и коллоидная химия почв / Н. И. Горбунов. М.: Наука, 1974.
Дуденко, Л. Н. Геохимические структуры эндогенных систем / Л. Н. Дуденко. Л.: Недра, Ленингр. отдел., 1981.
Жуховицкая, А. А. Геохимия озер Белоруссии / А. А. Жуховицкая, В. А. Генералова. Минск: Наука и техника, 1991.
Загрузина, И. А. Практическая геохронометрия / И. А. Загрузина. М.: Наука, 1991.
Короновский, А. В. Общая геология: учебник / А. В. Короновский. М.: Изд-во Моск. ун-та, 2002.
Кузнецов, В. А. Геохимия речных долин / В. А. Кузнецов. Минск: Наука и техника, 1986.
Кусков, О. Л. Термодинамика и геохимия ядра и мантии Земли /О. Л. Кусков, Н. И. Хитаров. М.: Наука, 1982.
Лукашев, К. И. Геохимия ландшафтов / К. И. Лукашев, В. К. Лукашев. Мн.: Вышэйшая школа, 1970.
Максимов, Е. М. Ритмы на Земле и в космосе / Е. М. Максимов. СПб.: Изд-во С.–Петерб. ун-та, 1995.
Минеев, Д. А. Геохимия и минералогия редких элементов: учеб. пособие / Д. А. Минеев. М., 1982.
Левых, Н. Н.. Коры выветривания запада Восточно-Европейской платформы / Н. Н. Левых. Минск, 1999.
Озима, М. Геохимия благородных газов / М. Озима, Ф. Подосек; пер. с англ. – М.: Недра, 1987.
Питулько, В. М. Основы интерпретации поисковой геохимии / В. М. Питулько, И. Н. Крицук. Л.: Недра. Ленингр. отдел., 1990.
Покровский, Б. Г. Коровая контаминация мантийных магм по данным изотопной геохимии // Труды ГИН РАН. Вып. 535/ отв. ред. В. И. Виноградов. М.: Наука, 2000.
Полезные ископаемые Беларуси / редкол.: П. З. Хомич[и др.]. Минск: Адукацыя i выхаванне, 2002.
Ронов, А. Б. Химическое строение земной коры и геохимический баланс главных элементов / А. Б. Ронов, А. А. Ярошевский, А. А. Мигдисов. М.: Наука, 1990.
Семененко, Н. П. Геохимия сфер Земли / Н. П. Семененко. Киев: Наукова думка, 1987.
Справочник по геохимическим поискам полезных ископаемых / А. П. Соловов [и др.]. М.: Недра, 1990.
Титаева, Н. А. Ядерная геохимия / Н. А. Титаева. М.: Изд. МГУ, 1992.
Требования к геохимическим работам при ГСР-50 с общими поисками. М.: ИМГРЭ, 1990.
Ферсман, А. Е. Избранные труды. Т.5. Геохимия / А. Е. Ферсман. М.: Изд. АН СССР, 1959.
Фор, Г. Основы изотопной геологии / Г. Фор. М.: Мир, 1989.
Хаин, В. Е. Основные проблемы современной геологии / В. Е. Хаин. М.: Наука, 1994.
Халезов, Ю. В. Планеты и эволюция звезд. Новая гипотеза происхождения Солнечной системы / Ю. В. Халезов. М.: Едиториал УРСС, 2004.
Чартко, М. К. Асновы геахiмii: метад. указаннi / М. К. Чартко. Минск.: БДУ, 2001.
Чертко, Н. К. Геохимия и экология химических элементов: справ. пособие / Н. К. Чертко, Э. Н. Чертко. Минск: Изд. центр БГУ, 2008.
Щербина, В. В. Основы геохимии / В. В. Щербина. М.: Недра, 1972.
Экологическая функция литосферы. Гл. 5 / под ред. В. Т. Трофимова. – М.: Изд. Моск. ун-та, 2000.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ. 3
1. ПРОИСХОЖДЕНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
1.1. Эволюция звезд.
1.2. Происхождение химических элементов.
2. ХИМИЧЕСКИЙ СОСТАВ ВСЕЛЕННОЙ. 20
2.1. Химический состав космических тел. 20
2.2. Планетысолнечнойсистемы. 22
3. ХИМИЧЕСКИЙ СОСТАВ ЗЕМЛИ И ЕЕ ОБОЛОЧЕК. 26
3.1. Строение и состав Земли. 26
3.2. Первичная дифференциация элементов. 30
4. ИЗОТОПНАЯ ГЕОХИМИЯ. 32
4.1.Закономерности изменения и распространения изотопов. 32
4.2. Геохимия некоторых изотопов и их использование в геологии. 34
5. ВНУТРЕННИЕ ФАКТОРЫ МИГРАЦИИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ. 38
5.1. Физико-химические свойства химических элементов. 39
5.2. Связь кларка с геохимическим поведением элементов. 52
6. ВНЕШНИЕ ФАКТОРЫ МИГРАЦИИ И РОЛЬ ГЕОХИМИЧЕСКИХ ПРОЦЕССОВ В
В МИГРАЦИИ ЭЛЕМЕНТОВ. 57
6.1. Внешние факторы миграции. 57
6.2. Термодинамика физико-химической миграции. 58
6.3. Геохимические процессы. 66
6.3.1. Щелочно-кислотные и окислительно-восстановительные условия. 66
6.3.2. Роль геохимических процессов в концентрировании химических элементов. 72
6.3.3. Геохимические барьеры.. 86
6.3.4. Кинетика и динамика физико-химической миграции. 87
7. ГЕОХИМИЧЕСКАЯ КЛАССИФИКАЦИЯ ЭЛЕМЕНТОВ. 89
8. ГЕОХИМИЯ МАГМАТИЧЕСКИХ ПРОЦЕССОВ. 93
8.1. Свойства и состав магмы. 97
8.2. Свойства и состав магматических пород. 99
8.3. Процессы магматического минералообразования. 105
8.4. Геохимия постмагматического процесса. 106
8.4.1. Вулканические возгоны.. 109
8.4.2. Пегматитовый процесс. 109
8.4.3. Пневматолитово-гидротермальные процессы.. 112
8.4.4. Контактно-метасоматические процессы.. 114
8.4.5. Гидротермальные процессы.. 118
9. ГЕОХИМИЯ МЕТАМОРФИЧЕСКИХ ПРОЦЕССОВ. 127
9.1. Метаморфические процессы. 128
9.2. Химический состав метаморфических пород. 131
9.3. Метаморфизм минералов. 133
10. ГЕОХИМИЯ ГИПЕРГЕННЫХ ПРОЦЕССОВ. 136
10.1. Геохимия гидросферы. 137
10.2. Геохимия атмосферы. 161
10.3. Геохимия биосферы. 164
ЛИТЕРАТУРА. 167
Учебное издание
Чертко Николай Константинович
Геохимия
учебное пособие
Редактор Р. Г. Блошко
Технический редактор Т. К. Романович
Корректор В. И. Богданович
Компьютерная верстка
Подписано в печать 00. 00. 2008. Формат 60 × 84 / 16. Бумага офсетная.
Гарнитура Таймс. Печать офсетная. Усл. печ. л. 9,77. Уч.-изд.л. 10,5
Тираж экз. Зак.
Белорусский государственныйуниверситет.
ЛИ № 02330 / 0056804 от 02.03.2044.
220050, Минск, проспект Независимости, 4.
Отпечатано с оригинала-макета заказчика.
Республиканское унитарное предприятие
«Издательский центр Белорусского государственного университета».
ЛП № 02330 / 0056850 от 30.04.2004.
220030, Минск, ул. Красноармейская, 6.
