Термодинамика физико-химической миграции
По конечным результатам рудообразующих процессов, наблюдаемых в настоящее время, геолог может судить о природных процессах, которые протекали в далеком прошлом и привели к формированию месторождений полезных ископаемых. Восстанавливая развитие природного процесса по его конечным результатам, мы расшифровываем его генезис и на этой основе научно и обоснованно прогнозируем открытие месторождения, целенаправленно осуществляем его поиски. Сложность разрешения генезиса месторождения иногда приводит к возникновению противоположных теорий и гипотез. Например, формирование гидротермальных рудных месторождений рассматривалось по аналогии с кристаллизацией вещества из нагретого раствора при его охлаждении.
Созданы теории различных физических и химических процессов (диффузии, фильтрации, кристаллизации и др.). Построена теория метасоматических процессов на термодинамической основе и зональности горных пород, основанная на концепциях «мозаичного» равновесия и «фильтрационного эффекта» разработанных Д. С Коржинским (1952) и его школой (В. А. Жариковым, Л. Л. Перчуком). Позже В. С. Голубев (1981) разработл теорию динамики метасоматоза и математических моделей геохимических процессов (теплопроводности, плавления, кристаллизации, растворения). На границе геохимии и физической химии появилась физическая геохимия, которая занимается изучением природных фазовых реакций на основе равновесного термодинамического метода.
Термодинамика –изучает химические реакции, фазовые переходы (растворение, испарение и кристаллизация веществ, растворов и обратные им процессы), адсорбцию, переход энергии из одной формы в другую и от одной части системы к другой в различных геохимических процессах. Она дает геохимии хорошо отработанный аппарат, который позволяет проверить количественное изучение любых химических превращений, сделать оценку условий протекания того или иного процесса. Например, требуется определить устойчивые твердые фазы в системе Al2O3–H2O при температуре 25 °С и атмосферном давлении. Известно, что древние осадки содержат диаспор AlO(OH), а молодые – гиббсит Al(OH)3. Существовала гипотеза, что диаспор образуется в результате дегидратации гиббсита при нагревании и это подтверждается экспериментом. Однако, термодинамический расчет показывает, что при температуре 25 °С реакция Al(OH)3→AlO(OH) + H2O идет в сторону образования диаспора, т. е. данная реакция должна протекать самопроизвольно. Скорость реакции мала, поэтому диаспор в осадочных породах встречается только в древних осадках.
Термодинамика может определить количественно равновесный состав и анализировать любую по сложности природную систему, количественно учесть многие факторы, влияющие на образование минералов, оценить их роль, выявить основные причины, приводящие к образованию месторождений полезных ископаемых. Реализуется на базе ЭВМ с использованием методов математического моделирования. Например, И. Л. Ходаковский и другие (1978) выполнил прогноз состава пород поверхности Венеры до посадок автоматических станций «Венера» по составу атмосферы, температуре, давлению и вероятному среднему составу преобладающих пород. На ЭВМ рассчитан минеральный состав грунта, из чего следует, что породы Венеры содержат больше Fe2O3, чем на Земле, поэтому возникла гипотеза об израсходовании воды Венеры на окисление железа:
2 FeO + H2O = Fe2O3 + H2.
Термодинамика позволяет исследовать устойчивость и стабильность минеральных ассоциаций при условиях, которые трудно воспроизвести экспериментально; провести по простым математическим соотношениям провести согласование термодинамических данных для всех изученных веществ; выполнить интерполяцию результатов для получения промежуточных значений, а также экстраполяцию данных в область, не охваченную экспериментом. Многие величины констант равновесия, предсказанные на основе теоретических обобщений, оказались достаточно надежными.
Ограничения использования термодинамики, по М. В. Борисову и Ю. В. Шварову (1992), следующие:
1) термодинамика равновесных процессов рассматривает только начальные и конечные состояния системы;
2) промежуточные факторы, механизм реакций, время течения процессов – область химической кинетики;
3) роль кинетического фактора важна в гипергенных условиях;
4) невозможно получить в обозримом будущем всю информацию по термодинамическим свойствам минералов, частицам водных и газовых растворов.
Термодинамический анализ начинается с выделения рассматриваемой совокупности веществ, называемых системой. Границы системы определяются задачами исследования. Законы термодинамики справедливы только для макросистем (минералы, породы). Следует определить характер системы по взаимодействию ее с внешней средой: изолированная – без обмена теплом и веществом с внешним миром; закрытая – без обмена веществом; открытая – возможен обмен веществом и энергией с внешним миром. Все природные системы открытые. Они могут быть гетерогенными и гомогенными. Части гомогенной системы, отделенные друг от друга физической поверхностью раздел, называются фазами (минерал, газ, жидкий раствор). Для описания всех фаз системы используются компоненты системы – индивидуальные вещества, взятые в наименьшем количестве. Для описания состояния систем используются параметры. Термодинамическим параметром может быть такое свойство системы, которое определяет ее состояние. Свойства системы бывают экстенсивные и интенсивные. Первые зависят от массы или числа частиц системы, т. е. обладают свойством аддитивности: объемом (V), энтропией (S), энтальпией (Н), внутренней энергией (U), массой (М) и др. Вторые не зависят от массы или числа частиц: температуры (Т), давления (Р), концентрации (С), плотности (D). Основные параметры состояния системы: T, P, C, D,V. Как функция основных рассматривается < S, H, U и др.
Если скорость изменения внешних условий (Т, Р, С) больше, чем скорость изменения самой системы, то не будет соблюдаться независимость изменения свойств самой системы на пути перехода. Например, в случае быстрого охлаждения расплава получаем стекло, при медленном – кристаллы.
Термодинамический процесс – всякое изменение системы, связанное с изменением хотя бы одного параметра. Равновесное состояние системы в ходе процесса достигается, если в ней протекали все макропроцессы и установилось равенство интенсивных параметров.
Выход каждой природной системы из состояния относительного равновесия диктуется законами термодинамики. Первый закон термодинамики является частным случаем общего закона сохранения энергии (Q) в данной системе: Q = ΔU + A (работа).
Второй закон термодинамики, имеющий значение для понимания химических процессов в земной коре, гласит: коэффициент полезного действия тепловой системы (при переходе от более теплой части к более холодной) всегда бывает меньше единицы и выражается формулой:
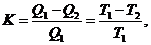
где Q1 – теплота теплоотдачи, Q2 – теплота теплоприемника, Т1 – Т2 – разность их температур.
Величина, полученная из отношения потока теплоты к совершаемой работе и названная энтропией, оказалась необходимой для определения направления природных процессов. В системе для нее характерно экстенсивное свойство, изменение которого связано с поглощаемой теплотой и температурой системы. Поэтому второй закон термодинамики может быть сформулирован следующим образом: в изолированных системах могут совершаться только такие процессы, при которых энтропия системы возрастает, и процесс самопроизвольно может идти только до такого состояния, при котором энтропия обладает максимальным для данных условий значением. Стремление к равновесию в данной системе выражается термодинамическим изобарно-изотермическим потенциалом (Z):
Z = U – TS – PV.
В обратимых изотермических процессах изменение энтропии (ΔS) равно тепловому эффекту процесса (Q), деленного на абсолютную температуру:
• в самопроизвольном процессе ΔS > Q / T;
• в равновесном процессе ΔS =Q / T;
• в несамопроизвольном процессе ΔS < δ Q / T.
Энтропия вычисляется из теплоемкости и измеряется в Дж/град·моль.
Третий закон термодинамики (постулат Планка) гласит: энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле (–273,15 °С) равна нулю:
lim S / T → 0.
Изменение внешних факторов (Р, Т, С) нарушает равновесие и приводит к новым превращениям в системе. Эти превращения совершаются согласно закону Ле-Шателье, если на систему, находящуюся в состоянии равновесия, оказывать какое-либо воздействие, то оно вызовет процесс, который будет стремиться ослабить это воздействие.
Частное приложение этого закона можно показать на следующих примерах.
При остывании магмы кристаллизуются минералы, образование которых сопровождается выделением тепла, противостоящего понижению температуры.
В водах соленого озера осенью при понижении температуры тепло выделяется и соли выпадают в осадок. Весной при повышении температуры осадок растворяется, происходит поглощение тепла. Значит, принцип Ле-Шателье позволяет определить направление процесса при изменении Т, Р, С и может быть применен только для равновесных систем, но не действует при процессах выветривания.
Возрастание температуры приводит к снижению теплового эффекта экзотермических реакций. Согласно формулировке Я. Вант-Гоффа, при повышении температуры равновесие смещается в сторону процесса, идущего с поглощением, а при понижении – с выделением тепла. В условиях земной поверхности окисление железа сопровождается выделением тепла, но при высоких температурах в недрах эта реакция идет с поглощением тепла и процесс направлен в сторону восстановления железа:
Fe2O3 ↔ FeO.
С повышением температуры возрастает растворимость солей, которая сопровождается поглощением тепла.
Возрастание давления вызывает реакции, приводящие к образованию веществ с уменьшенными объемами и повышенной плотностью. Например, при увеличении давления оливин и анортит превращаются в гранат:
Mg2SiO4 + CaAl2Si2O3 → Mg2CaAl2Si3O12
3,12–3,33 2,75 4,3 (плотность)
При повышении концентрации в реакции какого-либо из компонентов происходит переход вещества в другую фазу. Химические реакции протекают в направлении понижения содержания избыточного компонента. Например, в кислых магмах выделяются минералы, богатые кварцем, а в основных, обогащенных Mg, в первую очередь Mg2SiO4, а щелочных – минералы, богатые щелочами.
Изменение равновесия системы при повышении концентрации происходит по закону действующих масс: скорость химических реакций пропорциональна произведению концентрации реагирующих веществ.
При постоянной температуре и давлении движущей силой всех процессов является изобарно-изотермический потенциал или свободная энергия Гиббса (G):
ΔG=ΔH–TΔS.
У. Гиббс считается основателем современной термодинамики, так как разрабатывал применение законов термодинамики для изменения физического состояния вещества и химическим реакциям. Он сформулировал правило фаз, ввел понятие изобарный потенциал и др. Я. Вант-Гофф применил термодинамику к осадочным породам, В. М. Гольдшмидт – к метаморфическим.
Правило фаз Гиббса является одним из законов физической химии и встречает трудности в практическом применении: в равновесной гетерогенной системе число термодинамических степеней свободы (ν) связано простой закономерностью с числом фаз, т е. минералов (ф), и числом компонентов (к):
ν = к – ф + n,
где n – число внешних факторов (Т, Р), влияющих на равновесие в данной системе; фmax= к.
Под намичтермодиеской степенью свободы понимается число условий (Т, Р, С), которые можно изменять по желанию в определенных пределах, не сменяя числа или видов фаз системы.
Д. С. Коржинский сформулировал принцип дифференциальной подвижности компонентов, который, по мнению В. А. Жарикова, отражает самые общие закономерности природных процессов и является одним из главных и общих геологических законов: компоненты в природных системах ведут себя качественно неодинаково; для инертных компонентов независимыми являются экстенсивные, для подвижных – интенсивные параметры. Например, при альбитизации ортоклаза инертными компонентами являются Al, Si, подвижными – K, Na.
В термодинамике используются также химическое сродство, произведение растворимости, константа равновесия, правило торможения химических реакций.
Химическое сродство – способность элементов вступать в химическую реакцию (как FeS + O2, но не бывает реакции О2 + Au). Однако отсутствие взаимодействия не всегда означает отсутствие сродства, так как часто влияют кинетические процессы. Оценкой химического сродства служит не тепловой эффект, а максимальная работа реакции, прошедшая в условиях изотермического процесса.
Константа равновесия реакции (К) вычисляется разными способами, величины констант приводятся в справочниках. Зная К нескольких реакций, можно составить систему уравнений и определить, в каких формах данный элемент находится в изучаемой среде. К сожалению, нет сведений о величине К многих реакций.
Константа равновесия изменяется только при изменении показателей Т и Р и не зависит от активных концентраций реагирующих веществ. Например, в сильнокислых водах медных месторождений медь находятся в форме Cu2+ (14–30 %), CuHSO4+ (1–25), CuSO4o (70–95 %); в щелочных хлоридно-гидрокарбонатных водах с восстановительными условиями – в формах CuCO3o (15–40 %), Cu(CO3)2– (5–20), CuOH+ (5–10 %); в кислых хлоридных водах нефтегазоносных структур – Cu(OH)3– (40–65 %), Cu+ (20–46), CuCl+ (20–35 %).
Форма нахождения элемента в растворе имеет значение при изучении процессов миграции и концентрации элементов, решении экологических проблем.
Произведение растворимости – произведение молярных концентраций (активности) ионов минерала в его насыщенном растворе является постоянной величиной. Из этого вытекает, что при добавлении в раствор более растворимой соли (СаF2), имеющей одноименный ион (Са2+) с менее растворимой солью CaSO4, растворимость последней понижается. Аналогично в зоне окисления сульфидных месторождений снижается растворимость CaSO4 и ZnSO4 при появлении в растворе PbSO4.
Это правило не подходит при нахождении в растворе хорошо растворимых минералов. Им можно пользоваться при растворимости минерала в воде менее 0,01 моль/л (равнозначно менее 1 г/л).
Правило торможения химических реакций, сформулированное А. И. Перельманом (1941), гласит: если в системе один из реагентов присутствует в количестве, недостаточном для реализации всех возможных реакций, то реализуются только те реакции, для которых характерно максимальное химическое сродство. Отсюда следует, что для всех возможных реакций образования минералов в первую очередь протекают те, для которых характерна наименьшая величина произведения растворимости. Некоторые парагенные ассоциации элементов в рудах связаны с действием этого правила. Например, если в воду с содержанием Cl – и I – будет поступать AgNO3 , то сначала будет осаждаться AgI, так как растворимость его ниже (1 ·10–16), чем у AgCl (1 ·10–10). Значит, образование AgI и его осаждение будет тормозить осаждение AgCl.
Важнейшие параметры термодинамики (давление, температура) участвуют в формировании термодинамического геохимического барьера (Н), который распространен в гидротермальных и гипергенных системах. В местах резкого понижения давления СО2 в подземных водах осаждается кальцит и карбонаты:
Ca2+ + 2HCO3– →CaCO3↓ + H2O + CO2.
Так образуются кальцитовые гидротермальные жилы, травертины в местах выхода на поверхность углекислых источников, кальцитовые горизонты в почвах и осадочных породах.
Таким образом, термодинамика вносит большой вклад в изучение физико-химической миграции, однако ее возможности не универсальны, так как большинство реакций в зоне гипергенеза необратимы и для них нельзя рассчитать константы равновесия, изобарный потенциал и другие функции равновесной термодинамики. Это обстоятельство ограничивает решение части геохимических задач и потому на помощь приходит развивающаяся химическая кинетика. С ней связана динамика физико-химической миграции. Изучается механизм процесса, скорость реакций, которые реализуются путем исследования диффузии, конвекции или их совмещения (конвективная диффузия). Наиболее детально исследована кинетика и динамика метасоматоза и процессов образования ореолов рассеивания рудных месторождений. Динамике геохимических процессов посвящены исследования В. С. Голубева, сущность которых рассмотрим ниже.
Геохимические процессы
Внешние факторы в сочетании с внутренними и средой создают условия, при которых происходит трансформация природных соединений, перегруппировка атомов и ионов и установление определенного равновесия на основе физических, химических и биохимических законов и закономерностей на Земле. Все вместе взятое приводит к формированию процессов, которые действуют в определенных условиях геосфер и создают разнообразные соединения органической и неорганической природы, приуроченные к определенным участкам или регионам Земли.
По мере накопления геохимической информации обосновывались все новые и новые процессы. Сделаны попытки их классификации в геохимии, ландшафтоведении, почвоведении, геологии и других научных дисциплинах. Здесь мы рассмотрим лишь те геохимические процессы, которые имеют отношение к геохимии, геологии и ландшафтам.
Геохимический процесс – это физико-химические природные реакции, в результате которых распределяются атомы и соединения в пространстве и во времени для достижения равновесия, характерного при данных гидротермических условиях земной среды.
Классификацию геохимических процессов можно проводить по месту их воздействия, по особенностям проявления в сочетании или отдельных элементарных физических, химических, биологических и механических процессов.
