Приготовление раствора кислоты заданной концентрации
Теоретические основы. Растворы - это гомогенные системы переменного состава. Они состоят из растворителя и растворенного вещества, соотношение между которыми определяется концентрацией раствора.
Способы выражения концентрации раствора:
а) массовая доля раствора (процентная концентрация) показывает массу растворенного вещества в 100 г раствора
 w =
w = 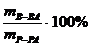
(например, 3% раствор NaOH или w(NaOH)=3%, w(NaOH)=0,03);
 б) молярная концентрация раствора (молярность) показывает количество растворенного вещества в 1 л раствора
б) молярная концентрация раствора (молярность) показывает количество растворенного вещества в 1 л раствора
СМ = 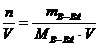
(например 2 М раствор HCl или СМ (HCl)= 2 моль/л);
в) молярная концентрация эквивалента (нормальная концентрация или нормальность) показывает количество эквивалентов вещества в 1 л раствора
 CN =
CN = 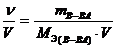
(например, 0,1N раствор НNO3 или CN(НNO3)= 0,1 моль/л).
Цель работы. По плотности исходного раствора соляной кислоты, экспериментально определенной с помощью ареометра, найти по таблице его концентрацию. Рассчитать объем концентрированного раствора соляной кислоты и воды, необходимые для приготовления требуемого объема кислоты заданной концентрации. Приготовить раствор кислоты.
Порядок работы.
1. Налейте исходный раствор кислоты в цилиндр без делений примерно на половину его объема.
2. Осмотрите ареометры. Ареометр, рассчитанный на измерение меньших плотностей, опустите в раствор кислоты в мерном цилиндре. Если шкала ареометра полностью находится над поверхностью, замените его на другой - для измерения больших плотностей. Для снятия показаний на шкалу смотрят несколько снизу, сквозь толщу раствора. Верхняя видимая при этом метка соответствует плотности раствора (r).
3. В таблице зависимости плотности раствора от концентрации (см. приложение 2) найдите массовую долю раствора соляной кислоты. При необходимости проведите интерполяцию (см. приложение 3).
4. Рассчитайте объемы исходного раствора Vисх и дистиллированной воды, необходимые для приготовления 250 мл 0,1 N раствора соляной кислоты.
5. Мерным цилиндром объемом 10 мл отмерьте в склянку рассчитанный объем исходного раствора НCl и мерным цилиндром объемом 250 мл - рассчитанный объем дистиллированной воды.
6. Закройте склянку пробкой и перемешайте содержимое, опрокидывая склянку не менее 20 раз.
7. На листе бумаги запишите: “HCl  0,1N”, свою фамилию, номер группы, закрепите его на склянке и оставьте раствор кислоты до следующего занятия.
0,1N”, свою фамилию, номер группы, закрепите его на склянке и оставьте раствор кислоты до следующего занятия.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Задание: приготовить 250 мл 0,1 N раствора соляной кислоты. Образец концентрированной кислоты № ..... .
4. Характеристика исходного раствора соляной кислоты:
плотность r = .......
интерполяция: ........
массовая доля исходного раствора кислоты w = ...... .
5. Расчеты:
а) масса соляной кислоты, содержащаяся в 250 мл 0,1 N раствора соляной кислоты
mHCl = MЭ (HCl) 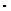 CN
CN  Vр-ра = .......
Vр-ра = .......
б) масса исходного раствора соляной кислоты, содержащая рассчитанное количество соляной кислоты
mисх .р-ра = 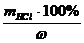 = ......
= ......
в) объем исходного раствора соляной кислоты
Vисх.р-ра = mисх. р-ра / r = ......
г) объем дистиллированной воды
Vводы = 250 - Vисх .р-ра = ......
Типовые задачи
1. В 300 г воды растворили 20 г нитрата калия. Вычислите массовую долю раствора.
2. Какая масса соли содержится в 600 г 12% раствора нитрата натрия?
3. Какая масса сульфата натрия требуется для приготовления 5 л 8% раствора (плотность 1,075 г/мл)?
4. Какая масса соли содержится в 800 мл 1,2 М раствора бромида калия?
5. Какую массу гидроксида калия надо взять для приготовления 200 мл 3 Н раствора?
6. Какой объем 6,0 М раствора соляной (хлороводородной)кислоты требуется для приготовления 25 мл 2,5 М раствора?
7. Какой объем 96% серной кислоты (плотность 1,84 г/мл) требуется для приготовления 0,8 л 2 М раствора?
8. К 500 мл 32% раствора азотной кислоты (плотность 1,20 г/мл) прибавили 1 л воды. Чему равна массовая доля кислоты в полученном растворе?
9. Рассчитать молярную концентрацию эквивалента (нормальность) концентрированной соляной (хлороводородной) кислоты (плотность 1,18 г/мл), содержащей по массе 36,5% HCl.
10. Пользуясь данными таблицы зависимости плотности от массовой доли раствора (приложение 2) и применив метод интерполяции (приложение 3), рассчитайте массовую долю раствора соляной кислоты с плотностью 1,163 г/мл.
Лабораторная работа 7
