Структурная организация белков.
Одной из особенностей белков является их сложная структурная организация. Все белки обладают первичной, вторичной и третичной структурой, а те, которые в своем составе имеют две и больше ППЦ обладают и четвертичной структурой (ЧС).
Первичная структура белка (ПСБ) – это порядок чередования (последовательность) аминокислотных остатков в ППЦ.
Даже одинаковые по своей длине и аминокислотному составу белки могут быть разными веществами. Например, из двух аминокислот можно составить 2 разных дипептида:
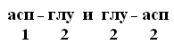
При числе аминокислот, равном 20, число возможных комбинаций равно 2´1018. А если учесть, что в ППЦ каждая аминокислота может встретиться больше 1 раза, то число возможных вариантов трудно поддается подсчету.
Определение первичной структуры белка (ПСБ).
ПСБ белков можно определить с помощью фенилтиогидантоиновогометода. Этот метод основан на реакции взаимодействия фенилизотиоцианата (ФИТЦ) с α-АК. В результате образуется комплекс этих двух соединений – ФИТЦ -АК. Например, рассмотрим пептид 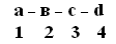 с целью определения его ПСБ, то есть последовательности соединения аминокислотных остатков.
с целью определения его ПСБ, то есть последовательности соединения аминокислотных остатков.
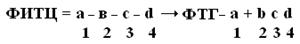
ФИТЦ взаимодействует с концевой аминокислотой (а). Образуется комплекс ФТГ-а, его отделяют от смеси и определяют подлинность аминокислоты а. Например, это – асн 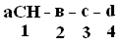 и т.д. Последовательно отделяют и идентифицируют все остальные аминокислоты. Это трудоемкий процесс. Определение ПСБ белка среднего размера занимает несколько месяцев.
и т.д. Последовательно отделяют и идентифицируют все остальные аминокислоты. Это трудоемкий процесс. Определение ПСБ белка среднего размера занимает несколько месяцев.
Приоритет в расшифровке ПСБ принадлежит Сенджеру (1953), который открыл ПСБ инсулина (Лауреат Нобелевской премии). Молекула инсулина состоит из 2х ППЦ – A и B.
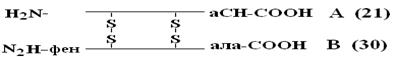
А-цепь состоит из 21 аминокислоты, цепь В – из 30. Между собой ППЦ соединяются дисульфидными мостиками. Число белков, ПСБ которых определена, к настоящему времени достигает 1500. Даже небольшие изменения первичной структуры могут существенно изменить свойства белка. В эритроцитах здоровых людей содержится HbA – при замене в b-цепи HbA, в 6-м положении глу на вал возникает тяжелейшее заболевание серповидно-клеточная анемия, при которой дети, родившиеся с этой аномалией, погибают в раннем возрасте. С другой стороны, возможны варианты изменения ПСБ, которые не сказываются на его физико-химических и биологических свойствах. Например, HbC содержит в 6-м положении b-цепи вместо глу – лиз, HbС почти не отличается по своим свойствам от HbA, а люди, имеющие в эритроцитах такой Hb, практически здоровы.
Стабильность ПСБ обеспечивается в основном прочными ковалентными пептидными связями и, во вторую очередь, дисульфидными связями.
Вторичная структура белка (ВСБ).
ППЦ белков обладают большой гибкостью и приобретают определенную пространственную структуру или конформацию. В белках различают 2 уровня такой конформации – это ВСБ и третичная структура (ТСБ).
ВСБ – это конфигурация ППЦ, то есть способ ее укладки или скручивания в какую-нибудь конформацию, в соответствии с программой, заложенной в ПСБ.
Известны три основных типа ВСБ:
1) a-спираль;
2) b-структура (складчатый слой или складчатый листок);
3) беспорядочный клубок.
a-спираль.
Ее модель предложена В. Полингом. Она наиболее вероятна для глобулярных белков. Для любой системы наиболее устойчивым является состояние, соответствующее минимуму свободной энергии. Для пептидов такое состояние имеет место, когда CO– и NH– группы соединяются между собой слабой водородной связью. В a-спирали NH– группы 1-го аминокислотного остатка взаимодействует с CO–группой 4-ой по счету аминокислотой. В результате пептидный остов образует спираль, на каждый виток которой приходится 3,6 АК-остатка.
|
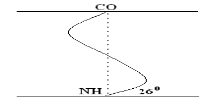
Закручивание ППЦ происходит по часовой стрелке, то есть у спирали – правый ход. Через каждые 5 витков (18 АК; 2,7 нм) конфигурация ППЦ повторяется.
Стабилизируется ВСБ в первую очередь водородными связями, и во вторую – пептидными и дисульфидными. Водородные связи в 10-100 раз слабее обычных химических связей; однако за счет их большого количества они обеспечивают определенную жесткость и компактность ВСБ. Боковые R-цепи a-спирали обращены к наружи и расположены по разные стороны от ее оси.
b-структура.
Это складчатые участки ППЦ, по форме напоминающие листок, сложенный в гармошку. Слои ППЦ могут быть параллельными, если обе цепи начинаются с N– или С–конца.
Если смежные цепи в слое ориентированы противоположными концами N–С и С–N, то они называются антипараллельными.

 паралельные
паралельные
 антипараллельные
антипараллельные
Образование водородных связей происходит, как и в a-спирали, между CO– и NH– группами.
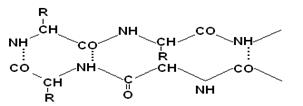
Содержание a-спирали и b-структуры в разных белках неодинаково. Не вся ППЦ уложена в спирали или складчатые слои.
Беспорядочный клубок
Некоторые участки вообще не имеют какой-либо правильной периодической пространственной конфигурации. Их обозначают как беспорядочный клубок, однако такие участки имеют свою фиксированную конформацию, которая определяется аминокислотным составом этого участка, а также ВСБ и ТСБ смежных областей, окружающих беспорядочный клубок. В областях беспорядочного клубка ППЦ могут легко изгибаться и изменять свою конфигурацию, в то время как a-спираль и b-структуры представляют собой довольно жесткие структуры.
Встречаемость a-спирали и b-структуры в различных белках.
| a-спираль | b-структура | |
| Рибонуклеаза | 26% | 35% |
| Миоглобин | 80% | 0% |
| Трипсин | 14% | 45% |
Третьичная структура белка (ТСБ).
По форме своих молекул и особенностям пространственной структуры белки делятся на две группы – глобулярные и фибриллярные белки.
Форма глобулярных белков близка к сферической или эллипсоидной, короткая и длинная ось которых может относиться как 1:50. Фибриллы белков более удлиненной формы. Такой белок может образовывать многомолекулярные нитевидные агрегаты – фибриллы. Фибриллярные белки выполняяют в основном опорную функцию. Функции глобулярных белков более разнообразны. ТС глобулярных белков образуется путем дополнительного скручивания ППЦ, содержащей a-спираль, b-структуру и беспорядочные клубки. ТСБ образуется, главным образом за счет взаимодействия R, основную роль при этом играют дисульфидные связи, слабые водородные, ионные связи и особенно гидрофобные.
Дисульфидные связи приводят к тому, что удаленные друг от друга области ППЦ сближаются и образуют фиксированные петли.
Гидрофобные взаимодействия осуществляются за счет сближения R аминокислот с молекулой воды. Неполярные гидрофобные R, отталкиваясь от водного окружения, как бы втягиваются внутрь белковой молекулы, образуя там так называемые «сухие зоны». А гидрофильные R обращены к наружи образующейся глобулы и ориентированы в сторону воды. Все образующиеся химические связи определены аминокислотным составом и их чередованием в ППЦ.
Таким образом, ТСБ – это компактное расположение или упаковка в пространстве одной или нескольких ППЦ в определенном объеме.
Все биологические свойства белковой молекулы связаны с сохранностью их ТС, которая называется нативной конфигурацией белка.
Глобулярная молекула (глобула) не является абсолютно жесткой структурой. Небольшие изменения конфигурации белковых молекул происходят как внутри самой молекулы (как бы пульсация), так и при взаимодействии с другими молекулами и напоминает изменение формы резинового мяча при надавливании.
