Количественная характеристика окислительно-восстановительных реакций
Окислительно-восстановительная активность простых веществ.Для количественной характеристики окислительно-восстановительной активности простых веществ используются такие величины как энергия ионизации, энергия сродства к электрону, которые зависят прежде всего от положения атомов элементов в периодической системе Д. И. Менделеева.
При химических реакциях атомное ядро остаётся без изменения, а химические свойства атомов (способность их отдавать или присоединять электроны) зависят от величины радиуса атома и электронной структуры, при этом решающую роль играет структура наружной электронной оболочки. Чем больше радиус атомов и меньше число электронов наружного электронного уровня, тем слабее они удерживаются в атомах и, следовательно, тем больше их восстановительная активность. Энергия ионизации может служить мерой восстановительной способности атомов: чем меньше её величина, тем более сильным восстановителем является атом. Так, щелочные металлы, имеющие наибольшие радиусы атомов и всего по одному валентному электрону, обладают наибольшей восстановительной активностью, при этом она возрастает сверху вниз, от лития к цезию и францию, в соответствии с увеличением радиусов атомов и уменьшением энергии ионизации или ионизационных потенциалов.
Такая закономерность характерна для подгрупп А (главных). В подгруппах В (побочных) при переходе от одного элемента к другому (в порядке увеличения заряда ядра атома) энергия ионизации относительно мало изменяется и характеризуется более высокими значениями, чем у элементов главных подгрупп. Это объясняется незначительным изменением радиусов их атомов (сказывается влияние лантаноидного сжатия), а также влиянием эффектов проникновения электронов к ядру и экранирования d- оболочкой внешних электронов.
Мерой окислительной способности атома служит энергия сродства к электрону (величина энергии, выделяемая или поглощаемая при присоединении электрона к нейтральному атому). Чем больше энергия сродства, тем более сильным окислителем является данный атом. В соответствии с этим окислителями являются атомы элементов, расположенные в правом верхнем углу периодической системы элементов, в главных подгруппах 5-7 групп. Окислительная активность элементов в этих подгруппах снижается сверху вниз. Например, в группе галогенов фтор является самым сильным окислителем.
Для оценки способности элементов к присоединению и отдаче электронов используют величину, называемую электроотрицательностью (ЭО), под которой понимают полусумму или сумму энергии ионизации атома и его энергию сродства к электрону. Для более удобного применения вместо абсолютных значений электроотрицательности (выражаемых в кДж/г-атом или эВ/атом) используют её относительные значения (ОЭО), принимая за единицу электроотрицательность лития. У фтора - самого сильного окислителя - ОЭО равна четырём. Чем больше ОЭО элемента, тем сильнее выражены его окислитель-
ные свойства, и наоборот, элемент, имеющий наименьшее значение ОЭО, наиболее активно проявляет восстановительные свойства.
Окислительно-восстановительная активность веществ, находящихся в растворах.Для количественной характеристики окислительно-восстановительной активности веществ, находящихся в растворах или контактирующих с ними, используются окислительно-восстановительные потенциалы ( 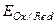 ). Значения этих потенциалов (в вольтах) можно рассчитывать по уравнению Нернста, имеющего вид
). Значения этих потенциалов (в вольтах) можно рассчитывать по уравнению Нернста, имеющего вид
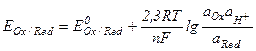 ,
,
где 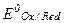 - нормальный или стандартный окислительно-восстановительный потенциал; F - число Фарадея; R - газовая постоянная; n - число электронов, отдаваемых или получаемых при превращении восстановленной формы в окисленную (или наоборот);
- нормальный или стандартный окислительно-восстановительный потенциал; F - число Фарадея; R - газовая постоянная; n - число электронов, отдаваемых или получаемых при превращении восстановленной формы в окисленную (или наоборот); 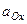 - активная концентрация окислительной формы вещества;
- активная концентрация окислительной формы вещества; 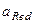 - активная концентрация восстановленной формы вещества;
- активная концентрация восстановленной формы вещества; 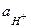 - активная концентрация ионов водорода. Например, для системы MnO4- + 8Н+ +5
- активная концентрация ионов водорода. Например, для системы MnO4- + 8Н+ +5 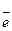 = Мn2+ + 4Н2О, в которой ионы МnO4- - являются окислительной формой вещества, а ионы Мn2+ - восстановительной формой вещества, окислительно-восстановительный потенциал определяется уравнением
= Мn2+ + 4Н2О, в которой ионы МnO4- - являются окислительной формой вещества, а ионы Мn2+ - восстановительной формой вещества, окислительно-восстановительный потенциал определяется уравнением
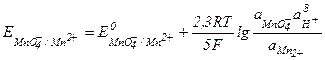
После подстановки постоянных величин уравнение Нернста примет более простой вид:
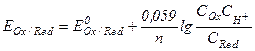
где 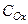 и
и 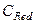 - мольные концентрации окисленной и восстановленной формы веществ,
- мольные концентрации окисленной и восстановленной формы веществ, 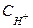 - концентрация ионов водорода. Следует отметить, что,
- концентрация ионов водорода. Следует отметить, что, 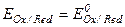 , когда
, когда 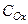 =
= 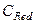 = =
= = 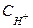 - 1 моль/л.
- 1 моль/л.
Окислительно-восстановительные потенциалы не являются неизменными. Они зависят от соотношения 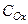 и
и 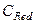 , а также от температуры, природы растворителя, рН среды и др.
, а также от температуры, природы растворителя, рН среды и др.
Направленность окислительно-восстановительных реакций.Значения 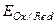 обычно измеряются относительно нормального водородного электрода, потенциал которого принят за нуль.
обычно измеряются относительно нормального водородного электрода, потенциал которого принят за нуль.
Чем меньше алгебраическая величина 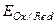 , тем активнее данная окислительно-восстановительная система как восстановитель, т.е. тем она легче отдает электроны и переходит из восстановленной формы в окисленную и наоборот. Таким образом, окислительно-восстановительные потенциалы позволяют количественно оценить активность окислителя и восстановителя, направление и глубину протекания окислительно-восстановительной реакции.
, тем активнее данная окислительно-восстановительная система как восстановитель, т.е. тем она легче отдает электроны и переходит из восстановленной формы в окисленную и наоборот. Таким образом, окислительно-восстановительные потенциалы позволяют количественно оценить активность окислителя и восстановителя, направление и глубину протекания окислительно-восстановительной реакции.
Например, для реакции (в гомогенной фазе)
МnO4- + 5Fe2+ + 8Н+ = Mn2+ + 5Fe+ + 4Н2O
Стандартные потенциалы полуреакций имеют значения 1,52 В для первой и 0,77 В для второй:
МnO4- + 8Н+ + 5 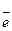 = Mn2+ + 5Fe3+ + 4Н2O Е0 =1,52 В
= Mn2+ + 5Fe3+ + 4Н2O Е0 =1,52 В
Fe3+ + 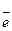 = Fe2+ Е°=0,77 В
= Fe2+ Е°=0,77 В
Окислительно-восстановительный потенциал для первой системы электроположительнее, чем для второй. Следовательно, при взаимодействии веществ, содержащих ионы MnO4- и Fe2+, первый, т.е. MnO4- выступает в роли окислителя, т.е. первая реакция протекает слева направо, а вторая справа налево.
Следовательно, окислительно-восстановительная реакция может протекать в выбранном направлении при условии, если окислительно-восстановительный потенциал окислителя больше потенциала восстановителя, т.е. если разность потенциалов (∆ Е = Еокисл-Евосст) имеет положительное значение. В этом случае свободная энергия Гиббса имеет отрицательное значение, так как ∆ G = -nF ∆ E, где ∆ Е - разность потенциалов, F - число Фарадея, n - число электронов, участвующих в процессе. Чтобы ∆ G было меньше нуля, т.е. ∆ G < О, ∆ Е должна быть положительной величиной, т.е. самопроизвольное протекание окислительно-восстановительной реакции возможно, если потенциал окислителя больше потенциала восстановителя. Чем больше ∆ Е, тем отрицательнее значение ∆ G, и, следовательно, интенсивнее протекание окислительно-восстановительной реакции.
Пример. Возможен ли процесс
2KBr + PbO2 + 4HNO3 = Br2 + Pb(NO3)2 + 2KNO3 + 2Н2O?
Находим по таблице значения стандартных окислительно-восстановительных потенциалов, участвующих в реакции систем:
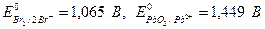
В реакции окислителем будет являться PbO2, а восстановителем бромид ион ∆ Е = 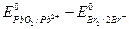 =1,449 В -1,065 В = 0,384 В, т.е. ∆ Е > 0, реакция будет протекать самопроизвольно слева направо.
=1,449 В -1,065 В = 0,384 В, т.е. ∆ Е > 0, реакция будет протекать самопроизвольно слева направо.
Чем больше величина ∆ Е реакций, тем интенсивнее она протекает. Например, из двух металлов - кальция и никеля -первый будет более интенсивно взаимодействовать с раствором НСl, т.к. 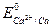 = -2,87 В, а
= -2,87 В, а 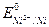 = -0,25 В.
= -0,25 В.
