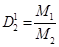Тема 1.1.3 Простейшие количественные отношения в химии. Расчеты по формулам и уравнениям.
Тема 1.1.3 Простейшие количественные отношения в химии. Расчеты по формулам и уравнениям.
Теория.
- Количество вещества. Постоянная Авогадро. Молярная масса.
- Закон Авогадро. Молярный объем. Относительная плотность газов.
- Основной закон стехиометрии. Расчеты по уравнениям.
Количество вещества - физическая величина, которая определяется числом структурных частиц (молекул, атомов и т.д.), содержащихся в данной порции вещества. Обозначается: 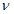 - «ню». Единица количества вещества - моль.
- «ню». Единица количества вещества - моль.
Один моль любого вещества содержит одно и то же число структурных частиц. Это число – величина постоянная и равно 6 . 1023. Это число названо в честь итальянского химика «постоянная Авогадро»

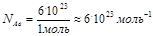
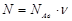
Т.к. масса частиц в чистом веществе величина постоянная, то масса 1 моль (т.е. определенного количества частиц) любого вещества тоже величина постоянная и называется «молярная масса». Числовое значение молярной массы равно относительной молекулярной массе, но выражается в г/моль. Например: Мr(H2SO4)= 98; M(H2SO4)= 98 г/моль 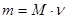
Объем частиц (размеры) у разных веществ тоже разные. Но газы отличаются от других веществ тем, что расстояние между частицами в сотни раз превышают размеры самих частиц. Поэтому объем газов определяется не размерами частиц газа, а их количеством.
ЗАКОН АВОГАДРО: в равных объемах разных газов при одинаковых условиях содержится одинаковое число молекул.
Но особое практическое значение имеют СЛЕДСТВИЯ ИЗ ЗАКОНА АВОГАДРО
1 следствие т.к. в 1 моль любого газа одинаковое число молекул => 1 моль любого газа при одинаковых условиях занимает одинаковый объем. При нормальных условиях – н.у. (0*С и 1 атм) 1 моль любого газа занимает объем 22,4 л, этот объем называют молярным и обозначают Vm т.е. Vm= 22,4 л/ моль.
Зная количество вещества (ν) , легко найти V = ν ·Vm
2 следствие из закона Авогадро: т.к. в одинаковых объемах газов одинаковое число молекул => то для 1 моля любого газа V1= V2= Vm , а масса m1= M1 ,a m2 = M2 (Mвозд.= 29) => относительная плотность газа определяется отношением масс молекул этих газов или их молярных масс, т.е. 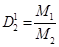
Образцы решения задач по уравнениям реакций
III. БЛОК КОНТРОЛЯ ЗНАНИЙ
Контролирующие материалы в форме индивидуальных карточек:
КОНТРОЛЬ ИСХОДНОГО УРОВНЯ ЗНАНИЙ.
Вар.
- А) Химическая формула – условное изображение состава вещества
Б) Химический элемент – совокупность атомов одного вида, с определенным зарядом ядра.
В) простое вещество – это вещество состоящее из одного химического элемента
2. C , 5N, 4O3, 3NO2
3. CIVOII2 NIII2OII3 KI3PIII AlIII2OII3 SVIOII3
4. ClIII2OII3 MgII3OII2 CIIOII CrVIOII3 AgI2OII
5. А) 4Al + 3O2 → 2Al2O3
Б)2 H2S + 3O2 → 2H2O + 2SO2
В) Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Г) Ag2O + 2HNO3 →2 AgNO3 + H2O
Критерии оценки заданий:
1. 3 балла
2. 4 балла
3. 5 баллов
4. 5 баллов
5. 8 баллов
25, 24 балла – 5
23, 22, 21 балл – 4
20, 19, 18 баллов - 3
Задания для закрепления и систематизации полученных знаний:
№9. Какое число молекул содержит кислород (О2) количеством вещества 5 моль?
№11. Какое количество вещества составляет 1,5·1023 молекул водорода (Н2)?
№13. Вычислить массу 0,5 моль сероводорода(H2S)?
№15. Какое количество вещества составляет 4,4 грамм углекислого газа(CO2)?
№17. Найти количество вещества, которое соответствует 306 г оксида алюминия(Al2O3).
№19. Найти число молекул кислорода (О2) В 0,1 моль.
№21 Найти объем 0,5 моль Н2(водорода)
№22 Найти количество вещества, если объем кислорода 22,4 л
№23 Найти относительную плотность кислорода по воздуху (средняя Мвозд.=29 г/моль)
№24 Найти молекулярную массу бурого газа, если его плотность по водороду равна 23.
№31. Сколько атомов в 80 г кальция (Са)?
№33. Найти массу 12·1023 атомов серы (S).
№35 Рассчитайте массу 156,8 л метана (CH4).
№37 Найти объем 38,4 г кислорода (O2).
№39 Сколько молекул содержится в 5,6 л водорода (H2)?
№40 Какой объем занимает 9· 1023 молекул кислорода?
№55 Какое количество вещества оксида фосфора (P2O5) образуется при сжигании 0,1 моль фосфора (P)?
№56 Какое количество вещества водорода (H2) выделится при взаимодействии 0,4 моль алюминия (Al) с соляной кислотой (HCl)?
№58 Найдите массу оксида меди II (CuO), если на окисление меди(Cu) затратили 0,5 моль кислорода (O2).
№59 Найти массу воды (H2O), которая получиться при сгорании 0,4 моль водорода (H2).
№60 Найдите массу соляной кислоты (HCl), которая вступит в реакцию с 0,5 моль цинка (Zn).
№61 Какой объем кислорода (O2) израсходовали на сжигание 0,2 моль угля (C)?
№63 Какой объём водорода (H2) израсходовали на восстановление 0,2 моль алюминия(Al) из оксида алюминия (Al)?
№66 Сколько г железа (Fe) можно получить из оксида железа III (Fe2O3) если на восстановление затратить 6,72 литров водорода (H2).
№67 Какой объём водорода (H2) образуется при взаимодействии 27 г алюминия (Al) с соляной кислотой (Al)?
Тема 1.1.3 Простейшие количественные отношения в химии. Расчеты по формулам и уравнениям.
Теория.
- Количество вещества. Постоянная Авогадро. Молярная масса.
- Закон Авогадро. Молярный объем. Относительная плотность газов.
- Основной закон стехиометрии. Расчеты по уравнениям.
Количество вещества - физическая величина, которая определяется числом структурных частиц (молекул, атомов и т.д.), содержащихся в данной порции вещества. Обозначается: 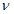 - «ню». Единица количества вещества - моль.
- «ню». Единица количества вещества - моль.
Один моль любого вещества содержит одно и то же число структурных частиц. Это число – величина постоянная и равно 6 . 1023. Это число названо в честь итальянского химика «постоянная Авогадро»

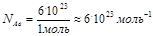
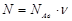
Т.к. масса частиц в чистом веществе величина постоянная, то масса 1 моль (т.е. определенного количества частиц) любого вещества тоже величина постоянная и называется «молярная масса». Числовое значение молярной массы равно относительной молекулярной массе, но выражается в г/моль. Например: Мr(H2SO4)= 98; M(H2SO4)= 98 г/моль 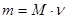
Объем частиц (размеры) у разных веществ тоже разные. Но газы отличаются от других веществ тем, что расстояние между частицами в сотни раз превышают размеры самих частиц. Поэтому объем газов определяется не размерами частиц газа, а их количеством.
ЗАКОН АВОГАДРО: в равных объемах разных газов при одинаковых условиях содержится одинаковое число молекул.
Но особое практическое значение имеют СЛЕДСТВИЯ ИЗ ЗАКОНА АВОГАДРО
1 следствие т.к. в 1 моль любого газа одинаковое число молекул => 1 моль любого газа при одинаковых условиях занимает одинаковый объем. При нормальных условиях – н.у. (0*С и 1 атм) 1 моль любого газа занимает объем 22,4 л, этот объем называют молярным и обозначают Vm т.е. Vm= 22,4 л/ моль.
Зная количество вещества (ν) , легко найти V = ν ·Vm
2 следствие из закона Авогадро: т.к. в одинаковых объемах газов одинаковое число молекул => то для 1 моля любого газа V1= V2= Vm , а масса m1= M1 ,a m2 = M2 (Mвозд.= 29) => относительная плотность газа определяется отношением масс молекул этих газов или их молярных масс, т.е.