Клиническое значение концентрации БФГ в консервированной крови
В крови, консервированной в некоторых средах, например цитратдекстрозной, за 10 дней концентрация БФГ снижается с 4,5 до 0,5 мМ. Гемоглобин такой крови имеет очень высокое сродство к О2. Если кровь со сниженной концентрацией БФГ переливать тяжелобольным, возникает опасность развития гипоксии тканей. Введённые с кровью эритроциты за 24 ч могут восстановить лишь половину нормальной концентрации БФГ. Добавлением в кровь БФГ нельзя восстановить нормальную концентрацию его в эритроцитах, так как, имея высокий отрицательный заряд, БФГ не может проникать через мембраны эритроцитов. Поэтому в настоящее время в кровь добавляют вещества, способные проникать через мембрану эритроцитов и поддерживать в них нормальную концентрацию БФГ.
6. Регуляторные свойства олигомерного белка
гемоглобина
Таким образом, олигомерный белок гемоглобин, в отличие от мономерного родственного белка миоглобина, способен присоединять к специфическим участкам 4 различных лиган-да: О2, Н+, СО2 и БФГ. Все эти лиганды присоединяются к пространственно разобщённым участкам, но конформационные изменения белка в месте присоединения одного лиганда передаются на весь олигомерный белок и изменяют сродство к нему других лигандов. Так, количество поступающего в ткани О2 зависит не только от парциального давления О2, но и концентрации аллостерических лигандов, что увеличивает возможность регуляции функций гемоглобина.
Как мы уже рассматривали выше, в капиллярах работающей мышцы увеличение концентрации СО2 и Н+ уменьшает сродство гемоглобина к О2 и увеличивает отдачу его в ткани. При длительной гипоксии усиливается синтез 2,3-БФГ в эритроцитах, что также снижает сродство гемоглобина к О2 и при том же парциальном давлении О2 увеличивает его транспорт в ткани.
Следовательно, благодаря воздействию регуляторных лигандов олигомерные белки способны приспосабливать свою конформацию и фунцию к изменениям, происходящим в окружающей среде.
7. Особенности строения
и функционирования гемоглобина плода
Фетальный гемоглобин (HbF) заменяет эмбриональный гемоглобин, начиная синтезироваться в печени через 2 нед после её формирования у плода. С 6 мес развития плода до его рождения это основной гемоглобин эритроцитов. После рождения ребёнка он интенсивно начинает замещаться на гемоглобин А.
В физиологических условиях HbF имеет более высокое сродство к О2, чем НbА, что создаёт оптимальные условия для транспорта О2 из крови матери в кровь плода. Это свойство HbF обусловлено тем, что он слабее, чем НЬА связывается с 2,3-БФГ. Физиологические особенности HbF связаны с особенностями его строения: вместо ?-глобиновых цепей в НЬА, он содержит две ?-цепи (р-подобные). Связывание 2,3-БФГ с НЬА происходит при участии положительно заряженных радикалов аминокислот двух ?-цепей, некоторые из которых отсутствуют в первичной структуре ?-цепей. В среде, лишённой 2,3-БФГ, НbА и HbF проявляют одинаковое высокое сродство к О2.
Гемоглобинопатии
Серповидноклеточная анемия - тяжёлое наследственное заболевание, обусловленное точечной мутацией гена, кодирующего структуру β-цепи гемоглобина (см. раздел 4). В результате в эритроцитах больных присутствует HbS, β-цепи которого в шестом положении вместо гидрофильной глутаминовой кислоты содержат гидрофобную аминокислоту валин. Появление гидрофобной аминокислоты недалеко от начала молекулы способствует возникновению нового центра связывания, поэтому при низком парциальном давлении кислорода тетрамеры дезокси-HbS ассоциируют, образуя длинные микротрубчатые образования, которые полимеризуются внутри эритроцитов. Полимеризация приводит к нарушению структуры эритроцитов, они приобретают серповидную форму и легко разрушаются. При этом заболевании отмечают анемию, прогрессирующую слабость, отставание в развитии и желтуху.
Носители гена серповидноклеточной анемии чаще всего встречаются среди африканского населения, так как они приобретают некоторое преимущество при заболевании малярией, часто встречающейся в странах с тропическим климатом. Причина сохранения гена серповидноклеточной анемии в популяции связана с тем, что в эритроцитах гетерозигот хуже развивается малярийный плазмодий, часть жизненного цикла которого проходит в эритроцитах человека. В связи с этим гетерозиготные носители дефектного
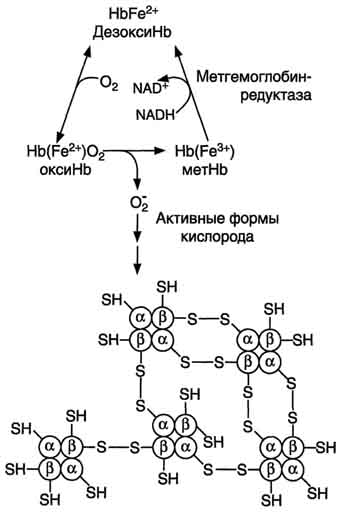
Рис. 14-5. Схема образования телец Хайнца-агрегация гемоглобина. В норме супероксиддисмутаза катализирует образование пероксида водорода, который под действием глутатионпероксидазы превращается в Н2О. При недостаточной активности ферментов обезвреживания активных форм кислорода между протомерами метгемоглобина образуются дисульфидные связи, и они агрегируют.
гена выживали при эпидемиях малярии, однако четверть их потомства погибала от серповиднок-леточной анемии.
Талассемии- наследственные заболевания, обусловленные отсутствием или снижением скорости синтеза α- или β-цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. Это приводит к нарушению основной функции гемоглобина - транспорту кислорода к тканям. Нарушение эритропоэза и ускоренный гемолиз эритроцитов и клеток-предшественников при талассемиях приводит к анемии.
При β-талассемии не синтезируются β-цепи гемоглобина. Это вызывает образование нестабильных тетрамеров, содержащих только α-цепи. При этом заболевании в костном мозге из-за преципитации нестабильных α-цепей усиливается разрушение эритробластов, а ускорение разрушения эритроцитов в циркулирующей крови приводит к внутрисосудистому гемолизу. Как известно, для образования фетального гемоглобина р-цепи не требуются (см. раздел 4), поэтому клинически β-талассемия не проявляется до рождения, после чего происходит переключение синтеза HbF на НBА.
В случае α-талассемии недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или НBН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем НBА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Наследственный сфероцитоз.Причиной этой патологии чаще всего является дефект белков цитоскелета эритроцитов - спектрина или ан-кирина, которые обеспечивают поддержание двояковогнутой формы клетки и эластичности мембраны. Эритроциты приобретают шарообразную форму, что приводит к уменьшению площади их поверхности и снижению скорости газообмена. Потеря эластичности клеточной мембраны приводит к повышению хрупкости и травматичности клеток и, как следствие, к ускорению их разрушения в сосудистом русле и селезёнке. Заболевание сопровождается анемией и желтухой. Удаление селезёнки (спленэктомия) при наследственном сфероцитозе улучшает состояние больных, так как предотвращает разрушение сфероцитов в селезёнке.
Мегалобластная (макроцитарная) анемияразвивается при дефиците фолиевой кислоты или витамина В12.
Фолиевая кислота в виде кофермента (Н4-фолата) участвует в синтезе нуклеотидов. Недостаток фолиевой кислоты приводит к снижению скорости синтеза ДНК в быстроделящихся клетках, и в первую очередь в предшественниках эритроцитов. Клетки дольше пребывают в интерфазе, синтезируя гемоглобин, и становятся крупнее. Кроме того, из-за недостатка нуклеотидов они реже делятся, и количество эритроцитов снижается, а крупные мегалобласты быстрее разрушаются. Всё это в конечном итоге приводит к развитию анемии.
Аналогичная симптоматика развивается при недостатке в организме витамина В12. Этот витамин участвует в переносе метальной группы с N5-метил-Н4-фолата на гомоцистеин с образованием метионина и Н4-фолата (см. раздел 10). Недостаточность витамина В12 приводит к накоплению N5-метил-Н4-фолата в клетках. Дефицит Н4-фолата приводит к нарушению деления клеток и развитию анемии.
97. Биосинтез гема. Схема процесса, химизм первых двух реакций, место протекания. Регуляция активности ферментов АЛК-синтазы и АЛК-дегидратазы. Источники железа для синтеза гема, всасывание железа, транспорт в крови, депонирование.
Гемоглобин – это сложный белок, простетической группой которого является гем. Основная роль гемоглобина – перенос кислорода и углекислого газа.
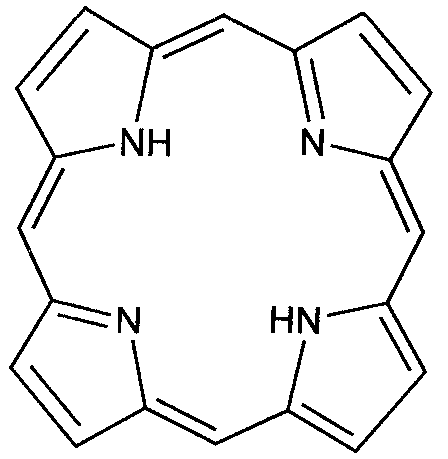
Гем– комплекс железа (Fe+2) c протопорфирином.
 Биосинтез гема
Биосинтез гема
Наиболее активно гем синтезируется в костном мозге и печени.
В костном мозге гем синтезируется для образования гемоглобина в ретикулоцитах, в печени – гем нужен для синтеза цитохрома P450.
Предшественниками синтеза гема являются глицин и сукцинил-КоА, поэтому путь синтеза гема называется глициносукцинатный цикл.
Первые две реакции приводят к образованию порфобилиногена. Далее идёт образование линейных тетрапирролов, которые завершается синтезом протопорфирина IX. Протопорфирин IX присоединяет Fe2+ с помощью фермента – феррохелатазы (гем-синтезы) и образуется гем.
 Регуляция синтеза гема
Регуляция синтеза гема
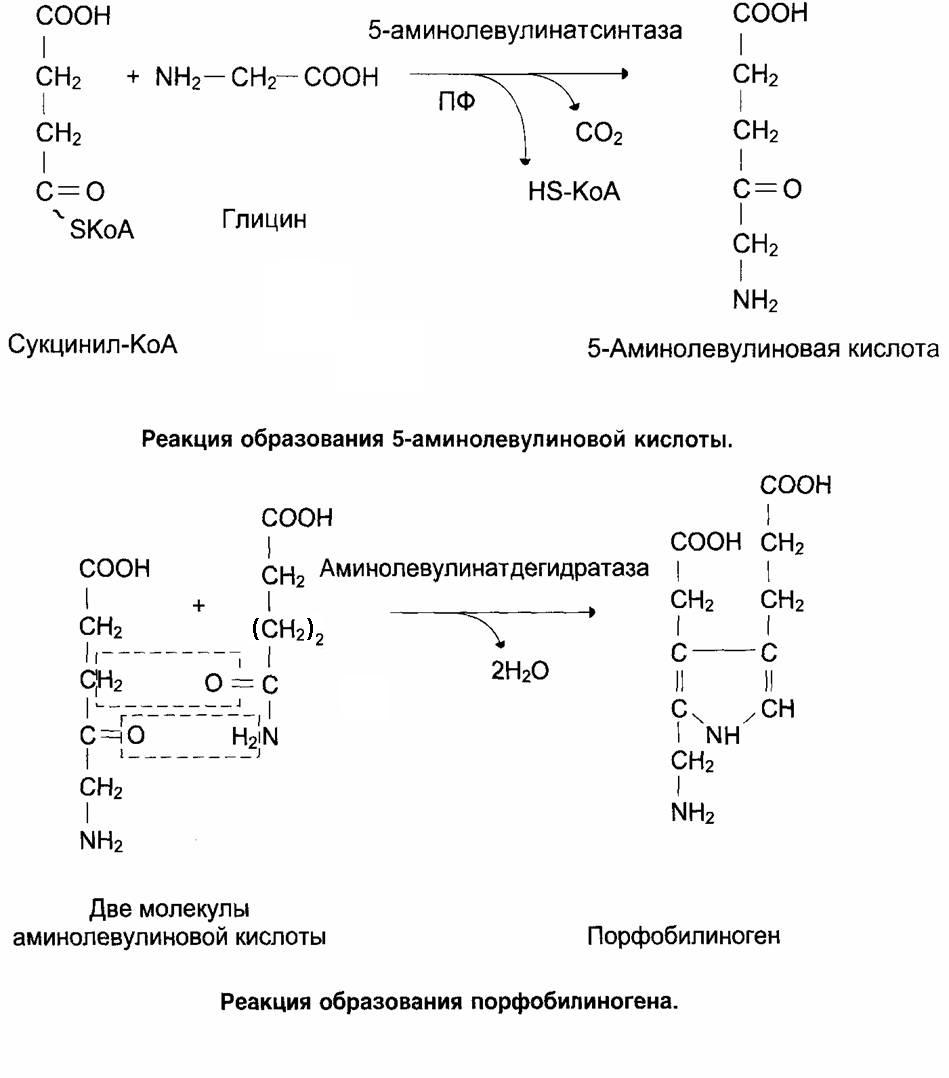
Регуляторными ферментами являются АЛК (аминолевулинатсинтетаза) и аминолевулинатдегидрогеназа.
АЛК - синтаза является главным регуляторным ферментом, коферментом которого служит ПФ.
Аллостерическими ингибиторами АЛК-синтетазы служит гем и гемоглобин.
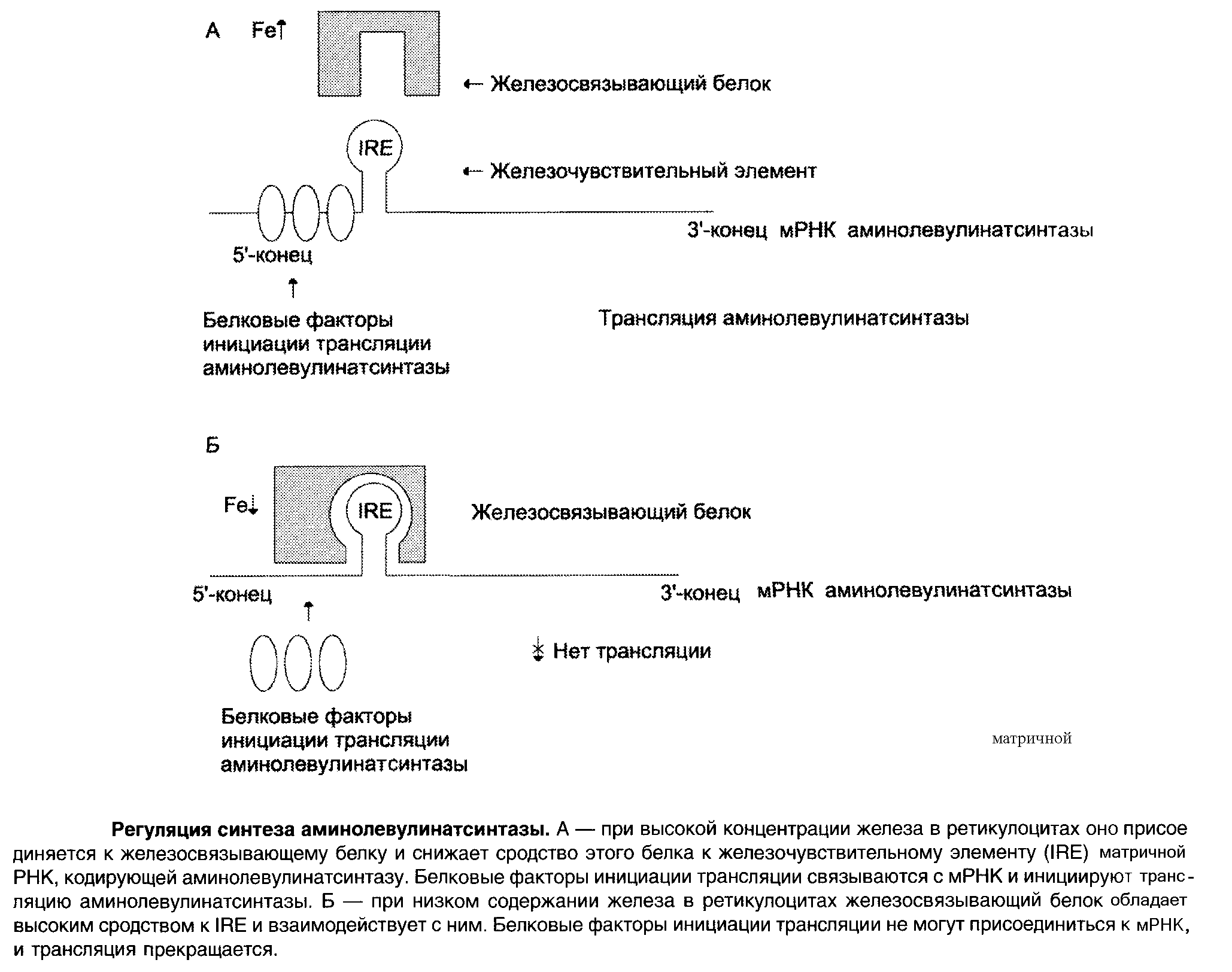
На уровне трансляции АЛК-синтазы регуляция осуществляется концентрацией железа.
В точке инициации мРНК АЛК-синтазы имеется шпилечная петля, которая называется железочувствительный элемент (IRE).
Регуляторный железосвязывающий белок при высокой концентрации железа связывается с железом и вызывает снижение сродства этого белка к IRE – элементу мРНК АЛК-синтетазы и продолжение трансляции.
При низких концентрациях железа увеличивается сродство железосвязывающего белка к IRE-элементу мРНК АЛК-синтетазы и трансляция аминолевупинатсинтетазы тормозится.
Недостаток ПФ и лекарства – аналоги ПФ снижают активность АЛК-синтетазы.
Стероиды, барбитураты, сульфаниламиды, эстрогены – индукторы синтеза АЛК.
 Нарушения синтеза гема – Порфирии
Нарушения синтеза гема – Порфирии
Порфирии – болезни, связанные с нарушением работы ферментов синтеза гема. Первичные порфирии обусловлены генетическими дефектами ферментов синтеза гема, вторичные связаны с нарушениями регуляции синтеза гема.
В зависимости от основной локализации патологического процесса различают печёночные и эритропоэтические наследственные порфирии. При этом эритропоэтические порфирии сопровождаются накоплением порфиринов в нормобластах и эритроцитах, а печёночные – в гепатоцитах.
Порфириногены не окрашены, но на свету они легко переходят в порфирины, которые проявляют красную флуоресценцию в ультрафиолетовых лучах.
В коже на солнце кислород реагирует с порфиринами и переходит в синглетное состояние. В этой форме он вызывает ПОЛ клеточных мембран и разрушение клеток, поэтому порфирии часто сопровождаются фотосенсибилизацией и изъязвлением открытых участков кожи.
Аминолевулинат и порфириногены являются нейротоксинами, что приводит к нейропсихическим расстройствам.
Приём лекарств – индукторов АЛК – синтетазы – сульфаниламидов, барбитуратов, диклофенака, вольтарена, стероидов, истогенов – может вызвать обострение порфирии.
В период полового созревания при повышении образования β-стероидов идёт индукция синтеза АЛК-синтетазы и проявляются симптомы порфирий.
Порфирии наблюдаются и при отравлении солями свинца, т.к. свинец ингибирует АЛК-дегидратазу и феррохелатазу.
Обмен железа
Источником железа для синтеза гема служат пищевые продукты и железо, освобождающееся при распаде эритроцитов.
В гем-содержащих белках железо находится в составе гема.
В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, рибонуклеотидредуктазу, ксантиноксидазу и др.
В организме взрослого человека содержится 3-4 г. железа.
В пище железо находится в окислённом состоянии (Fe+3). При кислом значении pH желудка железо выделяется из солей органических кислот.
Аскорбиновая кислота (Витамин С), содержащаяся в пище, восстанавливает железо и улучшает его всасывание и в клетки слизистой оболочки кишечника поступает железо в виде Fe+2.
Апоферритин в энтероцитах связывает железо и превращается в ферритин – запасную форму железа.
Железо по крови транспортируется трансферрином.
Трансферрин – гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe+3).
Поступающее в кровь железо окисляется ферментом феррооксидазой (церулоплазмином). Этом фермент содержит медь.
Трансферрин может соединиться с одним или двумя ионами Fe+3 одновременно с анионом , образуя комплекс трансферрин – 2 (Fe+3 - ).
Трансферрин взаимодействует со специфическими рецепторами клеток. В результате в цитозоле клетки образуется комплекс Ca+2 – кальмодулин – ПКС, который фосфорилирует рецептор трансферрина и вызывает образование эндосомы.
В эндосоме создаётся кислая среда при действии АТФ – зависимого протонного насоса. При этом железо освобождается из трансферрина.
Ферритин – олигомерный белок, состоит из 24 протолиров и служит для запасания железа в клетке. В разных тканях существуют его изоформы.
Ферритин имеет полость, внутри которой может содержаться до 4500 ионов Fe+3.
Fe+2 окисляют в Fe+3 тяжёлые цепи ферритина. Комплекс железа в виде гидрофосфата хранится внутри сферы, образованной белковой частью молекулы.
Наибольшая часть ферритина содержится в печени, селезёнке и костном мозге.

98. Белки сыворотки крови, биологическая роль основных фракций белков, значение их определения для диагностики заболевания. Ферменты плазмы крови, энзимодиагностика. Количественное определение активности аминотрансфераз (АЛТ, АСТ).
В плазме крови содержится 7% всех белков организма при концентрации 60 - 80 г/л. Белки плазмы крови выполняют множество функций. Одна из них заключается в поддержании осмотического давления, так как белки связывают воду и удерживают её в кровеносном русле.
- Белки плазмы образуют важнейшую буферную систему крови и поддерживают рН крови в пределах 7,37 - 7,43.
- Альбумин, транстиретин, транскортин, трансферрин и некоторые другие белки (табл. 14-2) вьшолняют транспортную функцию.
- Белки плазмы определяют вязкость крови и, следовательно, играют важную роль в гемодинамике кровеносной системы.
- Белки плазмы крови являются резервом аминокислот для организма.
- Иммуноглобулины, белки свёртывающей системы крови, α1-антитрипсин и белки системы комплемента осуществляют защитную функцию.
Методом электрофореза на ацетилцеллюлозе или геле агарозы белки плазмы крови можно разделить на альбумины (55-65%), α1-глобулины (2- 4%), α2 -глобулины (6-12%), β-глобулины (8-12%) и γ-глобулины (12-22%) (рис. 14-19).
Применение других сред для электрофоретического разделения белков позволяет обнаружить большее количество фракций. Например, при электрофорезе в полиакриламидном или крахмальном гелях в плазме крови выделяют 16-17 белковых фракций. Метод иммуноэлектрофореза, сочетающий электрофоретический и иммунологический способы анализа, позволяет разделить белки плазмы крови более чем на 30 фракций.
Большинство сывороточных белков синтезируется в печени, однако некоторые образуются и в других тканях. Например, γ-глобулины синтезируются В-лимфоцитами (см. раздел 4), пептидные гормоны в основном секретируют клетки эндокринных желёз, а пептидный гормон эритропоэтин - клетки почки.
Для многих белков плазмы, например альбумина, α1-антитрипсина, гаптоглобина, транс-феррина, церулоплазмина, α2-макроглобулина и иммуноглобулинов, характерен полиморфизм (см. раздел 4).
Почти все белки плазмы, за исключением альбумина, являются гликопротеинами. Олигосахариды присоединяются к белкам, образуя гликозидные связи с гидроксильной группой серина или треонина, или взаимодействуя с карбоксильной группой аспарагина. Концевой остаток олигосахаридов в большинстве случаев представляет собой N-ацетилнейраминовую кислоту, соединённую с галактозой. Фермент эндотелия сосудов нейраминидаза гидролизует связь между ними, и галактоза становится доступной для специфических рецепторов гепатоцитов. Путём эвддцитоза "состарившиеся" белки поступают в клетки печени, где разрушаются. Т1/2 белков плазмы крови составляет от нескольких часов до нескольких недель.
При ряде заболеваний происходит изменение соотношения распределения белковых фракций при электрофорезе по сравнению с нормой (рис. 14-20).
Такие изменения называют диспротеинемиями, однако их интерпретация часто имеет относительную диагностическую ценность. Например, характерное для нефротического синдрома снижение альбуминов, α1- и γ-глобулинов и увеличение α2- и β-глобулинов отмечают и при некоторых других заболеваниях, сопровождающихся потерей белков. При снижении гуморального иммунитета уменьшение фракции γ-глобулинов свидетельствует об уменьшении содержания основного компонента иммуноглобулинов - IgG, но не отражает динамику изменений IgA и IgM.
Содержание некоторых белков в плазме крови может резко увеличиваться при острых воспалительных процессах и некоторых других патологических состояниях (травмы, ожоги, инфаркт миокарда). Такие белки называют белками острой фазы, так как они принимают участие в развитии воспалительной реакции организма. Основной индуктор синтеза большинства белков острой фазы в гепатоцитах - полипептид интерлейкин-1, освобождающийся из мононуклеарных фагоцитов. К белкам острой фазы относят С-реактивный белок, называемый так, потому что он взаимодействует с С-полисахари-дом пневмококков, α1-антитрипсин, гаптоглобин, кислый гликопротеин, фибриноген. Известно, что С-реактивный белок может стимулировать

Рис. 14-19. Электрофореграмма (А) и денситограмма (Б) белков сыворотки крови.

Рис. 14-20. Протеинограммы белков сыворотки крови. а - в норме; б - при нефротическом синдроме; в - при гипогаммаглобулинемии; г - при циррозе печени; д - при недостатке α1-антитрипсина; е - при диффузной гипергаммаглобулинемии.
систему комплемента, и его концентрация в крови, например, при обострении ревматоидного артрита может возрастать в 30 раз по сравнению с нормой. Белок плазмы крови а,-антитрипсин может инактивировать некоторые протеазы, освобождающиеся в острой фазе воспаления.
Содержание некоторых белков в плазме крови и их функции представлены в таблице 14-2.
Альбумин.Концентрация альбумина в крови составляет 40-50 г/л. В сутки в печени синтезируется около 12 г альбумина, Т1/2 этого белка - примерно 20 дней. Альбумин состоит из 585 аминокислотных остатков, имеет 17 дисульфидных связей и обладает молекулярной массой 69 кД. Молекула альбумина содержит много дикарбоновых аминокислот, поэтому может удерживать в крови катионы Са2+, Cu2+, Zn2+. Около 40% альбумина содержится в крови и остальные 60% в межклеточной жидкости, однако его концентрация в плазме выше, чем в межклеточной жидкости, поскольку объём последней превышает объём плазмы в 4 раза.
Благодаря относительно небольшой молекулярной массе и высокой концентрации альбумин обеспечивает до 80% осмотического давления плазмы. При гипоальбуминемии осмотическое давление плазмы крови снижается. Это приводит к нарушению равновесия в распределении внеклеточной жидкости между сосудистым руслом и межклеточным пространством. Клинически это проявляется как отёк. Относительное снижение объёма плазмы крови сопровождается снижением почечного кровотока, что вызывает стимуляцию системы ренинангиотензинальдрстерон, обеспечивающей восстановление объёма крови (см. раздел 11). Однако при недостатке альбумина, который должен удерживать Na+, другие катионы и воду, вода уходит в межклеточное пространство, усиливая отёки.
Гипоальбуминемия может наблюдаться и в результате снижения синтеза альбуминов при заболеваниях печени (цирроз), при повышении проницаемости капилляров, при потерях белка из-за обширных ожогов или катаболических состояний (тяжёлый сепсис, злокачественные новообразования), при нефротическом синдроме, сопровождающемся альбуминурией, и голодании. Нарушения кровообращения, характеризующиеся замедлением кровотока, приводят к увеличению поступления альбумина в межклеточное пространство и появлению отёков. Быстрое увеличение проницаемости капилляров сопровождается резким уменьшением объёма крови, что приводит к падению АД и клинически проявляется как шок.
Альбумин - важнейший транспортный белок. Он транспортирует свободные жирные кислоты (см. раздел 8), неконъюгированный билирубин (см. раздел 13), Са2+, Сu2+, триптофан, тироксин и трийодтиронин (см. раздел 11). Многие лекарства (аспирин, дикумарол, сульфаниламиды) связываются в крови с альбумином. Этот факт необходимо учитывать при лечении заболеваний, сопровождающихся гипоальбуминемией, так как в этих случаях повышается концентрация свободного лекарства в крови. Кроме того, следует помнить, что некоторые лекарства могут конкурировать за центры связывания в молекуле альбумина с билирубином и между собой.
Транстиретин(преальбумин) называют тирок-синсвязывающим преальбумином. Это белок острой фазы. Транстиретин относят к фракции альбуминов, он имеет тетрамерную молекулу. Он способен присоединять в одном центре связывания ретинолсвязывающий белок, а в другом - до двух молекул тироксина и трийодтиронина.
Таблица 14-2. Содержание и функции некоторых белков плазмы крови
| Группа | Белки | Концентрация в сыворотке крови, г/л | Функция |
| Альбумины | Транстиретин | 0,25 | Транспорт тироксина и трийодтиронина |
| Альбумин | Поддержание осмотического давления, транспорт жирных кислот, билирубина, жёлчных кислот, стероидных гормонов, лекарств, неорганических ионов, резерв аминокислот | ||
| α1-Глобулины | α1 -Антитрипсин | 2,5 | Ингибитор протеиназ |
| ЛПВП | 0,35 | Транспорт холестерола | |
| Протромбин | 0,1 | Фактор II свёртывания крови | |
| Транскортин | 0,03 | Транспорт кортизола, кортикостерона, прогестерона | |
| Кислый α1-гликопротеин | Транспорт прогестерона | ||
| Тироксинсвязывающий глобулин | 0,02 | Транспорт тироксина и трийодтиронина | |
| α2-Глобулины | Церулоплазмин | 0,35 | Транспорт ионов меди, оксидоредуктаза |
| Антитромбин III | 0,3 | Ингибитор плазменных протеаз | |
| Гаптоглобин | Связывание гемоглобина | ||
| α2-Макроглобулин | 2,6 | Ингибитор плазменных протеиназ, транспорт цинка | |
| Ретинолсвязыва-ющий белок | 0,04 | Транспорт ретинола | |
| Витамин D связывающий белок | 0,4 | Транспорт кальциферола | |
| β-Глобулины | ЛПНП | 3,5 | Транспорт холестерола |
| Трансферрин | Транспорт ионов железа | ||
| Фибриноген | Фактор I свёртывания крови | ||
| Транскобаламин | 25×10-9 | Транспорт витамина B12 | |
| Глобулин связывающий белок | 20×10-6 | Транспорт тестостерона и эстрадиола | |
| С-реактивный белок | <0,01 | Активация комплемента | |
| γ-Глобулины | IgG | Поздние антитела | |
| IgA | 3,5 | Антитела, защищающие слизистые оболочки | |
| IgM | 1,3 | Ранние антитела | |
| IgD | 0,03 | Рецепторы В-лимфоцитов | |
| IgE | <0,01 | Реагин |
Соединение с этими лигандами происходит независимо друг от друга. В транспорте последних транстиретин играет существенно меНbшую роль по сравнению с тироксинсвязывающим глобулином.
α1 - Антитрипсинотносят к α1-глобулинам. Он ингибирует ряд протеаз, в том числе фермент эластазу, освобождающийся из нейтрофилов и разрушающий эластин альвеол лёгких. При недостаточности α1-антитрипсина могут возникнуть эмфизема лёгких (см. раздел 15) и гепатит, приводящий к циррозу печени. Существует несколько полиморфных форм α1-антитрипсина, одна из которых является патологической. У людей, гомозиготных по двум дефектным аллелям гена антитрипсина, в печени синтезируется α1-антитрипсин, который образует агрегаты, разрушающие гепатоциты. Это приводит к нарушению секреции такого белка гепатоцитами и к снижению содержания α1-антитрипсина в крови.
Гаптоглобинсоставляет примерно четверть всех α2-глобулинов. Гаптоглобин при внутрисосудистом гемолизе эритроцитов образует комплекс с гемоглобином, который разрушается в клетках РЭС. Если свободный гемоглобин, имеющий молекулярную массу 65 кД, может фильтроваться через почечные клубочки или агрегировать в них, то комплекс гемоглобин-гаптоглобин имеет слишком большую молекулярную массу (155 кД), чтобы пройти через гломерулы. Следовательно, образование такого комплекса предотвращает потери организмом железа, содержащегося в гемоглобине. Определение содержания гаптоглобина имеет диагностическое значение, например, снижение концентрации гаптоглобина в крови наблюдают при гемолитической анемии. Это объясняют тем, что при Т1/2 гаптоглобина, составляющем 5 дней, и Т1/2 комплекса гемоглобин - гаптоглобин (около 90 мин) увеличение поступления свободного гемоглобина в кровь при гемолизе эритроцитов вызовет резкое снижение содержания свободного гаптоглобина в крови.
Гаптоглобин относят к белкам острой фазы, его содержание в крови повышается при острых воспалительных заболеваниях.
Информация о некоторых других белках плазмы крови, представленных в табл. 14-2, имеется в соответствующих разделах учебника.
Энзимодиагностика
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
- при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток;
- количество высвобождаемого фермента достаточно для его обнаружения;
- активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени И отличается от нормальных значений;
- ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
- существуют различия во внутриклеточной локализации ряда ферментов.
1. Причины, приводящие к увеличению количества
ферментов в крови
Ферменты плазмы крови можно разделить на 2 группы. Первая, относительно небольшая группа ферментов активно секретируется в плазму крови определёнными органами. Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их
нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, так как постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения.
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе). Определение в крови активности ряда ферментов хорошо налажено в биохимических лабораториях, что используют для диагностики заболеваний сердца, печени, скелетной мускулатуры и других тканей. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов. Так, появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе.
Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе (способности вьпюдиться почками) наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей.
Изоферменты
Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изофермен-тами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов.
По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой - изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
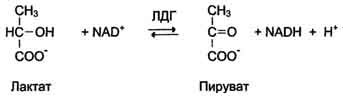
Изоформы лактатдегидрогеназы.Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты) (см. раздел 7).
Лактатдегидрогеназа- олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle -мышца) и Н (от англ, heart- сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
- Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ (рис. 2-35, Б).
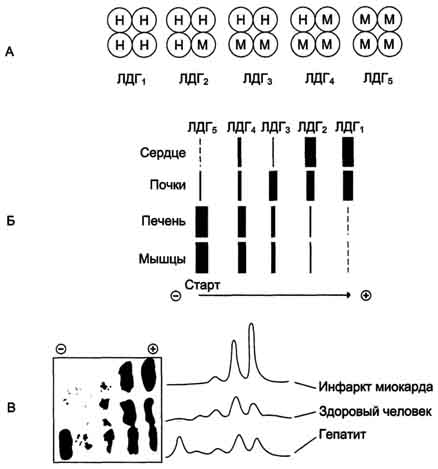
Рис. 2-35. Изоформы лактатдегидрогеназы. А - строение различных изоформ ЛДГ; Б - распределение на электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В - содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы - слева и фотометрическое сканирование - справа).
- Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (М-типы ЛДГ) работают эффективно в анаэробных условиях, ЛДГ, и ЛДГ2 (Н-типы) - в аэробных, когда пируват быстро окисляется до СО2 и Н2О, а не восстанавливается до молочной кислоты.
- При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет 170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей.
- Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2-35, В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифичес-ких изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани.
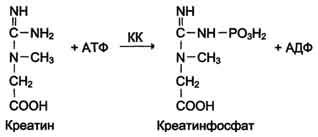
Изоформы креатинкиназы.Креатинкиназа (КК) катализирует реакцию образования креатинфосфата:
Молекула КК - димер, состоящий из субъединиц двух типов: М (от англ, muscle -мышца) и В (от англ, brain -мозг). Из этих субъединиц образуются 3 изофермента - ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и MB - в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2-36).
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
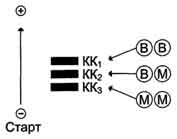
Рис. 2-36. Структура и электрофоретическая подвижность различных изоформ креатинкиназы.
