Четвертичная структура гемоглобина
Четыре полипептидные цепи, соединённые вместе, образуют почти правильную форму шара, где каждая ?-цепь контактирует с двумя ?-цепями (рис. 1-32).
Так как в области контакта между ?1- и ?1-, а также между ?2- и ?2-цепями находится много гидрофобных радикалов, то между этими полипептидными цепями формируется сильное соединение за счёт возникновения в первую очередь гидрофобных, а также ионных и водородных связей. В результате образуются димеры ?1?1, и ?2?2. Между этими димерами в тетрамерной молекуле гемоглобина возникают в основном полярные (ионные и водородные) связи, поэтому при изменении рН среды в кислую или щелочную сторону в первую очередь разрушаются связи между димерами. Кроме того, димеры способны легко перемещаться относительно друг друга.
Так как поверхность протомеров неровная, полипептидные цепи в центральной области не могут плотно прилегать друг к другу, в результате в центре формируется "центральная полость", проходящая сквозь всю молекулу гемоглобина.
3. Связывание гемоглобина с О2в лёгких
и его диссоциация из комплекта в тканях
Основная функция гемоглобина - доставка О2 от лёгких к тканям. Олигомерная структура гемоглобина обеспечивает быстрое насыщение его кислородом в лёгких (образование оксигемоглобина - Нb(О2)4), возможность отщепления кислорода от гемоглобина в капиллярах тканей при относительно высоком парциальном давлении О2, а также возможность регуляции сродства гемоглобина к О2 в зависимости от потребностей тканей в кислороде.
Кооперативные изменения конформации протомеров
О2 связывается с протомерами гемоглобина через Fe2+ , который соединён с четырьмя атомами азота пиррольных колец тема и атомом азота
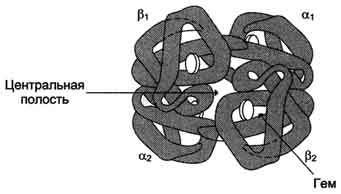
Рис. 1-32. Строение гемоглобина.
Гис F8 белковой части протомера. Связывание О2 с оставшейся свободной координационной связью Fe2+ происходит по другую сторону от плоскости гема в области Гис Е7 (аналогично тому, как это происходит у миоглобина). Гис Е7 не взаимодействует с О2, но обеспечивает оптимальные условия для его связывания (рис. 1-33).
В дезоксигемоглобине благодаря ковалентной связи с белковой частью атом Fe2+ выступает из плоскости гема в направлении Гис F8. Присоединение О2 к атому Fe2+ одного протомера вызывает его перемещение в плоскость гема, за ним перемещаются остаток Гис F8 и полипептидная цепь, в состав которой он входит. Так как протомер связан с остальными протомерами, а белки обладают конформационной лабильностью, происходит изменение конформации всего белка. Конформационные изменения, произошедшие в других протомерах, облегчают присоединение следующей молекулы О2, что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы О2. Четвёртая молекула О2 присоединяется к гемоглобину в 300 раз легче, чем первая молекула (рис. 1-34).
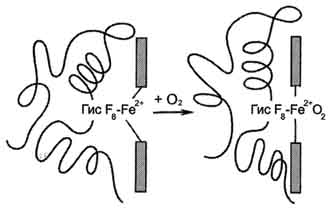
Рис. 1-33. Изменение прложения Fe2+ и белковой части гемоглобина при присоединении О2.
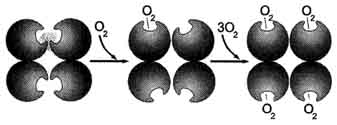
Рис. 1-34. Кооперативные изменения конформации протомеров гемоглобина при присоединении О2.
Изменение конформации (а следовательно и функциональных свойств) всех протомеров олигомерного белка при присоединении лиганда только к одному из них носит название кооперативных изменений конформации протомеров.
Аналогичным образом в тканях диссоциация каждой молекулы О2 изменяет конформацию всех протомеров и облегчает отщепление последующих молекул О2.
Кривые диссоциации О2 для миоглобина и гемоглобина
Кооперативность в работе протомеров гемоглобина можно наблюдать и на кривых диссоциации О2 для миоглобина и гемоглобина (рис. 1-35).
Отношение занятых О2 участков связывания белка к общему числу таких участков, способных к связыванию, называется степенью насыщения этих белков кислородом. Кривые диссоциации показывают, насколько насыщены данные белки О2 при различных значениях парциального давления кислорода.
Кривая диссоциации О2 для миоглобина имеет вид простой гиперболы. Это указывает на то, что миоглобин обратимо связывается с лигандом, и на это не оказывают влияние никакие посторонние факторы (схема ниже).
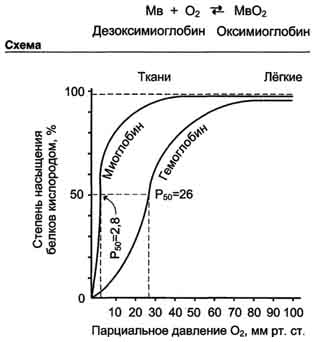
Рис. 1-35. Кривые диссоциации кислорода для миоглобина и гемоглобина в зависимости от парциального давления кислорода.
Процессы образования и распада оксимиоглобина находятся в равновесии, и это равновесие смещается влево или вправо в зависимости от того, добавляется или удаляется кислород из системы. Миоглобин связывает кислород, который в капиллярах тканей высвобождает гемоглобин, и сам миоглобин может освобождать О2 в ответ на возрастание потребностей в нём мышечной ткани и при интенсивном использовании О2 в результате физической нагрузки.
Миоглобин имеет очень высокое сродство к О2. Даже при парциальном давлении О2, равном 1-2 мм рт. ст., миоглобин остаётся связанным с О2 на 50%.
Кривая диссоциации О2 для гемоглобина. Из графика на рис. 1-35 видно, что гемоглобин имеет значительно более низкое сродство к О2; полунасыщение гемоглобина О2 наступает при более высоком давлении О2 (около 26 мм рт. ст.).
Кривая диссоциации для гемоглобина имеет сигмоидную форму (S-образную). Это указывает на то, что протомеры гемоглобина работают кооперативно: чем больше О2 отдают протомеры, тем легче идёт отщепление последующих молекул О2.
В капиллярах покоящихся мышц, где давление О2 составляет около 40 мм рт. ст., большая часть кислорода возвращается в составе оксигемоглобина обратно в лёгкие. При физической работе давление О2 в капиллярах мышц падает до 10-20 мм рт. ст. Именно в этой области (от 10 до 40 мм рт. ст.) располагается "крутая часть" S-образной кривой, где в наибольшей степени проявляется свойство кооперативной работы протомеров.
Следовательно, благодаря уникальной структуре каждый из рассмотренных белков приспособлен выполнять свою функцию: миоглобин - присоединять О2, высвобождаемый гемоглобином, накапливать в клетке и отдавать в случае крайней необходимости; гемоглобин - присоединять О2 в лёгких, где его насыщение доходит до 100%, и отдавать О2 в капиллярах тканей в зависимости от изменения в них давления О2
4. Перенос Н+и С02из тканей в лёгкие
с помощью гемоглобина. Эффект Бора
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада - СО2 и Н2О, количество которых пропорционально интенсивности процессов окисления. СО2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента карбангидразы происходит увеличение скорости образования Н2СО3. Слабая угольная кислота может диссоциировать на Н+и НСО3-
СО2 + Н2О - H2CO 3 - H+ + HCO3-.
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух ?-цепей, радикалам Гис122 и концевым ?-аминогруппам двух ?-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём (рис. 1-36, А). Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О - Н2СО3 - Н+ + НСО3- сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом (рис. 1-36, Б).
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани (рис. 1-37).
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3-. Небольшое количество
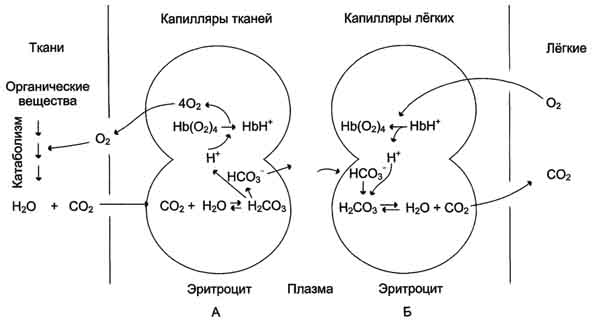
Рис. 1-36. Перенос Н+ и СО2 с кровью. Эффект Бора. А - влияние концентрации СО2 и Н+ на высвобождение О2 из комплекса с гемоглобином в тканях (эффект Бора); Б - оксигенирование дезоксигемоглобина в лёгких, образование и выделение СО2.
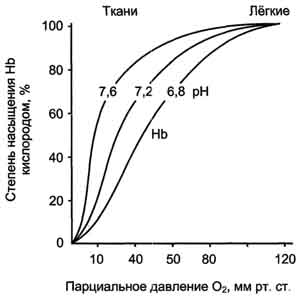
Рис. 1-37. Влияние рН на кривую диссоциации О2 для гемоглобина.
СО2 (около 15-20%) может переноситься в лёгкие, обратимо присоединяясь к неионизированным концевым ?-аминогруппам. R-NH2+ СО2 = R-NH-COO + Н+, в результате образуется карбогемоглобин, где R - полипептидная цепь гемоглобина. Присоединение СО2 к гемоглобину также снижает его сродство к О2.
5. 2,3-Бифосфоглицерат - аллостертеский регулятор сродства гемоглобина к О2
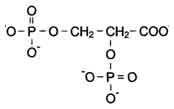
2,3-Бифосфоглицерат (БФГ) - вещество, синтезируемое в эритроцитах из промежуточного продукта окисления глюкозы 1,3-бифосфоглицерата.
Бифосфоглицерат
Регуляция с помощью 2,3-бифосфоглицерата сродства гемоглобина к О2
В нормальньж условиях 2,3-бифосфоглицерат присутствует в эритроцитах примерно в той же концентрации, что и гемоглобин. БФГ, присоединяясь к гемоглобину, также может менять его сродство к О2.
В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров.
Центральная полость - место присоединения БФГ.
Размеры центральной полости могут меняться: отщепление О2 от оксигемоглобина вызывает его конформационные изменения, которые способствуют образованию дополнительных ионных связей между димерами ?1?1 и ?2?2. В результате пространственная структура дезоксигемоглобина становится более жёсткой, напряжённой, а центральная полость расширяется.
Поверхность полости ограничена остатками аминокислот, в числе которых имеются положительно заряженные радикалы Лиз82, Гис143 ?-цепей и положительно заряженные ?-аминогруппы N-концевого валина ?-цепей. В расширенную полость дезоксигемоглобина БФГ, имеющий сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух ?-цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дезоксигемоглобина и снижает сродство белка к О2 (рис. 1-38).
Присоединение БФГ к дезоксигемоглобину происходит в участке, ином по сравнению с ге-мом, где происходит связывание О2. Такой лиганд называется "аллостерический", а центр, где связывается аллостерический лиганд, - "аллостерический центр" (от греч. "аллос" - другой, иной, "стерос" - пространственный).
В лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина. Разрыв
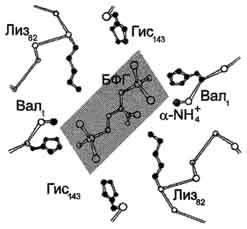
Рис. 1-38. Взаимодействие 2,3-бифосфоглицерата с аминокислотными остатками центральной полости дезоксигемоглобина.
ионных связей между димерами ?1?1 и ?2?2 приводит к "расслаблению" белковой молекулы, уменьшению центральной полости и вытеснению БФГ.
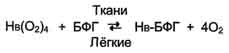
Изменение концентрации БФГ как механизм адаптации организма к гипоксии. Концентрация БФГ в эритроцитах людей, живущих в определённых климатических условиях, - величина постоянная. Однако в период адаптации к высокогорью, когда человек поднимается на высоту более 4000 м над уровнем моря, концентрация БФГ уже через 2 дня возрастает почти в 2 раза (от 4,5 до 7,0 мМ). Это снижает сродство гемоглобина к О2 и увеличивает количестве О2, транспортируемого в ткани (рис. 1-39).
Такую же адаптацию наблюдают у больных с заболеваниями лёгких, при которых развивается общая гипоксия тканей. Так, у больных с тяжёлой обструктивной эмфиземой лёгких парциальное давление в них снижается от 100 до 50 мм рт. ст. Но при этом в эритроцитах усиливается выработка БФГ, и его концентрация повышается с 4,5 до 7,0 мМ, что существенно увеличивает доставку О2 в ткани.
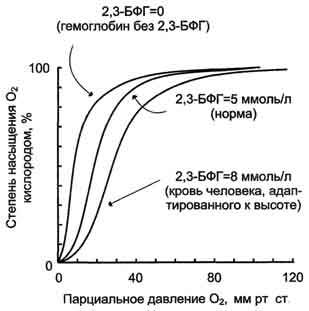
Рис. 1-39. Влияние различных концентраций 2,3-бифосфоглицерата на сродство гемоглобина к О2.
