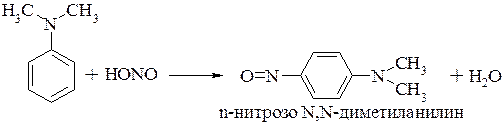Глава 19. Нитросоединения и Амины. Диазо- и азосоединения
Нитросоединения
Нитросоединения – это производные углеводородов, в которых атом водорода замещён на нитрогруппу.
Нитрогруппа представляет собой самостоятельную азотсодержащую функцию. В ней оба атома кислорода равноценны, а атом азота – однозаряден и четырёхвалентен:
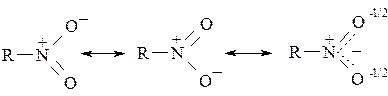
Способы получения
Как алифатические, так и ароматические нитросоединения удобно получать прямым нитрованием алканов и аренов, о чём подробно говорилось в разделах 5.3 и 10.3.1. В общем виде реакцию нитрования можно представить:
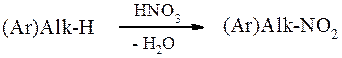
Реакция прямого нитрования алканов проходит по свободнорадикальному механизму – SR, а аренов – по электрофильному механизму – SE.
Алифатические нитросоединения удобно получать действием нитритов (чаще всего серебра) на галогеналкан:

Путём подбора растворителей, в среде которых протекает реакция, можно повысить выход нитроалкана.
Из ароматических диазосоединений удобно получать нитросоединения в тех случаях, когда их нельзя получить прямым нитрованием. Диазогруппа легко замещается на нитрогруппу с помощью нитрит-иона:
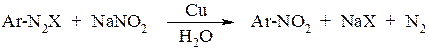
Химические свойства
Таутомерия нитроалканов и кислотность
Первичные и вторичные алифатические нитросоединения характеризуются СН-кислотностью, что связано с сильно выраженным –I-эффектом нитрогруппы. Эти особенности создают условия для существования аци-форм нитроалканов:

Из двух таутомерных форм более стабильной и преобладающей является нитроформа. Например, для нитрометана концентрация аци-формы не превышает 1∙10-7.
Кислотность мононитроалканов сравнима с кислотностью фенолов, однако она возрастает с увеличением числа нитрогрупп, связанных с одним углеродным атомом:
CH3NO2 O2N–CH2–NO2 H–C(NO2)3
pKα=10,2 pKα=4,0 pKα≈0,15
Анион нитроалкана подобно енолят-аниону является амбидентныманионом, поэтому для него характерными являются галогенирование, нитрозирование, алкилирование, реакции конденсации с карбонильными соединениями, а также аминометилирование (реакция Манниха), присоединение к α,β-непредельным соединениям, восстановление.
Галогенирование нитроалканов в присутствии оснований протекает легко по СН-кислотному центру:
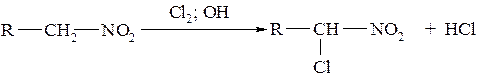
При нитрозировании образуются нитрозонитроалканы, которые далее изомеризуются в нитроновые кислоты:
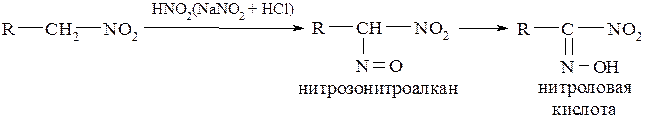
Взаимодействие с алкилирующими агентами может происходить в направлении О-алкилирования и С-алкилирования, что можно регулировать соответствующими условиями:
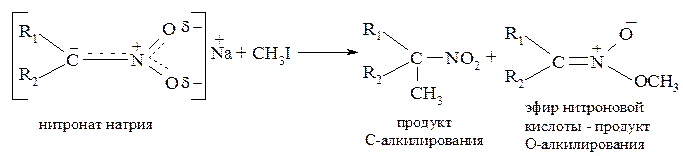
Первичные и вторичные нитроалканы в щелочной среде вступают в реакции конденсации с альдегидами и кетонами. В данной реакции участвует анион нитроалкана, поскольку кислотность нитроалканов гораздо выше, чем у альдегидов и кетонов. Если в реакции участвует ароматическое оксосоединение, то промежуточный вторичный спирт легко отщепляет воду, с образованием непредельного соединения:
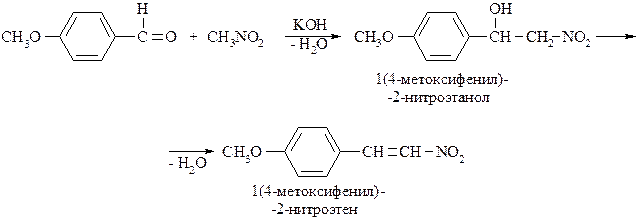
Нитроалканы взаимодействуют с первичными и вторичными аминами и формальдегидом с образованием аминометильных производных. Аминометильная группа замещает водород в СН–кислотном центре. Эта реакция называется аминометилированием:
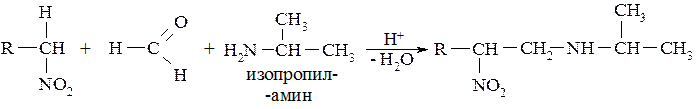 Первичные и вторичные нитроалканы способны присоединятся к активированной двойной связи α,β-непредельных карбонильных соединений:
Первичные и вторичные нитроалканы способны присоединятся к активированной двойной связи α,β-непредельных карбонильных соединений:
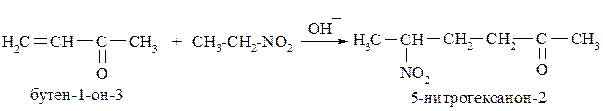
При восстановлении нитроалканов и нитроаренов образуются соответствующие алкил– или ариламины:
(Ar)Alk–NO2 + 6H → (Ar)Alk–NH2 + H2O.
Водород в момент выделения можно получать либо действием кислоты на металл, либо раствором щёлочи на амфотерные металлы (Zn, Sn и др.).
Впервые восстановление нитробензола до анилина было осуществлено выдающимся отечественным химиком Н.Н. Зининым в 1842 году по реакции:
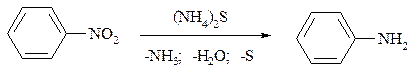
С использованием сульфида аммония в качестве восстановителя впервые были получены не только анилин, но и 2-нафтиламин и м-аминобензойная кислота.
Восстановление нитросоединений в соответствующие амины можно осуществлять действием не только сульфидов, но и самого сероводорода:
R–NO2 + 3H2S → R–NH2 + 3S + H2O.
Восстановление нитроаренов, как и нитроалканов, в кислой среде на первой стадии осуществляется присоединением двух электронов (Н – е–→ Н+) и завершается образованием нитрозопроизводного:
С6Н5–NO2 + 2e– + 2H+ → С6Н5–NO + H2O
нитрозобензол
Нитрозобензол восстанавливается до фенилгидроксиламина, который далее восстанавливается до анилина:
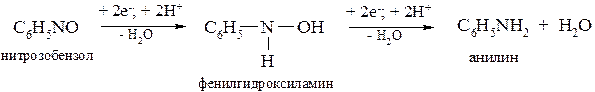
Суммарно: C6H5NO2 + 6H → C6H5NH2 + 2H2O
В щелочной среде нитрозобензол восстанавливается очень медленно, поэтому в реакционной среде накапливаются нитрозобензол и фенилгидроксиламин. Щёлочь в данном случае является катализатором реакции:
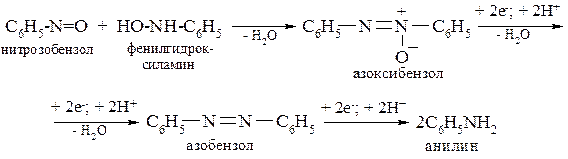
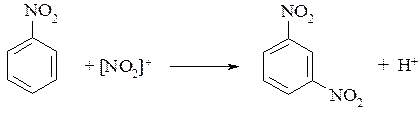
Для ароматических нитросоединений характерны реакции электрофильного замещения по ароматическому ядру (подробно см. раздел 10.3.2):
Нитроарены могут вступать также в реакции нуклеофильного замещения. Характерно, что более активными являются динитропроизводные, у которых нитрогруппы находятся в о- и п-положениях. В этом случае одна из нитрогрупп способна замещаться на гидроксигруппу:
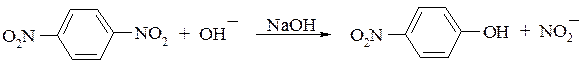
Амины
Амины – это производные аммиака, у которого атомы водорода замещены на углеводородные радикалы.
В зависимости от числа углеводородных радикалов различают первичные, вторичные и третичные амины.
Другая группа соединений в этом же ряду – это замещённые соли аммония, которые включают следующие типы соединений: [RN+H3]X–; [R1R2N+H2]X–; [R1R2R3N+H]X–; [R1R2R3R4N+]X–.
Группа –NH2 называется аминогруппой.
По радикально-функциональной номенклатуре простейшие амины можно называть по числу радикалов, связанных с атомом азота с добавлением суффикса «амин»:
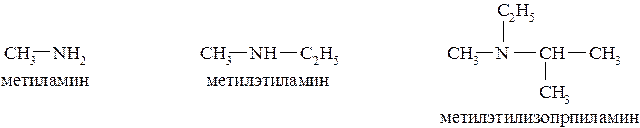
Очень удобной системой названий для аминов является та, которая соответствует номенклатуре ИЮПАК: суть её заключается в том, что она аналогична номенклатуре спиртов, только в данном случае к названию соответствующего углеродоводорода добавляют окончание «амин»:
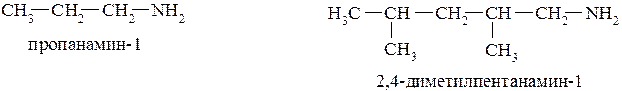
В случае вторичных и третичных аминов названия формируются таким образом, чтобы вначале выбрать наиболее длинную цепь углеродных атомов как основного соединения. Остальные заместители при атоме азота указываются с префиксом N–:
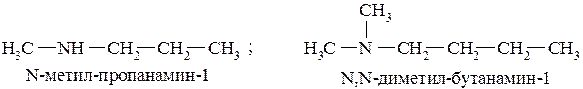

В некоторых случаях для NH2-группы (первичные амины) допускается использование префикса «амино».
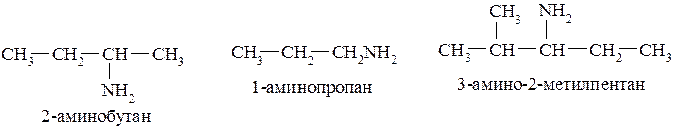 Вторичные и третичные амины в этом случае называют так, чтобы префикс включал радикал с наибольшей цепью углеродных атомов:
Вторичные и третичные амины в этом случае называют так, чтобы префикс включал радикал с наибольшей цепью углеродных атомов:
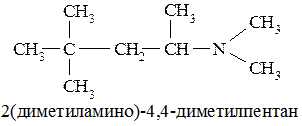
Способы получения аминов
В предыдущих главах при изучении свойств органических молекул рассматривались реакции, с помощью которых могут быть получены амины. Эти реакции приведены ниже:
1. Взаимодействием алкилгалогенидов с аммиаком или аминами (реакция аммонолиза).
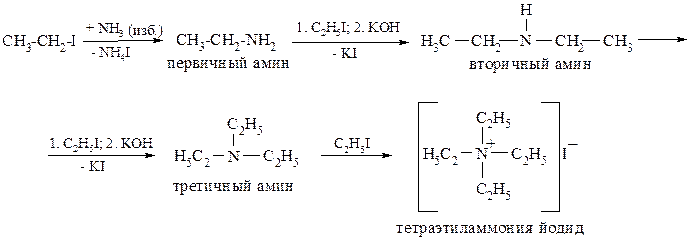
2. Восстановительным аминированием альдегидов или кетонов:
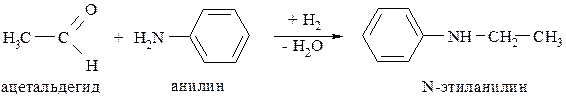
3. Восстановлением нитросоединений:
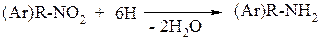
4. Восстановлением амидов кислот:
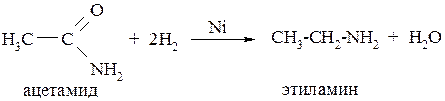
5. Восстановлением оксимов:
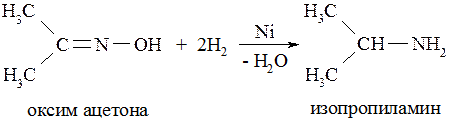
6. Восстановлением нитрилов:
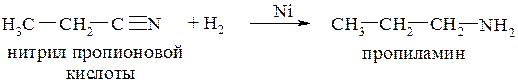
7. Расщеплением амидов кислот по Гофману:
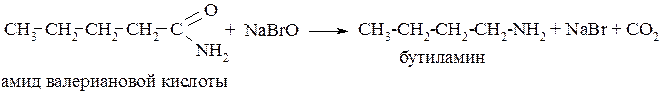
Физические свойства
Метиламин, диметиламин и триметиламин являются газами, этиламин, диэтиламин и триэтиламин – низкокипящие жидкости. По мере увеличения молекулярной массы аминов температуры кипения повышаются и уменьшается растворимость в воде.
Если сравнить между собой температуры кипения первичных вторичных и третичных аминов с таким же параметром спиртов и карбоновых кислот, то окажется, что у аминов она значительно ниже:
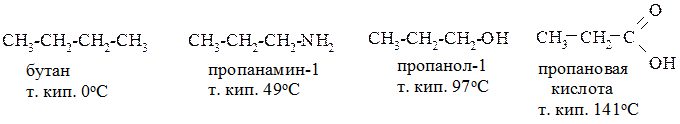
Строение
Молекула аммиака имеет форму правильной пирамиды с атомом азота в вершине:
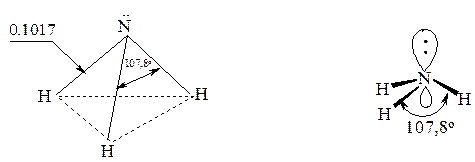
Считается, что атом азота находится в состоянии sp3-гибридизации, и неподеленная электронная пара располагается на sp3-гибридной орбитали.
Аналогичное электронное строение характерно для аминов, с той лишь разницей, что длины связей и валентные углы несколько искажены по сравнению с аммиаком. Сопоставляя между собой аммиак и амины, можно легко убедиться, что при наличии трех разных заместителей при атоме азота молекулу нельзя совместить с его зеркальным отображением, т.е. она может существовать в виде пары энантиомеров.
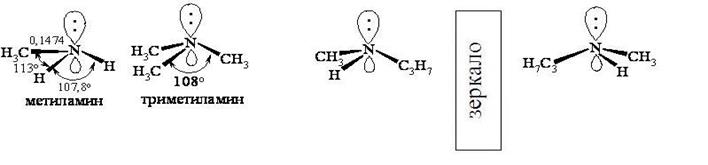
Здесь следует учесть, что в воображаемом тетраэдре три вершины заняты разными заместителями, а четвертую вершину занимает орбиталь с неподеленной электронной парой, которая выполняет роль четвертого заместителя. Такой теоретический вывод реального подтверждения не находит поскольку энантиомеры такого рода просто не могут существовать. Причиной этому является тот факт, что подобная конфигурация является очень подвижной и поэтому становится возможным переход одной конфигурации в другую путем инверсии молекулы.
В данном контексте под инверсией следует понимать изменение свойств системы на противоположные.
У аммиака инверсия осуществляется очень быстро: частота событий составляет 109 секунду (быстрая инверсия):
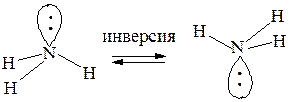
У алкиламинов скорость инверсии уменьшается, поскольку энергетический барьер перехода увеличивается. Однако инверсия все же происходит легко, а выделить оптически активные энантиомеры невозможно.
В стереохимическом отношении полным аналогом тетраэдрического асимметрического атома углерода является атом азота в четырехзамещенных солях аммония:
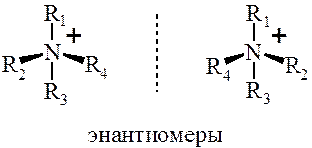
Химические свойства аминов
Основность. Амины как производные аммиака характеризуются не только нуклеофильными, но и основными свойствами, что обусловлено наличием неподеленной электронной пары на аминном атоме азота.
Как нуклеофильность, так и основность сильно зависят от электронной плотности на атоме азота: они уменьшаются с уменьшением электронной плотности или при экранировании атома азота и увеличиваются с увеличением электронной плотности.
Электронный и пространственный факторы могут конкурировать между собой, что наглядно проявляется на примере метиламинов: в водных растворах основность уменьшается в следующей последовательности:
(CH3)2NH > CH3 – NH2 > (CH3)3N
Известно, что метильная группа характеризуется +I-эффектом, поэтому основность диметиламина выше, чем у метиламина (а метиламин более сильное основание, чем аммиак).
Казалось бы, что триметиламин в водных растворах должен проявлять более сильные основные свойства, чем метиламин и диметиламин. Однако в действительности наблюдается обратная картина, поскольку преобладающим фактором в этом случае является не электронный эффект (+I-эффект трех CH3-групп), а пространственный: атом азота сильно экранирован тремя объемными метильными группами, что затрудняет присоединение протона с последующей сольватацией третичного амина.
В газовой фазе основность аминов изменяется в такой последовательности:
(CH3)3N > (CH3)2NH > CH3NH2 > NH3
Анилин является гораздо более слабым основанием, поскольку орбиталь с неподеленной парой электронов участвует в р,π-сопряжении с ароматическим ядром:
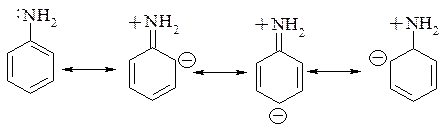
Именно за счёт резонансной стабилизации основность анилина гораздо ниже по сравнению с аммиаком и алифатическими аминами.
Будучи более сильными основаниями, чем вода, амины способны в водных растворах повышать концентрацию гидроксид-анионов:
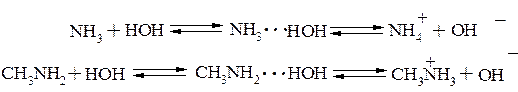
Амины как и аммиак превращаются в соли при действии минеральных кислот и легко вытесняются из солей при действии гидроксид – аниона
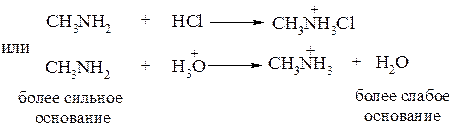
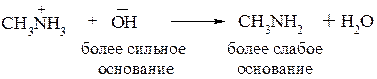
Полярность связи N–H обусловлена различной электроотрицательностью этих атомов. По этой причине атом водорода в первичных и вторичных аминах способен отщепляться в виде иона Н+, что свидетельствует об их NH–кислотности. Первичные и вторичные амины являются более слабыми кислотами, чем спирты. Данные свойства аминов проявляются лишь в присутствии сильных оснований.
При отщеплении протона от амина образуются амид-анионы:
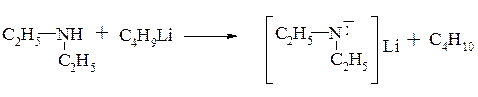
Нуклеофильные свойства аминов обусловлены также наличием неподеленной электронной пары: как активные нуклеофилы они взаимодействуют с различными электрофильными центрами, что ранее уже было рассмотрено в предыдущих главах:
алкилирование аминов (разд. 11.3.1.)
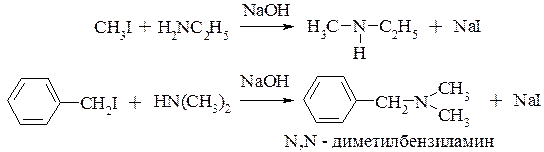
получение амидов кислот (реакции ацилирования) (разд. 17.3.2.)
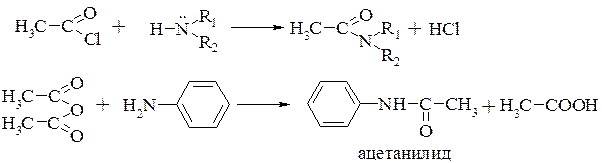
взаимодействие с альдегидами и кетонами с образованием N-замещенных иминов (разд. 16.3.1.5.)
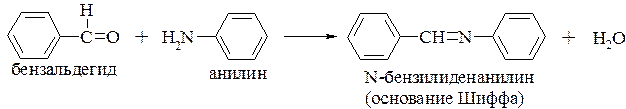
Изонитрильная реакция. Качественной реакцией на первичные амины является образование изонитрила (карбиламина). Все первичные амины взаимодействуют с хлороформом в щелочной среде:

Образующиеся изонитрилы имеют крайне неприятный запах и высоко-токсичны.
Строение изонитрила можно представить двумя предельными структурами:
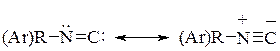
Таким образом, изонитрилы представляют собой линейные диполярные структуры с семиполярной связью.
Реакции аминов с азотистой кислотой.
Амины по-разному реагируют с азотистой кислотой HONO. Как известно, эта кислота крайне неустойчива и в свободном виде не существует. Поэтому ее получают непосредственно в реакционной среде взаимодействием нитрита натрия с минеральной кислотой, чаще всего с HCl. Обычно в реакционной среде генерируемая азотистая кислота присутствует в протонированной форме, из которой далее образуется катион нитрозония. Именно катион–нитрозония, будучи электрофильной частицей, далее участвует в реакциях с аминами:
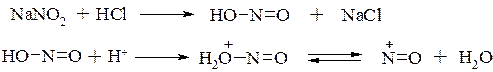
Первичные ароматические амины, взаимодействуя с азотистой кислотой, образуют соли диазония, которым посвящен раздел 19.3:
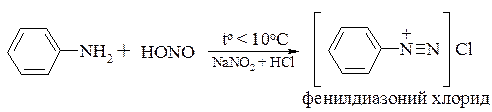
Первичные алифатические амины также образуют диазосоединения, но они, как правило, очень быстро разрушаются ввиду нестабильности:
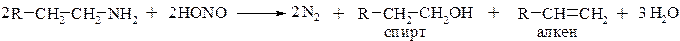
Вторичные алифатические и ароматические амины с азотистой кислотой образуют N-нитрозоамины:
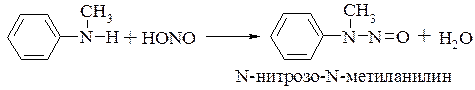
Третичные алифатические амины на холоду устойчивы к действию азотистой кислоты, но при нагревании они могут подвергаться дезалкилированию с последующим образованием N-нитрозопроизводного вторичного амина:
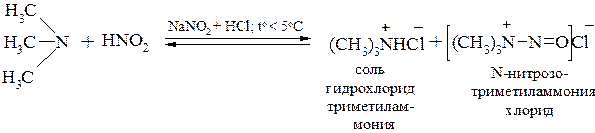
Третичные ароматические амины с азотистой кислотой вступают в реакцию электрофильного замещения с образованием преимущественно пара-нитрозосоединения. Если пара-положение занято, то образуются орто-нитрозопроизводные: