Определить эквивалент и эквивалентную массу хлористой кислоты
5. B соединении азота с углерoдом массовая доля углерода 46,15%. Плотность его паров по воздуху 1,79. Выведите истинную формулу вещества.
6.Рассчитайте относительную атомную массу элемента кобальта, если известно, что в природе существуют два его изотопа: 57Со (массовая доля 0,17%) и 59Со (99,83%).
7. Напишите электронную и графическую конфигурации атома свинца. Определите к какому семейству он относится.
8. Определите степень окисления атомов кислорода в О3.
9. Выразить концентрацию 1,444 М раствора хлорида бария BaC12через массовую долю, моляльность, нормальность и мольные доли, если его плотность равна 1,253г/мл.
10. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
BaCl2 + K2SO4 = BaSO4 + KCl
Вопросы
1.Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 15.
2. Осмос и осмотическое давление.
Вариант 16
Задачи
1.Чему равна относительная атомная масса свинца, учитывая, что масса атома свинца равна 343,62 × 10-24 г, а 1/12 массы атома углерода равна 1,66×10-24г.
2.Какое число молекул содержится в 10 г ортофосфорной кислоты.
3. Сколько молекул углекислого газа занимают объем 2,75 л при н.у.
4.Три вещества имеют одинаковый состав: массовые доли (%) углерода, водорода равны соответственно 85,7 и 14,3. Эти вещества объемом 1 л имеют массы 1,87; 2,50; 3,75 г. Определите формулы веществ.
5. Какой объем углекислого газа (н. y.) выделится, если к карбонату натрия массой 70 г прибавить раствор, содержащий 40,5 г. НСl? (Растворимостью СО2 в растворе пренебречь.)
6.Элемент галлий имеет два природных изотопа: 69Ga и 71Ga. Рассчитайте массовые доли этих изотопов в природном галлии, если относительная атомная масса элемента равна 69,72.
7. Напишите электронную и графическую конфигурации атома теллура. Определите к какому семейству он относится.
8. Определите степень окисления атомов кислорода в Н2О.
9. В 500 г воды растворили 1,5 моль серной кислоты. Рассчитайте массовую долю растворенного вещества.
10. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
AgNO3 + NaCl = AgCl + NaNO3
Вопросы
1.Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 16.
2.Эбулиоскопия.
Вариант 17
Задачи
1. Масса атома брома равна 132,8 × 10-24 г, 1/12 массы атома углерода равна 1,66 × 10-24 г. Вычислите относительную атомную массу брома.
2. Найти массу двух моль серной кислоты.
3. Давление водорода равно 79,5 кПа, объем 50 л. Чему равно количество вещества газа при 10 0С?
4. Вычислите массовые доли каждого элемента в нитрате железа (III) и сульфате аммония.
5. При сжигании соединения азота массой 0,620 г c водородом получены вода Н2О массой 0,721 г и азот N2 объемом 0,443 л (при н. y.). Плотность пара этого вещества по воздуху 1,1. Установите молекулярную формулу этого вещества.
6.Закончить уравнение ядерной реакции: 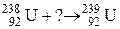 .
.
7. Напишите электронную и графическую конфигурации атома бария. Определите к какому семейству он относится.
8. Определите степень окисления атомов кислорода в Н2О2.
9. Какая масса фенолята натрия С6Н5ОNa может быть получена при взаимодействии 4,7 г фенола С6Н5ОН с раствором гидроксида натрия объемом 4,97 мл (r=1,38 г/мл), массовая доля гидроксида натрия в растворе составляет 35%.
10. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
ZnCl2 + NaOH = Zn(OH)2 + NaCl
Вопросы
1.Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 17.
2. Криоскопия.
Вариант 18
Задачи
1. Определите массу атома магния, если масса а.е.м. равна 1,66 × 10-24 г.
2.Вычислите, сколько моль содержится в 5,2 г сульфида меди (II).
3. При давлении 105,4 кПа и температуре 25°С азот занимает сосуд вместимостью 5,5 л. Вычислите количество вещества азота, находящегося в данном сосуде.
4. Определите молекулярную формулу соединения, содержащего 30,43 % азота и 69,57 % кислорода. Относительная плотность этого вещества по водороду равна 46.
5. Какую массу NаС1 можно получить из 350 г Nа2СО3?
6.Рассчитайте число протонов и нейтронов в ядре атома технеция (изотоп с атомной массой 99) и ядре атома радия (изотоп с атомной массой 226).
7. Напишите электронную и графическую конфигурации атома рубидия. Определите к какому семейству он относится.
8. Определите степень окисления атомов кислорода в Li2О.
9. Выразить концентрацию водного раствора хлороводорода через массовую долю, молярность, нормальность и моляльность, если его мольная доля равна 0,05, плотность раствора 1,05 г/мл.
10. Имеется некоторая соль массой 200 г. Рассчитайте массу воды, которую надо взять, чтобы получить раствор с массовой долей соли 12,5 %.
Вопросы
1.Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 18.
2. Общая характеристика и свойства оксидов.
Вариант 19
Задачи
1. Найти относительную атомную массу платины Pt, если масса атома платины составляет 323,87 × 10-24 г, а атомная единица массы равна 1,66 × 10-24 г.
2. Сколько моль кислорода содержится в 2 моль сернистой кислоты.
3. Чему равна относительная молекулярная масса газа, если при н. у. плотность по воздуху равна 1,52?
4. При полном сжигании соединения серы с водородом образуется 3,6 г воды и 12,8 г оксида серы (IV). Определить формулу исходного вещества.
5. При взаимодействии магния c серной кислотой получили 72 г MgSO4. Определите массы прореагировавших веществ.
6.Природный магний состоит из изотопов 24Mg, 25Mg и 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
7. Напишите электронную и графическую конфигурации атома алюминия. Определите к какому семейству он относится.
8. Определите степень окисления атомов в соединении и изобразите его структурную формулу: N2O5.
9. Для приготовления раствора сульфата меди (II) использовали 50 г соли и 450 г воды. Определите массовую долю сульфата меди (II) в полученном растворе.
10. Выразить концентрацию водного раствора нитрата меди (II) через массовую доли, молярность, нормальность и мольные доли, если его моляльность 1,33 Мл и плотность 1,189 г/мл.
Вопросы
1.Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 19.
2. Общая характеристика и свойства гидроксидов.
Вариант 20
Задачи
1.Вычислите массу атома мышьяка, учитывая, что атомная единица массы равна 1,66 × 10-24 г.
2. Сколько граммов молекулярного кислорода О2 содержится в 0,5 моль газа?
3. Вычислите количество вещества оксида углерода (IV), который занимает объем 120 л при температуре 27 °С и давлении 166,2 кПа.
4. Газообразное соединение азота с водородом содержит 12,5 % водорода. Относительная плотность соединения по водороду равна 16. Найти молекулярную формулу соединения.
5.При взаимодействии смеси натрия и калия массой 8,5 г c водой выделился водород объемом 3,0 л при температуре 27 °С и давлении 1,2.105 Па. Определите массы металлов в смеси.
6.Закончить уравнение ядерной реакции: 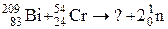
7. Напишите электронную и графическую конфигурации атома магния. Определите к какому семейству он относится.
8. Определите степень окисления атомов в соединении и изобразите его структурную формулу: KMnO4.
9. Составить уравнения в полной и сокращенной ионной формах (расставить коэффициенты), дать названия всем веществам:
BaCl2 + Na2SO4 = BaSO4 + NaCl
10. В 150 г воды растворили 45 г хлорида алюминия. Определить массовую долю растворенного вещества.
Вопросы
1.Опишите положение в периодической системе и охарактеризуйте свойства элемента с порядковым номером 20.
2. Общая характеристика и свойства кислот.
Вариант 21
Задачи
1. Найти относительную атомную массу кальция, если известно, что масса атома кальция равна 66,4 × 10-24 г, а 1/12 массы атома углерода 1,66 × 10-24г.
2. Вычислите сколько моль содержится в 15,5 г сульфата натрия.
3. Определите массу при н. у. 2 л оксида углерода (IV).
