Термодинамические процессы идеальных газов
В закрытых системах
Основными процессами, весьма важными и в теоретическом, и в прикладном отношениях, являются: изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермический, происходящий при постоянной температуре; адиабатный — процесс, при котором отсутствует теплообмен с окружающей средой, и политропный, удовлетворяющий уравнению 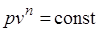 .
.
Метод исследования процессов, не зависящий от их особенностей и являющийся общим, состоит в следующем:
выводится уравнение процесса, устанавливающее связь между начальными и конечными параметрами рабочего тела в данном процессе;
вычисляется работа изменения объема газа;
определяется количество теплоты, подведенной (или отведенной) к газу в процессе;
определяется изменение внутренней энергии системы в процессе;
определяется изменение энтропии системы в процессе.
Изохорный процесс.При изохорном процессе выполняется условие
dv = 0 или v = const. Из уравнения состояния идеального газа следует, что p/T=R/v=const, т. е. давление газа прямо пропорционально его абсолютной температуре:
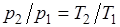 .
.
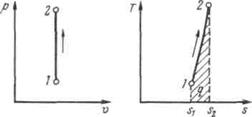
Рисунок 5.1 - Изображение изохорного процесса в р,v- и T, s-координатах
Работа расширения в этом процессе равна нулю, так как dv= 0.
Количество теплоты, подведенной к рабочему телу в процессе 12 при 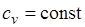 , определяется как:
, определяется как:
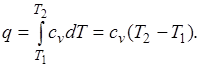
При переменной теплоемкости 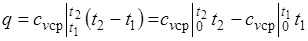 , где
, где 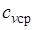 — средняя массовая изохорная теплоемкость в интервале температур от t1 до t2.
— средняя массовая изохорная теплоемкость в интервале температур от t1 до t2.
Так как 1= 0, то в соответствии с первым законом термодинамики 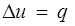 и
и
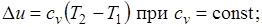
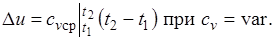
Поскольку внутренняя энергия идеального газа является функцией только его температуры, то полученные формулы справедливы для любого термодинамического процесса идеального газа.
Изменение энтропии в изохорном процессе определяется по формуле
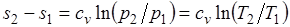 ,
,
т. е. зависимость энтропии от температуры на изохоре при сv = const имеет логарифмический характер.
Изобарный процесс.Из уравнения состояния идеального газа при р=const находим 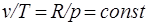 , или
, или 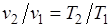 , т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака, 1802 г.). На рисунке изображен график процесса.
, т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака, 1802 г.). На рисунке изображен график процесса.
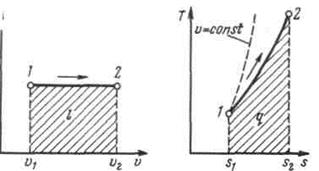
Рисунок 5.2 - Изображение изобарного процесса в p,v- и T,s-координатах
Из выражения 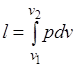 следует, что
следует, что 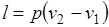 .
.
Так как 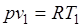 и
и 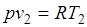 , то одновременно
, то одновременно
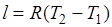
Количество теплоты, сообщаемое газу при нагревании (или отдаваемое им при охлаждении):
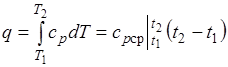 ,
,
где 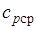 — средняя массовая изобарная теплоемкость в интервале температур от t1до t2при
— средняя массовая изобарная теплоемкость в интервале температур от t1до t2при 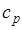 = const
= const
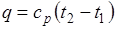 .
.
Изменение энтропии при ср = const согласно равно
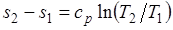 ,
,
т. е. температурная зависимость энтропии при изобарном процессе тоже имеет логарифмический характер, но поскольку ср>сv, то изобара в Т,s-диаграмме идет более полого, чем изохора.
Изотермический процесс.При изотермическом процессе температура постоянна, следовательно, pv = RT = const, или
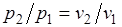 ,
,
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении — падает (закон Бойля — Мариотта, 1662 г.).
Графиком изотермического процесса в р,v –координатах является равнобокая гипербола, для которой координатные оси служат асимптотами .
Работа процесса:
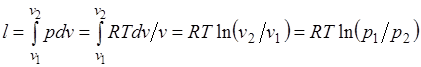 .
.
Так как температура не меняется, то внутренняя энергия идеального газа в данном процессе остается постоянной ( 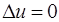 ) и вся подводимая к газу теплота полностью превращается в работу расширения:
) и вся подводимая к газу теплота полностью превращается в работу расширения:
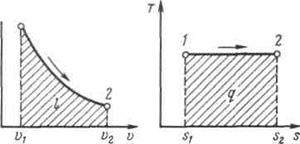
Рисунок 5.3 - Изображение изотермического процесса в р, v- и T, s-координатах.
При изотермическом сжатии от газа отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии в изотермическом процессе выражается формулой
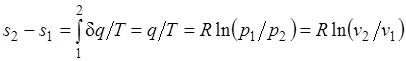 .
.
Адиабатный процесс.Процесс, происходящий без теплообмена с окружающей средой, называется адиабатным, т. е. 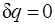 . Для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т. е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
. Для того чтобы осуществить такой процесс, следует либо теплоизолировать газ, т. е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
Уравнения первого закона термодинамика для адиабатного процесса принимают вид: 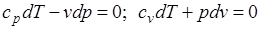 . Поделив первое уравнение на второе, получим
. Поделив первое уравнение на второе, получим
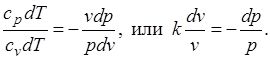
Интегрируя последнее уравнение при условии, что k =cp/cv=const, находим
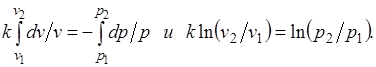
После потенцирования имеем
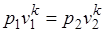 . *
. *
Это и есть уравнения адиабаты идеального газа при постоянном отношении теплоемкостей (k = const). Величина
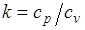
называется показателем адиабаты. Подставив cp = cv-R, получим k. Согласно классической кинетической теории теплоемкость газов не зависит от температуры, поэтому можно считать, что величина k также не зависит от температуры и определяется числом степеней свободы молекулы. Для одноатомного газа k=1,66 для двухатомного k=1,4, для трех- и многоатомных газов k=l,33.
Поскольку k>1, то в координатах р,v линия адиабаты идет круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
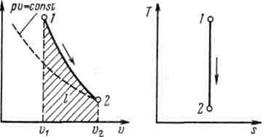
Рисунок 5.4 - Изображение адиабатного процесса в р, v- и Т, s-координатах
Определив из уравнения состояния, написанного для состояний 1и 2, отношение объемов или давлений, получим уравнение адиабатного процесса в форме, выражающей зависимость температуры от объема или давления:
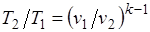 ;
;
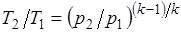 .
.
Работа расширения при адиабатном процессе согласно первому закону термодинамики совершается за счет уменьшения внутренней энергии и может быть вычислена по одной из следующих формул:
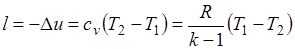 .
.
Так как 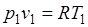 и
и 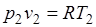 , то
, то
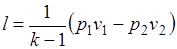 .
.
В данном процессе теплообмен газа с окружающей средой исключается, поэтому q=0. Выражение 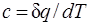 показывает, что теплоемкость адиабатного процесса равна нулю.
показывает, что теплоемкость адиабатного процесса равна нулю.
Поскольку при адиабатном процессе 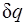 = 0, энтропия рабочего тела не изменяется (ds=0 и s=const). Следовательно, на Т,s-диаграмме адиабатный процесс изображается вертикалью.
= 0, энтропия рабочего тела не изменяется (ds=0 и s=const). Следовательно, на Т,s-диаграмме адиабатный процесс изображается вертикалью.
Политропный процесс и его обобщающее значение.Любой произвольный процесс можно описать в р,v-координатах (по крайней мере на небольшом участке) уравнением
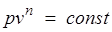 ,
,
подбирая соответствующее значение п. Процесс, описываемый таким уравнением, называется политропным. Показатель политропы n может принимать любое численное значение в пределах от 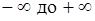 , но для данного процесса он является величиной постоянной.
, но для данного процесса он является величиной постоянной.
Из уравнения Клапейрона нетрудно получить выражения, устанавливающие связь между р, v и Т в любых двух точках на политропе, аналогично тому, как это было сделано для адиабаты:
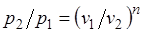 ;
; 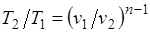 ;
; 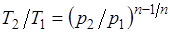 . (5.1)
. (5.1)
Работа расширения газа в политропном процессе имеет вид 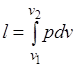 .
.
Так как для политропы в соответствии с (5.1)
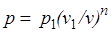 ,
,
то
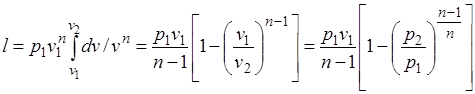 (5.2)
(5.2)
Уравнение (5.1) можно преобразовать к виду:
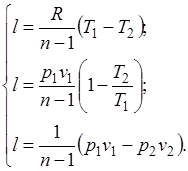
Количество подведенной (или отведенной) в процессе теплоты можно определить с помощью уравнения первого закона термодинамики: 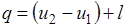 .
.
Поскольку 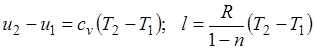 , то
, то
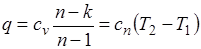 ,
,
где
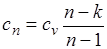
представляет собой теплоемкость идеального газа в политропном процессе. При постоянных cv, k и п теплоемкость сn = const, поэтому политропный процесс иногда определяют как процесс с постоянной теплоемкостью.
Изменение энтропии
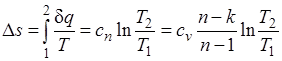 .
.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов. Ниже приведены характеристики термодинамических процессов.
| Процесс | п | 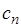 |
| Изохорный | 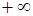 | 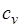 |
| Изобарный | 0 | 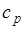 |
| Изотермический | 1 | 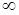 |
| Адиабатный | k | 0 |
На рисунке показано взаимное расположение на р, V- и Т, s-диаграммах политропных процессов с разными значениями показателя политропы. Все процессы начинаются в одной точке («в центре»).
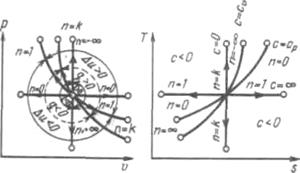
Рисунок 5.5 - Изображение основных термодинамических процессов идеального газа в р, v- и Т, s-координатах
Изохора (п= ± 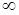 ) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа.
) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа.
Процессы, расположенные правее и выше адиабаты, идут с подводом теплоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой ( = 1), характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную теплоемкость, так как 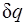 и du (а следовательно, и dT), имеют в этой области противоположные знаки. В таких процессах
и du (а следовательно, и dT), имеют в этой области противоположные знаки. В таких процессах 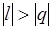 , поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
, поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
Эксергия
Основываясь на втором начале термодинамики, установим количественное соотношение между работой, которая могла бы быть совершена системой при данных внешних условиях в случае протекания в ней равновесных процессов, и действительной работой, производимой в тех же условиях, при неравновесных процессах.
Рассмотрим изолированную систему, состоящую из горячего источника с температурой Ti, холодного источника (окружающей среды) с температурой То и рабочего тела, совершающего цикл.
Работоспособностью (или эксергией) теплоты Q1, отбираемой от горячего источника с температурой Т1, называется максимальная полезная работа, которая может быть получена за счет этой теплоты при условии, что холодным источником является окружающая среда с температурой То.
Из предыдущего ясно, что максимальная полезная работа L'макс теплоты Q1 представляет собой работу равновесного цикла Карно, осуществляемого в диапазоне температур T1 –T0.
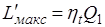 ,
,
где 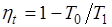 .
.
Таким образом, эксергия теплоты Q1
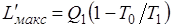 ,
,
т. е. работоспособность теплоты тем больше, чем меньше отношение 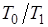 . При
. При 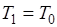 она равна нулю.
она равна нулю.
Полезную работу, полученную за счет теплоты Q1 горячего источника, можно представить в виде 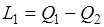 , где
, где 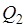 — теплота, отдаваемая в цикле холодному источнику (окружающей среде) с температурой
— теплота, отдаваемая в цикле холодному источнику (окружающей среде) с температурой 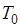 .
.
Если через 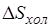 обозначить приращение энтропии холодного источника, то
обозначить приращение энтропии холодного источника, то 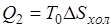 , тогда
, тогда
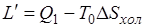 . (5.3)
. (5.3)
Если бы в рассматриваемой изолированной системе протекали только равновесные процессы, то энтропия системы оставалась бы неизменной, а увеличение энтропии холодного источника 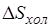 равнялось бы уменьшению энтропии горячего. В этом случае за счет теплоты Q1 можно было бы получить максимальную полезную работу
равнялось бы уменьшению энтропии горячего. В этом случае за счет теплоты Q1 можно было бы получить максимальную полезную работу
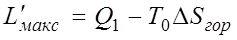
что следует из уравнения (5.3).
Действительное количество работы, произведенной в этих же условиях, но при неравновесных процессах, определяется уравнением (5.3).
Таким образом, потерю работоспособности теплоты можно записать как 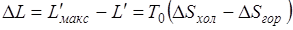 , но разность
, но разность 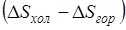 представляет собой изменение энтропии рассматриваемой изолированной системы, поэтому
представляет собой изменение энтропии рассматриваемой изолированной системы, поэтому
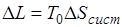 . (5.4)
. (5.4)
Величина 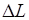 определяет потерю работы, обусловленную рассеиванием энергии вследствие неравновесности протекающих в системе процессов. Чем больше неравновесность процессов, мерой которой является увеличение энтропии изолированной системы
определяет потерю работы, обусловленную рассеиванием энергии вследствие неравновесности протекающих в системе процессов. Чем больше неравновесность процессов, мерой которой является увеличение энтропии изолированной системы 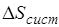 , тем меньше производимая системой работа.
, тем меньше производимая системой работа.
Уравнение (5.4) называют уравнением Гюи — Стодолы по имени французского физика М. Гюи, получившего это уравнение в 1889 г., и словацкого теплотехника А. Стодолы, впервые применившего это уравнение.
ЛЕКЦИЯ 6
