Описание лабораторной установки и порядок выполнения работы
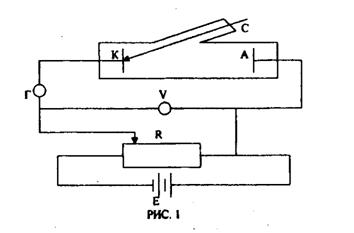
В работе применяется селеновый фотоэлемент.
Устанавливают фотоэлемент и электролампу с известной силой света так, чтобы их центры были на одной горизонтали. Устанавливают фотоэлемент на указанном в работе расстоянии от электролампы и подсоединяют гальванометр к фотоэлементу. Включают лампу в сеть и устанавливают указанное в работе напряжение.
При освещении фотоэлемента гальванометр покажет наличие фототока. Записывают в таблицу расстояние R от фотоэлемента до электролампы и силу фототока i. Повторяют измерения, измеряя расстояние через равные интервалы.
Пройдя весь указанный в работе интервал расстояний, выключают электролампу и отключают гальванометр от фотоэлемента.
Результаты измерений записывают в таблицу.
Таблица результатов по определению чувствительности фотоэлемента типа ....
Фоточувствительная поверхность S=
Сила света лампы J =
| № п/п | ||||||||||
| R | ||||||||||
| i | ||||||||||
| i/iмакс | ||||||||||
| Ф |
Обрабатывают результаты измерений.
Зная освещенность и светочувствительность площадь фотоэлемента, (она указана в работе), находят световой поток, падающий на фотоэлемент
Ф = ЕS
Зная световой поток Ф и силу фототока i, строят график зависимости i/iмакс от Ф. Из графика находят чувствительность фотоэлемента к = 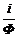 .
.
3.Контрольные вопросы.
1.Дайте определение материи.
2.Каковы взгляды классической физики на понятия частицы и волны?
3.В чем заключается идея о корпускулярно-волновой двойственности материи?
4. Какие физические явления подтверждают корпускулярно-волновой дуализм материи?
5.Дайте определение дифракции света?
6.Что представляет собой дифракционная решетка?
7.Где применяют дифракционные решетки?
4.Тестовые задания
1.Явление вырывания электронов из атомов и молекул вещества под действием света называется …
А) дисперсией
Б) фотоэффектом
В) дифракцией
Г) интерференцией
2.Основной характеристикой дифракционной решетки является …
А) дифракционный максимум
Б) постоянная дифракционной решетки
В) дифракционный минимум
Г) расстояние между максимумами
3.Формулой Планка называют следующую формулу …
А) F = ma
Б) E = mc2
B) E = hν
Г) λ = h/p
Лабораторная работа №2
Градуирование спектроскопа и определение постоянной Планка.
Дисперсия света
Основным понятием геометрической оптики является понятие светового луча. Законы, определяющие направления световых лучей – закон прямолинейного распространения в однородной среде, законы отражения и преломления, – были открыты опытным путем.
Ньютоном было открыто, что показатель преломления не зависит от угла падения светового пучка, но он зависит от цвета. Занимаясь усовершенствованием телескопов, Ньютон обратил внимание на то, что изображение, даваемое объективом, по краям окрашено. Радужную окраску изображения, даваемого линзой, наблюдали, конечно, и до него. Было замечено также, что радужные края имеют предметы, рассматриваемые чрез призму. Пучок световых лучей, прошедших через призму, окрашивается по краям.
Ньютон направил на призму световой пучок малого поперечного сечения. Пучок солнечного света проходил в затемненную комнату через маленькое отверстие в ставне. Падая на стеклянную призму, он преломлялся и давал на противоположной стене удлиненное изображение с радужным чередованием цветов: красный, оранжевый, желтый, зеленый, голубой, синий, фиолетовый. Эту радужную полоску Ньютон назвал спектром. Спектром называют совокупность цветов, расположенных в соответствии с длиной волны.
Видимый белый свет – это результат наложения электромагнитных волн с различными длинами волн, которые по отдельности воспринимаются наблюдателем как различные цвета. Таким образом, цвета в спектре – это цвета, содержащиеся в свете белого цвета. Их последовательность соответствует уменьшению длины волны – от красного до фиолетового.
Важный вывод, к которому пришел Ньютон гласит: «Световые пучки, отличающиеся по цвету, отличаются по степени преломляемости. Наиболее сильно преломляются фиолетовые лучи, меньше других – красные».
Зависимость показателя преломления света от его цвета (длины волны) носит название дисперсии (от лат. dispergo – разбрасываю).
Сущностью явления дисперсии является неодинаковая скорость распространения лучей света с различной длиной волны в прозрачном веществе – оптической среде (тогда как в вакууме скорость света всегда одинакова, независимо от длины волны и следовательно цвета).
Различают нормальную и аномальную дисперсии. При нормальной дисперсии с уменьшением длины волны (ростом частоты) показатель преломления увеличивается. Нормальная дисперсия наблюдается у веществ, прозрачных для света. Обычно чем меньше длина (больше частота) волны, тем больше показатель преломления среды и меньше её скорость света в ней. Так, у фиолетового цвета минимальная скорость света в среде и максимальная степень преломления, у красного цвета максимальная скорость в среде и минимальная степень преломления,
Однако в некоторых веществах (например в парах йода) наблюдается эффект аномальной дисперсии, при котором синие лучи преломляются меньше, чем красные. То есть при аномальной дисперсии с уменьшением длины волны (ростом частоты) показатель преломления уменьшается. Аномальная дисперсия наблюдается в областях частот, соответствующих полосам интенсивного поглощения света в данной среде.
Дисперсия света позволила впервые вполне убедительно показать составную природу белого света.
Дисперсией объясняется факт появления разноцветной радуги после дождя.
Дисперсия является причиной хроматической аберрации (искажения изображения) – одного из тщательно устраняемых недостатков (аберраций) оптических систем, в том числе фото и видообъективов.
Благодаря дисперсии света, можно наблюдать цветную «игру света» на гранях бриллианта и других прозрачных гранёных материалов.
Постоянная Планка
Свет представляет собой форму лучистой энергии, которая распространяется в пространстве в виде электромагнитных волн. В 1900 году ученый Макс Планк – один из основоположников квантовой механики – предложил теорию, согласно которой лучистая энергия испускается и поглощается не непрерывным волновым потоком, а отдельными порциями, которые получили название квантов (фотонов).
Энергия, переносимая одним квантом, равна: E = hv, где v – частота излучения, а h – элементарный квант действия, представляющий собой новую универсальную константу, получившую вскоре название постоянная Планка (по современным данным h = 6,626 × 10–34 Дж·с).
В 1913 году Нильс Бор создал стройную, хотя и упрощенную модель атома, согласующуюся с распределением Планка. Бор предложил теорию излучения, в основу которой положил следующие постулаты:
1. В атоме существуют стационарные состояния, находясь в котором атом не излучает энергию. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны;
2. При переходе электрона с одной стационарной орбиты на другую (из одного стационарного состояния в другое) излучается или поглощается квант энергии hν = |Ei – En| , где ν – частота излучаемого кванта, Ei – энергия состояния, из которого переходит, а En – энергия состояния, в которое переходит электрон.
Если электрон под каким-либо воздействием переходит с орбиты, близкой к ядру на какую либо другую более удаленную, то энергия атома увеличивается, но что требуется затрата внешней энергии. Но такое возбужденное состояние атома малоустойчиво и электрон падает обратно по направлению к ядру на более близкую возможную орбиту.
А когда электрон перескакивает (падает) на орбиту, лежащую ближе к ядру атома, то потерянная атомом энергия переходит в один квант лучистой энергии, испускаемой атомом.
Соответственно, любой атом может излучать широкий спектр связанных между собой дискретных частот, который зависит от орбит электронов в составе атома.
Атом водорода состоит из протона и движущегося вокруг него электрона. Если электрон поглощает порцию энергии, то атом переходит в возбужденное состояние. Если же электрон отдает энергию, то атом переходит из более высокого в менее высокое энергетическое состояние. Обычно переходы из более высокого энергетического состояния в менее высокое сопровождаются излучением энергии в форме света. Однако, возможны также и безызлучательные переходы. В этом случае атом переходит в менее высокое энергетическое состояние без излучения света, а избыток энергии отдает, например, другому атому при их столкновении.
Если атом, переходя из одного энергетического состояния в другое, излучает спектральную линию с длиной волны λ, то, в соответствии со вторым постулатом Бора, излучается энергия Е равная: 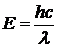 , где h - постоянная Планка; c - скорость света.
, где h - постоянная Планка; c - скорость света.
Совокупность всех спектральных линий, которые может излучать атом, называется его спектром испускания.
Как показывает квантовая механика, спектр атома водорода выражается формулой:
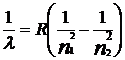 , где R – постоянная, называемая постоянной Ридберга; n1 и n2 числа, причем n1< n2.
, где R – постоянная, называемая постоянной Ридберга; n1 и n2 числа, причем n1< n2.
Каждая спектральная линия характеризуется парой квантовых чисел n2 и n1. Они указывают энергетические уровни атома соответственно до и после излучения.
При переходе электронов с возбужденных энергетических уровней на первый (n1 = 1; соответственно n2 = 2, 3, 4, 5…) образуется серия Лаймана. Все линии серии Лаймана находятся в ультрафиолетовом диапазоне.
Переходы электронов с возбужденных энергетических уровней на второй уровень (n1 = 2; соответственно n2 = 3,4,5,6,7…) образуют серию Бальмера. Первые четыре линии (то есть при n2 = 3, 4, 5, 6) находятся в видимом спектре, остальные (то есть при n2 = 7, 8, 9) в ультрафиолетовом.
То есть, видимые спектральные линии этой серии получаются, если электрон перескакивает на второй уровень (вторую орбиту): красная – с 3-ей орбиты, зеленая – с 4-ой орбиты, синяя – с 5-ой орбиты, фиолетовая – с 6-ой орбиты.
Переходы электронов с возбужденных энергетических уровней на третий (n1 = 3; соответственно n2 = 4, 5, 6, 7…) образуют серию Пашена. Все линии серии Пашена расположены в инфракрасном диапазоне.
Переходы электронов с возбужденных энергетических уровней на четвертый (n1 = 4; соответственно n2 = 6, 7, 8…) образуют серию Брэккета. Все линии серии находятся в далёком инфракрасном диапазоне.
Также в спектральных сериях водорода выделяют серии Пфунда и Хэмпфри.
Наблюдая линейчатый спектр атома водорода в видимой области (серию Бальмера) и измеряя длину волны λ спектральных линий этой серии, можно определить постоянную Планка.
В системе СИ расчетная формула для нахождения постоянной Планка при выполнении лабораторной работы примет вид:
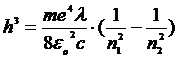 ,
,
где n1 = 2 (серия Бальмера); n2 = 3, 4, 5, 6.
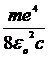 =3,2 × 10-93
=3,2 × 10-93
λ – длина волны (нм)
Постоянная Планка фигурирует во всех уравнениях и формулах квантовой механики. Она, в частности, определяет масштабы, начиная с которых вступает в силу принцип неопределенности Гейзенберга. Грубо говоря, постоянная Планка указывает нам нижний предел пространственных величин, после которого нельзя не принимать во внимание квантовые эффекты. Для песчинок, скажем, неопределенность произведения их линейного размера на скорость настолько незначительна, что ею можно пренебречь. Иными словами, постоянная Планка проводит границу между макромиром, где действуют законы механики Ньютона, и микромиром, где вступают в силу законы квантовой механики. Будучи получена всего лишь для теоретического описания единичного физического явления, постоянная Планка вскоре стала одной из фундаментальных констант теоретической физики, определяемых самой природой мироздания.
