Строение химических элементов и понимание Периодической таблицы Менделеева
В своей Нобелевской речи Бор отметил, что его теория объясняет молекулярные спектры, неплохо согласуясь с опытом. При переходе к объяснению строения химических элементов он предположил, что замкнутые конфигурации энергетически более выгодны и после заполнения одной оболочки начинают заполняться следующие. Это предположение помогло Паули прийти (1925—1926) к своему принципу запрета, согласно которому в каждом квантовом состоянии может находиться только один электрон. После создания Бором квантовой теории атома водорода и успехов квантовых представлений в других областях науки активно развивалась спектроскопия, которая явилась ключом в мир внутриатомных явлений.
Еще в 1896 г. П.Зееман осуществил опыт, который не успел провести Фарадей. Пламя горелки он поместил между полюсами электромагнита и наблюдал спектр. При наблюдении поперек поля кроме основной ли-
нии с частотой колебаний, которая была бы без поля, были две линии, смещенные в разные стороны от основной. Все три линии линейно поляризованы. При наблюдении вдоль поля несмещенной компоненты нет, а смещенные — поляризованы по кругу в противоположных направлениях. Х.Лоренц объяснил эффект Зеемана вращением электронов по круговой орбите с циклической частотой, определяемой силой Лоренца. Дж.Лармор учел прецессию электронов вокруг силовых линий магнитного поля с этой частотой. Теория Лармора—Лоренца — выдающееся достижение электронной теории, и ее авторы были удостоены Нобелевской премии за открытие и объяснение эффекта Зеемана (1902). Но квантовая теория, развиваемая А. Зоммерфельдом, не могла ничего сказать о поляризации и интенсивности линий, их определили в нормальном эффекте Зеемана с помощью принципа соответствия Бора. На практике чаще наблюдается расчленение на несколько компонентов (линий). Как указывал в 1919 г. Д.С.Рождественский, эта проблема тесно связана с магнитными свойствами атома.
Но не был интерпретирован аномальный эффект Зеемана, когда возникало отличное от триплета расщепление линии в магнитном поле. Паули, работая у Бора два года над этой проблемой, выдвинул гипотезу ядерного спина для объяснения сверхтонкой структуры спектральных линий. Он считал, что необъясненные явления «возникают вследствие двузначности свойств электрона, которую нельзя описать классически» (1924). Фактически это и была гипотеза существования спина электрона, которую робко высказывал еще Комптон (1921). В 1925 г. американские физики Дж. Гауд-смит и С.Уленбек по представлению физика-теоретика П.Эренфеста опубликовали статью с предложением гипотезы спина электрона, ссылаясь на работу Паули, а после обсуждения с Бором, Эйнштейном и Эренфестом — большую статью в «Nature», где понятие спина объясняло многие явления в спектре.
Идея опыта состояла в использовании известного факта притяжения большим магнитом маленьких, у которых на северный и южный полюсы действуют разные силы из-за неоднородности большого магнита. В однородном поле они просто повернулись бы в направлении поля. По классической теории на экране пучок должен дать размытое изображение — магнитный момент атома может принимать любые значения. По квантовой теории следовало ожидать, что пучок или не расщепится (как должно быть у водорода), или расщепится не менее чем на три пучка (при наличии магнитного момента). Но получалось, что пучок атомов водорода, серебра, натрия, калия и других одновалентных атомов расщепляется на два пучка. Поэтому и возникла гипотеза о собственном механическом и магнитном моменте электрона.
С позиции классической теории наличие таких моментов может быть обусловлено вращением электрона вокруг собственной оси. Тогда он как вращающаяся масса будет обладать моментом импульса. А вращающийся заряд есть совокупность круговых токов, т.е. появляется и магнитный момент.
 |
Спин электрона имеет размерность вращательного момента-импульса, умноженного на расстояние, т.е. постоянной Планка 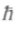 Вращательный момент L кратен
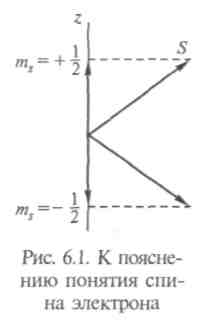
Вращательный момент L кратен 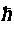 , является целым, и ему отвечают (2L + 1) различных состояний с различными значениями проекций на данную ось. Спин электрона в единицах h может иметь два значения: +(1/2) и -(1/2), соответствующие двум значениям проекции на эту ось (рис. 6.1). Говорят, что его состояния — «вверх» и «вниз». В магнитном поле он направлен по полю или против него. В том же 1924 г. Паули сформулировал принцип: на одной орбите не могут одновременно находиться более двух тождественных частиц с полуцелыми спинами. Спин электрона описывает асимметрию электрона, неизотропность его свойств.
, является целым, и ему отвечают (2L + 1) различных состояний с различными значениями проекций на данную ось. Спин электрона в единицах h может иметь два значения: +(1/2) и -(1/2), соответствующие двум значениям проекции на эту ось (рис. 6.1). Говорят, что его состояния — «вверх» и «вниз». В магнитном поле он направлен по полю или против него. В том же 1924 г. Паули сформулировал принцип: на одной орбите не могут одновременно находиться более двух тождественных частиц с полуцелыми спинами. Спин электрона описывает асимметрию электрона, неизотропность его свойств.
Паули руководствовался при написания работы аналогией спина электрона и поляризации фотона, так как для введения спина в волновую механику предложил приписать 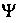 -функции две компоненты, имеющие смысл двух взаимно перпендикулярных компонент вектора, как для света. Формализм, введенный Паули, вскоре усовершенствовал Дирак, но интересны соображения Паули о введении спина в волновую механику.
-функции две компоненты, имеющие смысл двух взаимно перпендикулярных компонент вектора, как для света. Формализм, введенный Паули, вскоре усовершенствовал Дирак, но интересны соображения Паули о введении спина в волновую механику.
Принцип Паули отражает антисимметрию волновых функций электронов, наличие у них полуцелого спина. Согласно принципу, в силу неотличимости микрочастиц исключается вероятность того, что внутри одного атома одинаковые орбиты могут быть заняты одинаковыми электронами. Или: в одном атоме не может быть двух электронов, находящихся в одинаковом состоянии по всем четырем квантовым числам, характеризующим состояние (например, электронов только с противоположными спинами). Этот принцип позволил объяснить химические свойства элементов, определяемые электронами внешних незаполненных оболочек, что, в свою очередь, дало фундаментальное физическое обоснование Периодической таблице элементов.
Запрет Паули привел к новым открытиям, к пониманию тепло- и электропроводности металлов и полупроводников. К 1927 г. Паули сумел объяснить парамагнетизм электронного газа в металле и структуру электронных оболочек в атоме.
Электронные оболочки атомов строились с помощью принципа Паули. Так была понята Периодическая система химических элементов Д. И. Менделеева. Каждый слой представлялся совокупностью стационарных орбит. По Бору, электроны только после заполнения оболочки начинают занимать более высокие орбиты. Методы нахождения допустимых орбит определялись правилами квантования Бора—Зоммерфельда, позволившими продвинуть модель Бора от водорода к другим атомам. Оказалось, что электроны
движутся не по окружностям, а по эллипсам, значит, находящиеся на одном эллипсе электроны должны отличаться ориентацией, а эллипсы одного слоя — эксцентриситетом. Тогда электроны, находящиеся в одном слое, отличаются энергетическим состоянием. На основании квантово-механического рассмотрения микрообъектов стало ясно, что их состояние описывается с помощью квантовых чисел — целых или полуцелых чисел, которые определяют возможные дискретные значения физических величин или параметров, описывающих состояние микрообъекта. Например, состояние электронов описывается четырьмя квантовыми числами.
Значения энергии, которые может принимать движущаяся частица, определяются главным квантовым числом (и): п = 1, 2, 3,... Электронные слои обозначают большими буквами латинского алфавита К, L, М, N, О и т.д. Наибольшее количество электронов в слое равно 2n2, поэтому в самом близком к ядру слое К (п = 1) может находиться не более двух электронов, в слое L (п = 2) — не более восьми и т.д. Чем больше заряд ядра или порядковый номер в таблице, тем сильнее притягиваются электроны, особенно внутренних слоев, поэтому диаметры слоев с ростом номера элемента уменьшаются, и все атомы имеют почти одинаковые размеры порядка 10-10 м. Атомы, относящиеся к одной группе элементов таблицы Менделеева, имеют одинаковую валентность, обусловливающую их сходные химические свойства. На внешних оболочках они имеют одинаковое число электронов, которые называются валентными.
Возможные значения орбитального момента импульса в силовом поле определяются азимутальным (орбитальным) квантовым числом (l): l = = 0, 1, 2,..., п - 1. Этим числом характеризуют движение электронов в атомах и молекулах, а также нуклонов в ядрах атомов. Состояния с различными значениями / отличаются величиной момента импульса, им присвоили специальные обозначения: для электрона в состоянии l = 0 — s-состояние, l = 1 — p-состояние или называют его р-электроном; далее с ростом квантового числа — d-электрон или, 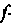 -электрон. Поскольку орбитальное число всегда меньше главного, то существуют состояния электрона 1s; 2s, 2р; 3s, 3р, 3d; ... Состояние 1s является основным состоянием водорода. Ему соответствует минимум потенциальной энергии, оно самое устойчивое. Возбуждению соответствует переход на более высокое состояние, обладающее большей энергией. Поэтому для возбуждения необходимо затратить энергию. Если это энергия теплового движения, переданная при соударении, то имеем тепловое излучение — обратный переход из возбужденного состояния в основное.
-электрон. Поскольку орбитальное число всегда меньше главного, то существуют состояния электрона 1s; 2s, 2р; 3s, 3р, 3d; ... Состояние 1s является основным состоянием водорода. Ему соответствует минимум потенциальной энергии, оно самое устойчивое. Возбуждению соответствует переход на более высокое состояние, обладающее большей энергией. Поэтому для возбуждения необходимо затратить энергию. Если это энергия теплового движения, переданная при соударении, то имеем тепловое излучение — обратный переход из возбужденного состояния в основное.
Величина проекции момента импульса на выделенное направление определяется магнитным квантовым числом (т) по формулам квантования: т = -1, ..., -1, 0, +1, ..., +1. Выделенное направление обычно выбирают по направлению внешнего поля. Чаще всего это поле магнитное, отсюда и название квантового числа.
С собственным моментом импульса электрона, не зависящим от движения электрона в пространстве, связано спиновое квантовое
число 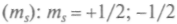 . Спином обладают все элементарные частицы
. Спином обладают все элементарные частицы
(кроме мезонов), это внутреннее свойство микрочастицы. Значения спинового квантового числа определяются принципом Паули.
Так принцип Паули позволил объяснить насыщение уровней. В соответствии со свойствами симметрии 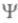 -функции при перестановке двух частиц для электронов возможны только антисимметричные состояния. В дальнейшем принцип Паули сыграл решающую роль при построении статистики Ферми—Дирака для частиц с полуцелым спином — фермионов. Для частиц с целым спином (в единицах
-функции при перестановке двух частиц для электронов возможны только антисимметричные состояния. В дальнейшем принцип Паули сыграл решающую роль при построении статистики Ферми—Дирака для частиц с полуцелым спином — фермионов. Для частиц с целым спином (в единицах 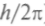 ) — бозонов — была построена статистика Бозе — Эйнштейна. Принцип Паули не имеет аналога в классической физике, и физические причины существования этого запрета не полностью еще понятны. Паули предложил сначала простое правило, автоматически объясняющее наличие групп из 2, 8, 18 и 32 элементов. Он постулировал, что одну электронную орбиталь (или стоячую волну) могут занимать не более двух электронов. Вскоре было обнаружено наличие спина у электрона, и получилось, что принцип Паули имеет основание.
) — бозонов — была построена статистика Бозе — Эйнштейна. Принцип Паули не имеет аналога в классической физике, и физические причины существования этого запрета не полностью еще понятны. Паули предложил сначала простое правило, автоматически объясняющее наличие групп из 2, 8, 18 и 32 элементов. Он постулировал, что одну электронную орбиталь (или стоячую волну) могут занимать не более двух электронов. Вскоре было обнаружено наличие спина у электрона, и получилось, что принцип Паули имеет основание.
Если идти по системе химических элементов в направлении увеличения их номера, то оказывается, что электронами сначала заполняются наинизшие уровни энергии. Так, атом висмута выглядит так же, как и атом свинца, но с одним отличием — у висмута на 6p-оболочке на один электрон больше. Существует еще одно правило заполнения оболочек — правило Хунда, согласно которому, при заполнении s, p, d и т. д. уровней их сначала занимают электроны с одинаковой ориентацией спина и только потом — с противоположной. Так можно построить модели 92 стабильных атомов Периодической системы химических элементов.
Так, атом азота имеет 7 электронов; из них по два (с «правым» и «левым» спином) располагаются на уровнях \s и 2s, а остальные три — на уровне 2р, который может вместить только 6 электронов. По правилу Хунда последние три электрона азота имеют одинаковую ориентацию спина. В волновой модели каждому из р-электронов соответствует волновая функция из двух симметричных «яйцевидных» половинок; три из них могут быть ориентированы вдоль любой из трех осей прямоугольной системы координат, в результате атом выглядит сферически симметричным. Следующий атом — кислород — должен содержать в одном из этих «p-пространств» еще один электрон с противоположно направленным спином. Это можно представить так: две полностью конгруэнтные p-орбитали проникают друг в друга, совершенно не влияя одна на другую. Периодическая система элементов теряла свою загадочность.
Само понятие спина не вытекало из теории того времени. Казалось, что при вращении электрон имел скорость, превышающую скорость света с, что противоречило СТО. Так, в тяжелых атомах скорости электронов получались порядка 0,6 с. Непротиво-
речивую теорию с учетом требований СТО построил П.Дирак (1928). Из его релятивистского волнового уравнения автоматически следовало наличие собственного магнитного момента электрона. Кроме того, оно оказалось симметричным относительно знака электрического заряда. Тем самым Дирак предсказал существование антиэлектрона — позитрона. Позитрон был обнаружен действительно в космических лучах К.Андерсоном в 1932 г. Квантовую механику, которая согласуется с теорией относительности, называют релятивистской. Так началось проникновение в дискретный мир микрочастиц.
Как известно, природные химические элементы занимают в Периодической таблице места до № 92, т. е. до урана. Более тяжелых элементов нет ни на Земле, ни в метеоритах, приходящих из Космоса. Это и понятно — в ядрах атомов этих элементов больше протонов, значит, ядра таких элементов неустойчивы, а атомы — радиоактивны. Для получения трансурановых элементов были созданы специальные установки, названные циклотронами, в которых создаются мощные пучки а-частиц и более тяжелых частиц для бомбардировки ими урана. Первые циклотроны были созданы в США, где были получены сначала плутоний и нептуний, а затем — вплоть до элемента № 101, который был назван менделее-вием. В 1958 г. В. А. Карнаухов (СССР) оценил границы стабильности ядер (до Z = 70) по отношению к протонной радиоактивности и предсказал возможные протонно-активные ядра (Sc-39, Fs-63, Sb-106), в 1959 г. В. И. Гольданский предсказал возможность двухпротонной радиоактивности — одновременного испускания ядром двух протонов, а П. Е. Спивак с сотрудниками определил период полураспада свободного нейтрона.
В нашей стране получением трансурановых элементов занялась группа ученых во главе с Г.Н.Флеровым. В подмосковном городе Дубна был введен в строй более совершенный циклотрон, в котором разгонялись ядра атомов легких элементов. В начале 60-х гг. шведы, а затем американцы сообщили о получении элемента № 102 с атомной массой 254, названного нобелием. Но в 1963 г. группа Флерова получила элемент № 102 с атомной массой 256, а многочисленные трехлетние исследования показали, что изотопа с массой 254 у этого элемента нет, т.е. сообщение шведов и американцев — фальсификация, и элемент № 102 стал первым элементом, полученным в СССР. Исследовать его свойства было очень трудно, так как его атомы распадаются за несколько секунд, и изучить свойства нужно всего по нескольким атомам. Но с помощью сверхчувствительного метода газовой радиохимии, разработанного в Дубне, эта задача была блестяще решена. Новый элемент обладал химическими свойствами, соответствующими актинидам (3-я группа Периодической таблицы), и советские ученые предложили назвать его в честь Фредерика Жолио-Кюри. Затем появилось сообщение об открытии элемента № 103 в США, который был назван в честь создателя циклотрона американского физика Лоуренса.
В это время в Дубне был получен и исследован элемент № 104, названный в честь академика И. В. Курчатова — курчатовий. О трудности этих работ говорит тот факт, что атом этого элемента существует всего лишь 0,3 с, а этот один атом получается в течение часа работы циклотрона. В 1967 г. Г.Н.Флеров высказал идею, что перспективным методом синтеза новых элементов может явиться деление сверхтяжелых составных ядер. В 1974—1975 гг. группа советских ученых во главе с Ю. Ц. Оганесяном осуществили синтез элементов № 106 и 107.
Новые частицы образовывались и в специальных устройствах — ускорителях. Если до середины века казалось, что существуют жесткие ограничения на передаваемую атомам энергию, связанные с увеличением массы разгоняемой частицы при скоростях, сравнимых со скоростью света (как в циклотронах), то благодаря работам советских физиков появились новые типы ускорителей. Академик В.И.Векслер предложил в 1944 г. принцип «авто-фазировки» ускоряемых частиц, что открыло новые возможности перед ядерной физикой и физикой элементарных частиц. На этом принципе в Объединенном институте ядерных исследований в Дубне были созданы фазотроны (с изменением частоты электрического поля), синхротроны (с изменением напряженности магнитного поля) и синхрофазотроны (комбинация обоих методов). В этих новых типах ускорителей поток заряженных частиц направляется на неподвижную мишень, и часть энергии расходуется на ускорение частиц мишени, что удорожает эксперименты. Академик Г. И.Будкер предложил создать ускоритель на встречных пучках, т.е. встречный пучок и играет роль мишени. Такой ускоритель был создан в Институте ядерной физики в Новосибирске.
