Основные способы выражения концентрации растворов
Количественный состав раствора чаще всего оценивают при помощи понятия концентрации, под которым понимают содержание растворенного вещества (в определенных единицах) в единице массы (объема) раствора (растворителя). Основными способами выражения концентрации растворов являются следующие:
1. Массовая доля вещества w(x) - это отношение массы данного компонента x, содержащегося в системе, к общей массе этой системы:
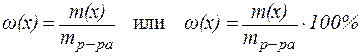 | (1) |
Выражается в долях единицы или в %. Массовая доля компонента в %показывает, сколько г данного компонента содержится в 100 г раствора. Например, раствор NaCl с массовой долей 0,9%содержит 0,9 г NaCl в 100 г раствора.
2. Молярная концентрация раствора С(х) - это отношение количества вещества компонента n(х) к объему раствора Vр-ра:
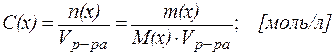 | (2) |
Единицей количества вещества является моль, т. е. то количество вещества, которое содержит столько реальных или условных частиц, сколько атомов содержится в 0,012 кг изотопа С12. При использовании моля как единицы количества вещества следует знать, какие частицы имеются в виду: молекулы, атомы, электроны или другие. Молярная масса М(х) - это отношение массы к количеству вещества (г/моль):
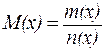
3. Молярная концентрация эквивалента С( 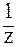 x) - это отношение количества эквивалента вещества n(
x) - это отношение количества эквивалента вещества n( 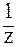 x) к объему раствора Vр-ра:
x) к объему раствора Vр-ра:
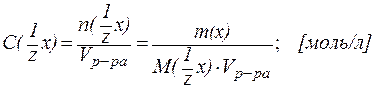 | (3) |
Химический эквивалент – это реальная или условная частица вещества, которая может замещать, присоединять или высвобождать 1 ион водорода в кислотно-основных или ионообменных реакциях.
Так же, как молекула, атом или ион, эквивалент безразмерен.
Масса моля эквивалентов называется молярной массой эквивалента М( 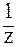 x).Величина
x).Величина 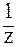 называется фактором эквивалентности. Она показывает, какая доля реальной частицы вещества соответствует эквиваленту. Для правильного определения эквивалента вещества надо исходить из конкретной реакции, в которой это вещество участвует, например, в реакции взаимодействия Н3РО4 с NaOH может происходить замещение одного, двух или трех протонов:
называется фактором эквивалентности. Она показывает, какая доля реальной частицы вещества соответствует эквиваленту. Для правильного определения эквивалента вещества надо исходить из конкретной реакции, в которой это вещество участвует, например, в реакции взаимодействия Н3РО4 с NaOH может происходить замещение одного, двух или трех протонов:
1. H3PO4 + NaOH = NaH2PO4 + H2O;
2. H3PO4 + 2NaOH = Na2HPO4 + 2H2O;
3. H3PO4 + 3NaOH = Na3PO4 + 3H2O.
В соответствии с определением эквивалента, в 1-й реакции замещается один протон, следовательно, молярная масса эквивалента вещества равна молярной массе, т. е. z = l и 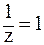 . В данном случае:
. В данном случае:
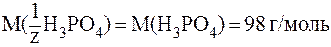 .
.
Во 2-й реакции происходит замещение двух протонов, следовательно, молярная масса эквивалента составит половину молярной массы Н3РО4, т. e. z = 2, а 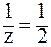 . Здесь:
. Здесь:
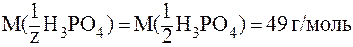 .
.
В 3-й реакции происходит замещение трех протонов и молярная масса эквивалента составит третью часть молярной массы Н3РО4, т.е. z = 3, a 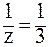 . Соответственно:
. Соответственно:
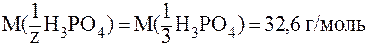 .
.
В реакциях обмена, где непосредственно не участвуют протоны, эквиваленты могут быть определены косвенным путем, введением вспомогательных реакций, анализ результатов которых позволяет вывести правило, что z для всех реакций равен суммарному зарядуобменивающихся ионов в молекуле вещества, участвующего в конкретной химической реакции.
Примеры:
1. AlCl3 + 3AgNO3 = Al(NO3)3 + 3AgCl¯.
Для AlCl3 обменивается 1 ион Al3+ с зарядом +3, следовательно, z = 1×3 = 3. Таким образом:
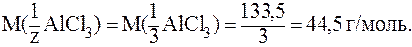
Можно также сказать, что обмениваются 3 иона хлора с зарядом -1. Тогда z = 3×1 = 3 и 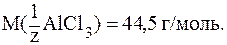
Для AgNO3 z = 1×1 = 1 (обменивается 1 ион Ag+ с зарядом +1 или обменивается 1 ион NO3- с зарядом -1).
2. Al2(SO4)3 + 3BaCl2 = 3BaSO4¯ + 2AlCl3.
Для Al2(SO4)3 z = 2×3 = 6 (обменивается 2 иона Al3+ с зарядом +3 или 3 иона SO42- с зарядом -2). Следовательно,
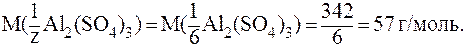
Итак, запись С( 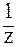 H2SO4) = 0,02 моль/л означает, что имеется раствор, в 1 л которого содержится 0,02 моль эквивалента H2SO4, а молярная масса эквивалента H2SO4 составляет при этом
H2SO4) = 0,02 моль/л означает, что имеется раствор, в 1 л которого содержится 0,02 моль эквивалента H2SO4, а молярная масса эквивалента H2SO4 составляет при этом 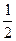 молярной массы H2SO4, т. е. 1 л раствора содержит
молярной массы H2SO4, т. е. 1 л раствора содержит 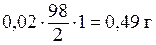 H2SO4.
H2SO4.
При факторе эквивалентности 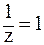 молярная концентрация эквивалента равна молярной концентрации раствора.
молярная концентрация эквивалента равна молярной концентрации раствора.
4. Титр Т(x) – это отношение массы вещества к объему раствора (в мл):
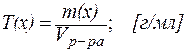 | (4) |
5. Моляльная концентрация (моляльность) b(х) – это отношение количества растворенного вещества (в молях) к массе m растворителя:
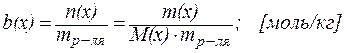 | (5) |
6. Мольная доля N(x) – это отношение количества вещества данного компонента,содержащегося всистеме, к общему количеству веществ системы:
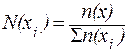 | (6) |
Выражается в долях единицы или в %.
7. Коэффициентом растворимости вещества Р(x) называют максимальную массу вещества, выраженную в г, которая может раствориться в 100 г растворителя.
