Гидролиз солей сильных кислот и слабых оснований
Данный тип гидролиза в общем случае выглядит следующим образом:
ВА + НОН ~» ВОН + Н+ + А'
Гидролиз по катиону
ВА: соли стрихнина, омнопона, синтетические азотистые соединения и т.д.
Прибавление кэтим растворам свободной кислоты, т.е. избытка водородных ионов, сдвигает равновесие влево. Уменьшение концентрации ионов водорода в растворе, например, в результате выщелачивания стекла, сдвигает равновесие вправо, т.е. усиливает гидролиз. Нагревание раствора во время стерилизации увеличивает степень диссоциации воды и повышает рН раствора за счет выщелачивания стекла. Это также вызывает значительное усиление гидролиза, что приводит к накоплению в растворе труднорастворимого основания.
Если основания алкалоидов являются относительно сильными или достаточно хорошо растворимыми в воде, то при повышении рН выпадение осадка не происходит (эфедрин основание). Иногда свободное основание не выпадает в осадой в следствии способности реагировать со щелочью с образованием растворимых продуктов (морфин, апоморфин,В растворах солей очень слабых оснований, малорастворимых в воде, незначительное повышение рН приводит к образованию осадка. При значительных увеличениях рН раствора (сильно щелочное стекло) иногда наблюдается выделение сильных свободных оснований, например новокаина.
Если алкалоид или синтетическое азотистое основание имеют сложноэфирные или лактонные группировки (новокаин), то при нагревании слабощелочных или нейтральных растворов происходит омыление сложного эфира или лактона. сопровождающееся изменением фармакологического действия. Так, после стерилизации растворов новокаина появляется свободная парааминобензойная кислота, благодаря чему рН раствора смещается в кислую сторону. При уменьшении рН до 8 количество разложившегося новокаина в растворе увеличивается до 11% . В литературе отмечаются сообщения о наличии анилина в растворах новокаина после стерилизации, что объясняется декарбоксилированием парааминобензойной кислоты.
Применение новокаина с примесью анилина вызывает повышенную болезненность..
Указанные выше изменения вызывают необходимость стабилизации растворов многих алкалоидов и азотсодержащих оснований. Большинство из них стабилизируют добавлением О.1н раствора кислоты хлористоводородной, нейтрализующей щелочь, выделяемую стеклом, и смещает рН раствора в кислую сторону. Это создает условия, препятствующие гидролизу, омылению сложных эфиров, окислению фенольных и альдегидных групп. Количество кислоты, необходимое для стабилизации раствора, зависит от свойств лекарственного вещества. Для получения устойчивого раствора новокаина гидрохлорида для инъекций с концентрацией 0,5—2,0% необходимо добавление 0,1 н раствора кислоты хлористоводородной до рН 3,8—4,5, что соответствует 3,4—9,0 мл 0.1 н раствора кислоты на 1 л раствора. Для приготовления стабильного раствора новокаина (1—2%) на изотоническом растворе натрия хлорида следует добавить 5 мл 0,] н раствора кислоты хлористоводородной на 1 л.
Для стабилизации растворов веществ со сложной эфирной группировкой (новокаин и др.) предложено уменьшение количества 0,1 н раствора кислоты хлористоводородной до 3-— 4 мл на 1 л раствора. Это связано с тем, что подкисление растворов местных анестетиков приводит к уменьшению их фармакологической активности. При снижении рН растворов от 5 до 3,2 активность новокаина уменьшается в 8 раз.
Теории окислительно-восстановительных процессов.
Механизм окислительно-восстановительного процесса раскрыт в перекисной теории А. Н. Баха и И. О. Энглера и теории разветвленных цепей Н. Н. Семенова. Согласно теории цепных реакций окисление развивается путем взаимодействия молекул исходного вещества со свободными радикалами, которые обращаются под влиянием инициирующих факторов. Свободный радикал начинает цепь окислительньгх превращений. Он реагирует с кислородом, образуя лероксидный радикал, с другими молекулами легко окисляющихся веществ образующий промежуточный продукт гидропероксид и новый свободный радикал:
hv,T
RH -> R' + H1
R1 + О2 ->R-O-O'
• пероксидный радикал
R-O-Or + RH-> R-O-O-H + R'
гидропероксид алкильный радикалГидропероксид распадается с образованием свободных радикалов, продолжают процесс окисления новых молекул лекарственного вещества. Процесс принимает характер цепных реакций
В ходе окисления может произойти разветвление цепной реакции, в результате чего образуется сложная смесь продуктов окисления:
ROOH -> RO1 + ОН1 ■ RO1 + RH -» ROH + R1 OH' + RH -» H2O + R'.
Исходя из сказанного выше, процесс окисления можно замедлить, если ввести:
— вещества, быстро реагирующие с алкильными радикалами;
— соединения, быстро реагирующие с пероксидными радикалами, что снизит скорость образования гидропероксидов и генерирование радикалов;
— вещества, разрушающие гидропероксиды с образованием молекулярных продуктов, не образующих свободных радикалов.
Необходимо отметить, что в фармацевтической технологии ингибиторы, прерывающие цепную реакцию, не применяются, так как они эффективны только при полном отсутствии кислорода.
Механизм действия антиоксидантов. Важное значение имеют стабилизаторы, позволяющие предохранять лекарственные вещества от нежелательного воздействия кислорода, так называемые антиокислители, или антиоксиданты.
По механизму защиты чувствительных лекарственных веществ различают две группы антиоксидантов:
1. Восстановители, которые обладают более высокой способностью к окислению, связывая кислород и тем самым предотвращают нежелательные процессы в растворах.
2. Отрицательные катализаторы, или антикатализаторы.— вещества, образующие комплексные соединения с ионами тяжелых металлов, провоцирующие окислительно-восстановительные процессы.
По происхождению ингибиторы окисления делятся на природные и синтетические. Природные антиоксиданты (АО) выделяют из различных частей растений. По химическому строению большинство применяемых на практике природных АО относится к производным полифенолов.
По растворимости АО классифицируют на:
— растворимые в воде;
— растворимые в маслах.
Требования к АО, применяемым в производстве фармацевтических препаратов:
1. Безвредность в применяемых дозах, отсутствие раздражающего действия, аллергических реакций как самих АО, так и продуктов их метаболизма и образующихся при воздействии с ними других ингредиентов состава.
2. Эффективность при низкой концентрации.
3. Хорошая растворимость в продуктах, подлежащих защите от окисления. Характеристика группы восстановителей. Восстановители, или прямые антиоксиданты,
подразделяются на несколько групп:
1. Вещества, препятствующие образованию активных радикалов из гидропероксидов. Механизм их действия:
RO'2 + InH-» ROOH+ In',
где InH — антиоксидант с подвижным атомом водорода: In1 ■— малоактивный радикал антиоксиданта.
К наиболее эффективным средствам этой группы относятся фенол, аминофенолы, анальгин, парааминофенол, нафтолы, ароматические амины.2. Вещества, разрушающие гидр опер оксиды. Не останавливают цепной процесс окисления, но, снижая скорость разветвления цепей, замедляют окислительные реакции. Тормозящее действие таких восстановителей тем сильнее, чем выше скорость реакции этих веществ с гидропероксидами. Это соли сернистой кислоты, органические соединения серы (натрия сульфит — Na2SC>3, натрия метабисульфит — Na2S2O3, натрия бисульфит — NaHSC>3, унитиол, ронгалит, тиомочевина и др.).
Ронгалит Н — C-SH ОН
I I
Н2 — С - SH Н2С — SCbNa
I I
Н2 — С — SO3Na NH2 — С — NH2
II Унитиол S
Тиомочевина
Органические соединения, содержащие серу — сильные восстановители. Их действие основано на быстром окислении серы. Механизм их действия: ROOH + R'SR ->ROH + R'2SO ROOH + R'2SO -> OH + R'2SO2
Негативная сторона данной группы — летучесть и разложение их при стерилизации, уменьшающиеся в среде инертных газов (азота и т. д.).
3. Вещества, обрывающие цепь окисления по реакции с алкильными радикалами. К ним относят хиноны, нитросоединения, молекулярный йод. Учитывая, что кислород очень быстро реагирует с алкильными радикалами, эти ингибиторы малоэффективны, однако эффективны при недостатке кислорода.
Еще одним возможным методом стабилизации легкоокисляющихся веществ может быть использование высокомолекулярных веществ (полиглюкин, пропиленгликоль, полиэтиленоксид с низкой молекулярной массой и др.). В среде этих веществ замедляется окисление, что возможно объяснить проникновением низкомолекулярного лекарственного вещества вовнутрь молекулы ВМС и, следовательно, уменьшением их реакционной способности. Окисление может быть уменьшено за счет устранения действия света и температуры. Иногда приготовление некоторых лекарственных средств (например, раствора фенотиазина) целесообразно проводить при красном свете или при хранении использовать ампулы из светозащитного стекла.
Применение консервантов также способствует повышению стабильности многих препаратов в ампулах. Среди консервантов используются этиловый спирт 95%, нипагин, нипазол, хлорбутанолгидрат, смесь этилового спирта с глицерином и др.
Физические методы стабилизации ампулированных растворов. Физические методы стабилизации также направлены на максимальное устранение факторов, вызывающих или ускоряющих негативные процессы в инъекционных растворах. К технологическим приемам повышения стабильности растворов в ампулах можно отнести:
■—дополнительную (специальную) очистку исходных веществ или растворителей;
— покрытие внутренней поверхности ампул химически стойкими пленками;
— использование оптимальных методов и режимов стерилизации;
— изготовление лекарственных препаратов в виде стерильных порошков или таблеток, из которых готовятся инъекционные растворы:
— предварительное связывание (удаление) кислорода в растворителях;
— ампулирование с применением газовой защиты.
Для удаления кислорода из воды можно использовать электролитические, химические и физические методы. Заслуживают внимания некоторые физические методы: удаление кислорода кипячением; барботажем инертными газами; распылением воды в вакууме;дистилляция воды в среде углекислого газа или азота. В некоторых случаях возможъ использование органических смол для связывания растворенного кислорода.
В условиях промышленного производства инъекционных растворов предварительное связывание кислорода в растворителе нерационально, так как на последующих технологических стадиях производства растворов в ампулах снова происходит его насыщение. Поэтому более целесообразно удалять его непосредственно перед заполнением ампул. Один из способов удаления кислорода — метод, основанный на изменении растворимости газов в жидкостях при различных температурах (от 20 до 100 °С). а также использование водяного пара в качестве инертной среды.
Принцип ампулирования растворов в среде инертных газов. В газовом пространстве и в растворе содержится достаточное количество кислорода, способствующее окислению растворов лекарственного вещества. Для получения стабильных растворов необходимо в ампуле максимально заменить воздух на инертный газ и удалить кислород из раствора, так как растворимость газа в жидкости изменяется в широких пределах в зависимости от газа, растворителя, давления и температуры. При этом раствор предварительно насыщается газом, ампулы непосредственно перед заполнением и запайкой продуваются инертным газом. В качестве инертной среды могут использоваться углекислый газ, азот, аргон.
На основании исследований, руководимых проф. Ф. А. Коневым (ГНЦЛС) разработана и внедрена технология ампулирования инъекционных растворов с газовой защитой при использовании вакуумного способа наполнения ампул.
Таким образом, устойчивость растворов легкоокисляющихся веществ зависит от многих факторов, а их стабилизация осуществляется путем использования различных технологических приемов и соблюдения ряда условий.
Использование консервантов в производстве препаратов парентерального назначения. Одна из причин снижения качества лекарственных средств — их микробная контаминация в процессе производства или применения, которая может привести к снижению терапевтического эффекта препаратов или развитию у больного различного рода заболеваний. В связи с этим инъекционные лекарственные формы можно применять только при отсутствии в них микроорганизмов, т. е. стерильными. Введение консервантов в растворы проводится в тех случаях, когда сохранение стерильности гарантировать нельзя
Каждое антимикробное вещество, используемое для консервации лекарств, должно обеспечивать безопасность больного и необходимое качество лекарственного препарата, Исходя из этого к консервантам предъявляются следующие требования:
—- широкий спектр антимикробного действия при низких концентрациях;
— хорошая растворимость;
совместимость с большинством лекарственных и вспомогательных веществ, упаковочными материалами;
— стабильность в широком интервале рН и температуры среды в течение срока годности лекарственного препарата;
— отсутствие влияния на органолептические свойства лекарственного препарата;
— отсутствие способности к образованию устойчивой формы микроорганизмов. Консерванты не должны снижать фармакологическую эффективность действующего
вещества или оказывать токсическое, аллергизирующее и раздражающее действие на организм человека.
До настоящего времени не найдено еще ни одного химического соединения, полностью отвечающего этим требованиям. Каждое из применяемых консервантов имеет определенные ограничения, поэтому их используют в тех случаях, когда предотвратить контаминацию лекарственных средств другими способами невозможно.
В настоящее время принята следующая классификация консервантов:
1. Неорганические соединения.
2. Металлоорганические соединения.
3. Органические— спирты; фенолы:
— органические кислоты;
— соли четвертичных аммониевых соединений;
— эфирные масла.
Механизмы воздействия консервантов на микроорганизмы (микробиологическая стабилизация) очень различны и определяются их химическим строением. Основным результатом при этом ■ является нарушение жизненных функций клетки, в частности инактивация белковой части клеточных ферментов. В зависимости от степени инактивации наступает либо гибель клетки, либо замедление ее жизненных функций. Скорость и глубина превращений, протекающих при этом, зависит как от физических (температура, концентрация, фазовое состояние, рН среды и т. д.), так и от химических факторов.
Немаловажное значение имеет способ фиксации консервантов биологическими средами или объектами, входящими в систему лекарственного средства, в частности; адсорбция на поверхности клетки, на молекулах органических веществ (например, крови) или на мелкодисперсных частицах суспензии. В двух первых случаях явления адсорбции полезно, поскольку представляет собой начальный этап к достижению антимикробного эффекта. В остальных случаях адсорбция приводит к снижению концентрации консерванта в лекарственном препарате, т. е. к ослаблению антимикробной активности.
Адсорбция консервантов элементами упаковки имеет место не только в процессе изготовления лекарств, но и при их хранении. Поэтому при определении эффективных для консервирования концентрации антимикробных веществ должны учитываться потери их активности во времени.
Среди факторов, ослабляющих антимикробное действие консервантов, следует отметить присутствие в лекарственном средстве неиноиогенных ПАВ, которые образуют комплексы со многими консервантами, снижают их свободную концентрацию и, соответственно, антимикробный эффект.
Для консервирования жидких лекарственных препаратов могут использоваться следующие вещества: бензалкония хлорид, хлорбутол, фенилэтиловый спирт, хлоргексидина диацетат или биглюконат, тиомерсал, сорбиновая и борная кислоты, ронгалит, нипагин, нипазол и др.
Лекарственные средства для внутриполостных, внутрисердечных, внутриглазных или других инъекций, имеющих доступ к спинно-мозговой жидкости, а также при разовой дозе, превышающей 15 мл, не должны содержать консервантов.
Перспективным подходом к решению проблемы антимикробной защиты лекарственных препаратов следует назвать применение комбинации консервантов. Это позволит расширить спектр антимикробного действия, применять их в более низких концентрациях, предупреждать возможность появления мутантов микроорганизмов. Эффективным оказалось применение фенилэтилового спирта (0,4%), ЭТДА (0,05%) в сочетании с бензалкония хлоридом, хлоргексидина ацетатом, хлорбутолом; смеси бензалкония хлорида и хлоргексидина.
Чаще использование консервантов сочетают с другими методами стерилизации (газовой или стерильной фильтрацией) для приготовления в асептических условиях растворов, не требующих тепловой стерилизации.
Таким образом, выбор консерванта определяется составом, лекарственного средства, рН среды, режимом его применения. Только комплексный подход и строгое соблюдение требований GMP к производству стерильной продукции будет способствовать решению проблемы антимикробной защиты лекарственных препаратов.
Так как раствор готовился без стабилизатора, то при значительных увеличениях рН раствора (сильно щелочное стекло) иногда наблюдается выделение сильных свободных оснований, например новокаина.Раствор новокаина стабилизируют добавлением 0.1 н раствора кислот», хлористоводородной, нейтрализующей щелочь, выделяемую стеклом, и смещает рН раствора в кислую сторону. Это создает условия, препятствующие гидролизу, омылению сложных эфиров,окислению фенольных и альдегидных групп.
Стабилизация 5, 10 и 20% растворов новокаина Для стабилизации этих растворов недостаточно введения кислоты хлороводородной до рН 3,8-—4,5, поскольку в процессе стерилизации происходит интенсивное окисление. Поэтому используют антиоксиданты, а также их комбинации по прописи:
Новокаина — 50,0 или 100,0
Натрия метабисульфита или
калия метабисульфита — 3,0
Кислоты лимонной — 0,2
Раствора 0,1 н кислоты хлороводородной — 10 мл
Вода для инъекций -— до 1 л
Приготовление 5% раствора новокаина для спинномозговой анестезии готовят асептически на цитратном буферном растворителе с добавлением в качестве стабилизатора 1,5% поливинола.
Новокаина гидрохлорид — соль слабого азотистого основания и сильной хлористоводородной кислоты, содержит сложноэфирнуюгруппу и аминогруппу с подвижными атомами водорода.
При термической стерилизации ускоряются процессы гидролиза и окисления нестабилизированного раствора новокаина, образуется основание новокаина, представляющее собой нерастворимую, маслянистую жидкость. Одновременно происходит щелочной гидролиз сложноэфирной группы. Возможно окисление аминогруппы.
Нормативные документы предписывают добавлять для стабилизации растворов новокаина (0,25, 0,5, 1%-ного) определенное количество кислоты хлористоводородной.
Для создания оптимального рН (3,8 — 4,5) целесообразно брать точный объем 0,1 М раствора хлористоводородной кислоты с учетом концентрации растворов новокаина. Так, для изготовления 1 л 0,25%-ного раствора новокаина требуется 3 мл, 0,5%-ного — 4 мл, 1 и 2%-ного — по 9 мл, 5 и 10%-ного — по 12 мл.
Процессы гидролиза и окисления ускоряются в растворах новокаина более высоких концентраций (2, 5 и 10%), предназначенных для анестезии слизистой горла и носа. В соответствии с НД в эти растворы добавляют еще и антиоксидант — натрия тиосульфат — 0,5 г на 1 л раствора, что позволяет резко (до 4, 6, 8 мл соответственно) сократить количество 0,1 М раствора хлористоводородной кислоты и значительно (до 90 дней) увеличить срок хранения раствора.
Учитывая, что в спинномозговой канал нельзя вводить стабилизаторы, раствор новокаина 5%-ный для спинномозговой анестезии готовят в асептических условиях на стерильной воде для инъекций. Предварительно стерилизуют порошок новокаина щадящим методом (в воздушном стерилизаторе при 120 °С 2 ч). Раствор фильтруют через мембранные фильтры и не стерилизуют, так как растворы новокаина без стабилизатора не выдерживают стерилизацию даже текучим паром.
Вопрос 3.
FJores Crataegi —- цветки боярышника {Crataegi flos —боярышника цветок) Fructus Crataegi — плоды боярышника {Crataegi fructus—боярышника плод) Сем. розоцветные (Rosaceae): боярышник кроваво-красный — Crataegus sanguined Pall., б. сглаженный — С. laevigata (Poir.) DC. (= б. колючий —С. oxyacantha sensu Pojark.), б. Король-кова —- С. korolkowii L Henry (= б. алтайский — С. altaica (Loud.) Lange, p. p.), 6. зеленоплодный — С. chloroca-pa Lenne et С Koch (= б. алтайский— С. altaica (Loud.) Lange, p. p.), б. даурский — С. dahurica Koehneet Schneid., б. однопестичный — С. топодупа Jacq., б. германский — С. allemanniensis Cin,,6. восточнобалтийский — С. orientobaltica Cm., б.отогауточашелистико-вый — С. curvisepala Lindm., б. курземский — С. х curonica Cm.., б. даугавский — С. х dunensis Ст.. б. пятипестичный — С. pentagyna Waldst. et Kit.
Основными районами заготовки сырья в промышленных масштабах являются Алтайский и Красноярский края, ряд областей Западной Сибири и Урала. В большом количестве возможна заготовка сырья в Краснодарском и Ставропольском краях, Воронежской области, в ряде республик Северного Кавказа, во многих областях Украины и прилегающих областях РФ.
Сырьевая база вполне достаточна для удовлетворения потребности в сырье за счет дикорастущих и культивируемых видов боярышника.
Химический состав.В цветках и плодах содержатсяфлавоноидные гликозиды, производные кверцетина — гиперозид (основной компонент) и кверцитрин, а также ацетилвитексин, витексин. пиннатифидин.
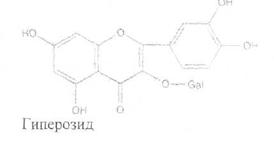
Заготовка, первичная обработка и сушка.Цветки собирают в начале цветения, когда часть их еще не раскрылась. Собранные в конце цветения, они темнеют при сушке; в случае сбора бутонов сырье долго не сохнет и буреет. Период цветения составляет 3-4 дня. Сбор сырья проводят после схода росы, обрывая целиком соцветия или их части. Раскладывают для сушки не позже чем через 1-2 ч после заготовки. При раскладке сырья удаляют цветки, поврежденные насекомыми, и другие части растения (веточки, листья).
Сушат в сушилках при температуре до 40 °С, на чердаках, под навесами или в помещениях с хорошей вентиляцией, разложив их тонким слоем на бумаге.
Плоды в зрелом состоянии срывают целиком в виде соплодий — щитков. Продолжительность сбора около месяца.
Сушат в теплых помещениях или сушилках при температуре до 70 °С на решетках, после провеивают для отделения плодоножек и других примесей.
Стандартизация.Плоды. Цельное сырье. Суммы флавоноидов в пересчете на гиперозид (спектрофотометрический метод) не менее 0,06 %, влажность не более 14 %; золы общей не более 3 %; золы, нерастворимой в 10 % растворе кислоты хлористоводородной, не более ] %.
Хранение.На складах сырье хранят на стеллажах и подтоварниках, в сухом проветриваемомпомещении. Срок годности цветков 3 года, плодов — 2 года.
Использование.Из цветков получают настой, из плодов — настойку, отвар и жидкий экстракт. Применяют как кардиотоническое средство при функциональных расстройствах сердечной деятельности, сердечной недостаточности, после перенесенных тяжелых заболеваний и при начальных формах гипертонии, аритмии, ангионеврозах,бессоннице. В сочетании с сердечными гликозидами терапевтический эффект достигается при значительно меньших дозах препаратов и снижается их токсическое действие.
Жидкий экстракт плодов входит также в состав препарата «Кардиовален».
Порошок цветков и плодов выпускается в фильтр-пакетах.
Используется также в гомеопатии.
Качественные реакции.Измельченное сырье в количестве 0,5 г кипятят в течение 15 мин с 5 мл 95 % спирта. После охлаждения извлечение декантируют и 0,0 J мл раствора микропипеткой наносят на пластинку «Силуфол» (15X15 см)в виде полосы длиной 1 см, рядом наносят в виде точки — 0,005 мл 0,1 % раствора Государственного стандартного образца (ГСО) гиперозида. Пластинку с нанесенными пробами высушивают на воздухе в течение 5 мин, затем помещают в камеру со смесью растворителей хлороформ — метиловыйспирт (8:2) и хроматографируют восходящим способом (смесь растворителей заливают в камеру непосредственно перед хроматографированием). Когда фронт растворителей дойдет до конца пластинки, ее вынимают из камеры, высушивают в вытяжном шкафу в течение 2 мин и просматривают в УФ-свете при длине волны 360 нм. На уровне пятна ГСО гиперозида должна появиться полоса темно-коричневого цвета. Затем пластинку обрабатывают 5 % спиртовым раствором алюминия хлорида и нагревают ее в течение 2—3 мин в сушильном шкафу при температуре 100—105°С. При этом пятно приобретает ярко-желтую окраску в видимом и яркую желто-зеленую флюоресценцию в УФ-свете (гиперозид).
В растительном сырье и препаратах флавоноидные соединения обнаруживают с помощью качественных реакций и методов хроматографии. Характерной реакцией на флавоноиды является цианидиновая проба (проба Шинода), основанная на восстановлении их атомарным водородом в кислой среде в присутствии Mg2+.
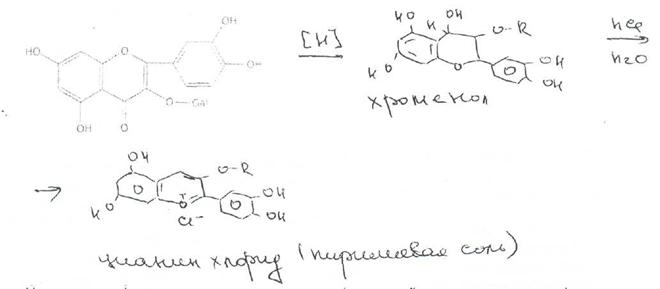
Присутствие фенольных гидроксилов и карбонильной группы позволяет флавоноидам образовывать комплексы различной степени устойчивости с солями металлов
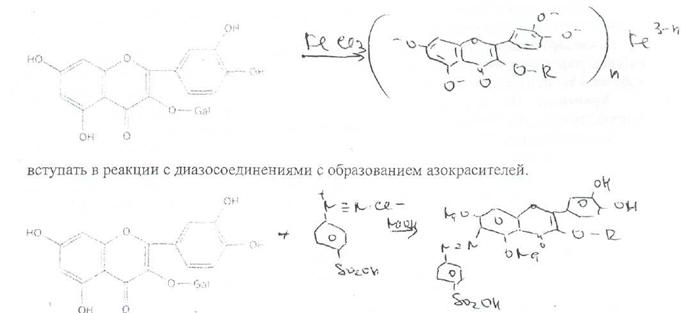
Характерной реакцией на флавоноиды считается также их взаимодействие с щелочами.
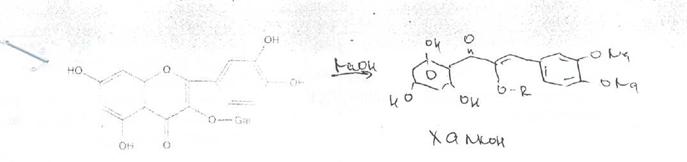
Флавоны, флавонолы, флаваноны и флаванонолы растворяются в щелочах с ооразованием желтой окраски, которая при нагревании изменяется до оранжевой или коричневой.
Количественное определение. 1.Взятие аналитической пробы
2. Получение извлечения
3. Очистка извлечения методом ТСХ
4. Элгоирование
5. Снятие оптической плотности элюата.
6. расчет колич. содер.
Вопрос 4. Рецепт выписан верно. НЕО для лидокаина не регламентированы. Отпуск отдельных ЛС производится в количествах, не превышающих предельно допустимых норм на один рецепт. Поэтому на следующем этапе аптечный работник проверяет, соответствует ли количество выписанных ЛС установленным приказами Минздрава России от 23.08.99 № 328 и от 09.01.2001 № 3 предельно допустимым для выписывания нормам.
Срок действия рецепта - 2 мес. Рецепт отдается больному с указание на обороте количества отпущенного препарата и даты отпуска и не хранится в аптеке. По истечении срока действия рецепт гасится штампом «Рецепт не действителен».
Способ применения ЛС обозначается на русском или русском и национальном языках с указанием дозы, частоты, времени приема и его длительности.
Инъекционные препараты хранят в прохладном темном месте в шкафу или изолированном помещении. Лидокаин и новокаин хранят по сипску Б.
СЪилет №10. Вопрос L__J-
Раствор Рингера Состав: Натрия хлорида 0,9 г Натрия гидрокарбоната 0,02 г Калия хлорида 0,02 г Кальция хлорида 0,02 г Воды до 100 мл
| Лекарственное вещество Химическая Описание формула |
Sodium Chloride (Natrii chloridum)— NaCl Белые кубические кристаллы или
натрия белый кристаллический пор'сшок без
хлорид запаха, соленого вкуса
Potassium Chloride (Kalii chloridum) KCI Бесцветные кристаллы или белый
— калия хлорид кристаллический порошок без запаха,
соленого вкуса
Calcium Chloride (Calcii chloridum)— СаС12*6Н?О Бесцветные кристаллы без запаха, кальция хлорид горько-соленого вкуса. очень
гигроскопичные, расплываются
на воздухе, переходя при 34 °С в
дигидрат. Он очень легко растворим в
воде с образованием растворов
нейтральной реакции. Раствор в воде
при этом сильно охлаждается. В
отличие от многих неорганических
солей кальция хлорид легко
растворяется в этаноле.
Natrii hydrocarbonas — натрия NaHCO] Натрия гидрокарбонат растворим в
гидрокарбонат воде, практически нерастворим в
этаноле. Водные растворы имеют слабощелочную реакцию.
Постепенно, особенно при
взбалтывании и нагревании
растворов, натрия гидрокарбонат переходит (при 70 °С) в двойную соль Na2CO3 • NaHCO3, а при 100°С почти нацело превращается в натрия карбонат ИагСОз. Это следует иметь в виду при приготовлении и хранении растворов натрия гидрокарбоната.
-Определение подлинности. Хлориды. К 4—5 каплям раствора прибавляют 0,5 мл
разведенной азотной кислоты и 2—3 капли раствора серебра нитрата. Образуется белый
творожистый осадок, растворимый в растворе аммиака. СГ + Ag+ -> AgCI iAgCI + 2NH3 • H2O -> [Ag(NH3)2]CI+ 2H2O
Калия хлорид. Соли калия окрашивают бесцветное пламя горелки в фиолетовый цвет (при рассматривании через синее стекло — пурпурно-красный). Катион калия можно также обнаружить реакцией с винной кислотой (в нейтральной или уксуснокислой среде) по образованию белого кристаллического осадка;

Осадок гидротартрата калия растворяется в разбавленных минеральных кислотах (с образованием винной кислоты) и в растворах гидроксидов щелочных металлов с получением двухзамещенных тартратов. 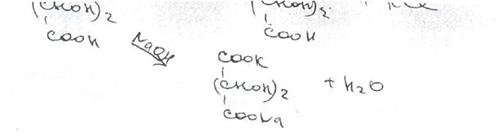
Соли калия в уксуснокислой среде (рН 4-6) образуют с гексанитрокобальтатом (Ш) натрия желтый кристаллический осадок:
2KCI + Na3[Co(NO2)6] -> K2Na[Co(NO2)6]4+ 2Na+
При действии щелочами происходит превращение в тёмно-бурый осадок гидроксида кобальта (III):
K2Na[Co(N02)6] + 3NaOH -» Co(OH)3+ 2KNO2 + 4NaNO2
Осадок постепенно приобретает розовую окраску в связи с образованием гидроксида кобальта (II).
Упаривают 2 мл раствора на водяной бане до 0,5 мл прибавляют 2—3 капли разведенной уксусной кислоты и 1—2 капли раствора натрия кобальтинитрита. Постепенно образуется желтый кристаллический осадок.
Кальция хлорид.
Наличие иона кальция устанавливают по окрашиванию бесцветного пламени горелки в кирпично-красный цвет и по образованию белого осадка при добавлении оксалата аммония к раствору кальция хлорида. Осадок растворим в разведенных минеральных кислотах, поэтому реакцию необходимо вести в нейтральной среде или в присутствии уксусной кислоты:
Са(СН3СОО)2 + (NH4)2C2O4 = CaC2O4+ 2CH3COONH4
В разбавленных растворах ион кальция образует с серной кислотой (1:4) характерные игольчатые кристаллы CaSO4 ° 2Н2О.
Гексацианоферрат (II) калия при рН 7 в присутствии хлорида аммония образует с ионами кальция белый кристаллический осадок:
СаС12 + K4[Fe(CN)6] + NH4CI -> KNH4Ca[Fe(CN)6] + 3KCI
Количество ионов калия и аммония может меняться от 0 до 2 в зависимости от условий реакции.
К 2—3 мл раствора прибавляют 3—5 капель раствора аммония оксалата. Постепенно образуется белый осадок, нерастворимый в разведенной уксусной кислоте и растворе аммиака, растворимый в разведенных минеральных кислотах.
Натрия гидрокарбонат. Подлинность его устанавливают по наличию иона натрия и гидрокарбонат-иона. Последний обнаруживают с помощью реакции разложения разведенной хлороводородной кислотой, которое происходит с выделением пузырьков газа:
NaHCO3+ HCI -> NaCI + Н2О + СО2
Количественное определение. Натрия хлорид, калия хлорид и кальция хлорид. Метод Мора.
Количественное определение галогенидов выполняют аргентометрическим методом. Лекарственные препараты хлоридов титруют в нейтральной среде, в качестве индикатора используют хромат калия (метод Мора). Реакции протекают по схеме:
NaCI +AgNO3 -> AgCl|+ NaNO3
KCI+ AgNO3 -> AgCIl^ KNO3
CaCI2 + 2AgNO3 -> 2AgCI^ Ca(NO3)2Избыток титранта (первая капля) взаимодействует с индикатором с образованием осадка оранжево-красного цвета, по которому устанавливают конечную точку титрования;
2AgNO3 + К2СЮ4 -> Ag2Cr04^ 2KNO3
Титруют 1 мл раствора 0,1 моль/л раствором серебра нитрата до оранжево-желтого окрашивания (индикатор — хромат калия).
1 мл 0,1 моль/л раствора серебра нитрата соответствует 0,00593 г суммы натрия, калия и кальция хлоридов.
Натрия гидрокарбонат. Метод кислотно-основного титрования (ацидиметрия). Титруют 5 мл раствора 0,02 моль/л раствором соляной кислоты до красного окрашивания (индикатор — метиловый красный).
NaHCO3 + НС1 -> NaCI + Н2О + СО2
Э - М - 84
1 мл 0,02 моль/л раствора соляной кислоты, соответствует 0,00168 г натрия гидрокарбоната.
Кальция хлорид. Метод прямого комплексонометрического титрования. К 10 мл раствора прибавляют 5 мл аммиачного буферного раствора, 0,05 г индикаторной смеси кислотного хром-темно-синего и титруют 0.01 моль/л раствором трилона Б до сине-фиолетового окрашивания.
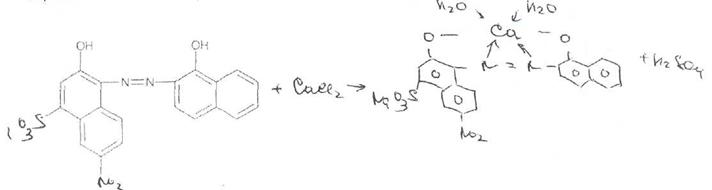
Титрант — 0,05 М раствор трилона Б (ЭДТАКаг) связывает находящиеся в растворе ионы кальция в комплексное соединение:

Поскольку при этом происходит выделение соляной кислоты, для поддержания оптимального значения рН среды необходимо прибавлять аммиачный буферный раствор.
В эквивалентной точке, когда все ионы кальция будут связаны в комплексное соединение' металл — ЭДТА Na?, титрант вступает во взаимодействие с ионами кальция, содержащимися в составе комплекса металл — индикатор. Последний имеет меньшую константу устойчивости, чем комплексное соединение ЭДТАЫаг —- металл, поэтому происходитразрушение комплекса индикатора с ионами" магния. При этом красно-фиолетовая окраска раствора переходит в синюю окраску свободного индикатора:
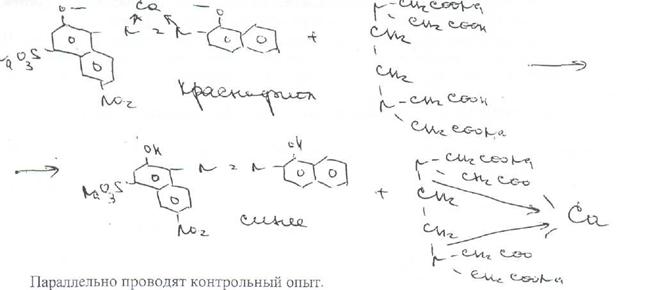
1 мл 0,01 моль/лраствора трилона Б соответствует 0.00219 г кальция хлорида.
