Реакции нуклеофильного присоединения
к карбонильной группе альдегидов и кетонов ( АN )
В карбонильной группе присутствуют две связи π и σ распределение электронной плотности, неравномерноевследствие различной электроотрицательности атомов углерода и кислорода , которые находятся в sp2 – гибридном состоянии. Создаются два центра, которые отзываются на активные частицы с противоположными зарядами ( + ) и ( - )
 |
б+ б–

 > С = О
> С = О
электрофильный центр нуклеофильный центр
атакует частица ( -) или с атакует частица (+ ),
повышенной электронной электрофил Е+.
плотностью, нуклеофил Nu
Донорные заместители подают электронную плотность в сторону атома углерода и снижают величину заряда б+ .Акцепторные заместители смещают электронную плотность от атома углерода и увеличивают заряд б+, усиливая поляризацию связи ( условно изображены разные величины частичных зарядов).
б+ б+
R —>СН = О R<— СН = О
донор акцептор
Акцепторные заместители должны увеличивать скорости реакций, а донорные заместители- уменьшать.
Химические свойства карбонильных соединений:
1. реакции нуклеофильного присоединения к карбонильной группе
2. электрофильные реакции замещения у атома углерода в соседнем, α – положении к карбонильной группе.
Реакции нуклеофильного присоединения
Карбонильные соединения реагируют с достаточно большим количеством
нуклеофилов :
НОН, RОН , НСN , RSН , Н2S , RNН2 , НС1, НВг, NаНSО3( натрия гидросульфит), RNHNH2 ( гидразин).
Механизм реакции становится ясным, если представить схему процесса и образование двух возможных промежуточных соединений:
А) Первым атакует ( Е+)электрофил. Образуется карбокатион, на атоме углерода появляется заряд (+). Атом углерода имеет гибридизацию sp2 и тригональное строение .
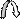 б + б - ( +)
б + б - ( +)
> С = О + Е+Nu–——> > С — О — Е
Б)Первым атакует (Nu–) нуклеофил. Образуется анион, отрицательный заряд локализован на атоме кислорода, атом углерода тетраэдрический, гибридизация sp3 , образует 4 ковалентные связи.
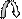 б+ б-
б+ б-
> С = О + Е+Nu–——> > С — О ( - )
|
Nu
Понятно, что анион( вариант Б) является более устойчивым,, чем карбокатион
( вариант А ). Известно множество примеров существования устойчивых анионов :
гидроксид НО – , анионы неорганических и органических кислот RCOO– .
Поэтому реакции с участием карбонильной группы проходят по механизму нуклеофильного присоединения. Для большинства реакций требуется кислая среда, которая способствует образованию карбокатиона, к которому легко присоединяется
нуклеофильная частица.
б+ б- + Nu
> С = О + Н+ ——> > С – О —Н + ——> > С — О– + Н+
|
Nu
1. Присоединение воды. Обратимая гидратация карбонильной группы происходит при растворении альдегида в воде, образуются гем-диолы, которые существуют только в растворе. Формальдегид гидратирован на 100% , ацетальдегид- на 58%, ацетон – менее 1%. Эти данные доказывают снижение реакционной способности карбонильной группы под влиянием заместителей с (+) индуктивным эффектом. Водный раствор формальдегида- формалин, w=40%, используется для изготовления анатомических и гистологических препаратов.
R—СН = О + НОН <=> R—СН – ОН
|
ОНгидрат альдегида
Трихлорэтаналь( жидкость, Т кип. 970 ) присоединяет воду и существует в виде устойчивого кристаллического соединения- хлоралгидрата СС13 СНО • Н2О, который использовали как успокаивающее и снотворное средство, и сейчас применяют в ветеринарии. Пример этого соединения подтверждает, что заместители с (–) индуктивным эффектом увеличивают реакционную способность карбонильной группы и устойчивость продуктов присоединения.
ОН
|
С13С- СНО + НОН —> С13 С– С – ОН
трихлорэтаналь | хлоралгидрат
ОН
2. Образование полуацеталей и ацеталей
Альдегиды в кислой среде образуют полуацетали при взаимодействии со спиртами. Полуацеталь сохраняет свойства альдегида и качественные реакции, характерные для альдегидной группы( «серебряного зеркала» и др.). При действии избытка спирта полуацеталь превращается в ацеталь, который не сохраняет свойства альдегидной группы. Гидролиз полуацеталя и ацеталя возможен только в кислой среде и не возможен в щелочной.
б+ б- б+ б - ROH
R—СН = О + Н —ОR <=> R—СН – ОН ——> R—СН – ОR
АN | SN |
ОRОR
полуацеталь ацеталь
Циклические полуацетали – результат внутримолекулярной реакции АN, которая возможна у гидроксиальдегидов, если гидроксигруппа находится в положении 4 или 5 в углеродной цепи.
б-
 СН2– СН2– СН2 –СН2– СНО СН2 –СН2– СН–ОН
СН2– СН2– СН2 –СН2– СНО СН2 –СН2– СН–ОН
| <=> | |
О - Н СН2 –СН2–О циклический полуацеталь
5-гидроксипентаналь шестичленный цикл носит название пирановый
пространственное строение «кресло»
Среди природных соединений распространены циклические полуацетали моносахаридов ( подробно в лекции по теме « Углеводы»).
Полуацетали образуются в качестве промежуточных соединений при обмене пировиноградной и α – кетоглутаровой кислот при участии витамина В1 – тиаминпирофосфата.
3.Образование циангидринов- присоединение циановодорода НСN к карбонильной группе альдегидов и кетонов
Реакция катализируется основаниями. т.к. НСN – слабая кислота. Циангидрины распространены в природе, в растениях они связывают синильную кислоту. В горьком миндале содержится до 2-4% циановодорода, много в вишневых и незрелых косточках
абрикоса, поэтому они представляют опасность при употреблении в пищу или изготовлении варенья, компотов с косточками.
Бензоциангидрин синтезируется некоторыми насекомыми и используется в качестве защиты, парализуя дыхательный центр врагов-насекомых.
С6 Н5 — СН = О + НСN ——> С6 Н5 — СН — ОН
|
бензальдегид СN бензоциангидрин
4.Образование тиополуацеталей - присоединение тиолов(синонимы- тиоспиртов, меркаптанов)
Реакция исключительно важна для понимания процессов с участием ферментов, которые в своем активном центре содержат тиольные группы аминокислоты цистеина.
R—СН = О + Н —SR <=> R—СН – ОН
АN |
SR
тиополуацеталь
Образование тиополуацеталей in vivo необходимо в процессе реакций биологического окисления.( см. раздел «реакции окисления биоорганических соединений).
