Цепь переноса электронов и протонов внутренней мембраны
Митохондрий (дыхательная цепь, редокс-цепь). Компоненты
Дыхательной цепи: флавопротеины, железосерные белки, коэнзим Q, цитохромы в, с1, с, аа3. Топография дыхательных переносчиков
В редокс-цепи
Последовательность реакций, связанных с переносом водорода на кислород при участии специфических переносчиков электронов, называется дыхательной (или электронтранспортной) цепью. У животных и человека она составлена из четырех основных типов переносчиков, каждый из которых способен претерпевать обратимое окисление и восстановление в результате потери и присоединения электронов при взаимодействии с другим переносчиком.
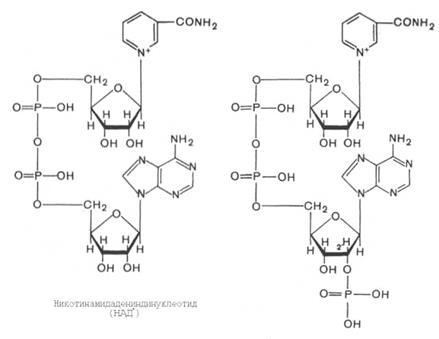
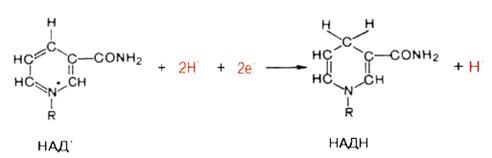
Первый тип переносчиков электронов в дыхательной цепи представлен никотинамидными коферментами – NAD+ и NADP+. Они способны активировать водород, отщепляемый от различных органических субстратов, действуя в составе дегидрогеназного окислительно-восстановительного ферментного комплекса. Коферменты NAD+ и NADP+ способны связываться с различными носителями, и каждый такой комплекс служит специфическим катализатором только в одной определенной реакции. Специфичность связывания коферментов NAD+ и NADP+ с ферментными белками зависит от аденин-нуклеотидной части их молекул, в то время как никотинамидная часть молекул этих коферментов придает им уникальное свойство действовать в качестве переносчиков электронов и протонов. В реакциях дегидрирования два атома водорода отщепляются от молекулы субстрата. Один атом водорода и один электрон переносятся на никотинамидное кольцо с образованием восстановленной формы коферментов NAD+ и NADP+ (NADН и NADPН), а другой атом водорода, потерявший электрон [Н+], освобождается в окружающую среду.
Дегидрогеназные реакции с участием коферментов NAD+ и NADP+ имеют ряд уникальных свойств, которые обуславливают их ключевую роль в процессах биологического окисления. Первая особенность – легкая обратимость при небольших изменениях свободной энергии, что позволяет коферментам участвовать как в окислении субстрата, так и в восстановлении продуктов реакции (в зависимости от потребностей клетки). Вторая особенность заключается в способности этих коферментов (как в окисленной, так и в восстановленной форме) легко отделяться от белка-носителя, в их высокой подвижности, что облегчает обмен атомами водорода и электронами между различными дегидрогеназными системами, расположенными в разных частях клетки. Коферменты NAD+ и NADP+ способны акцептировать водород от большого числа субстратов, окислительно-восстановительный потенциал которых ниже -0,3 В. К числу таких субстратов относятся продукты расщепления углеводов, жиров и различных аминокислот.
|
|
|
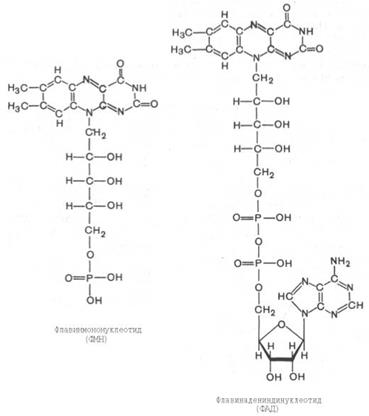
Второй тип переносчиков электронов, действующих в дыхательной цепи, ‒ это флавиновые коферменты: флавинмононуклеотид (FMN) и флавинадениндинуклеотид (FAD). В составе специфических дегидрогеназ (флавиновых ферментов или флавопротеинов) они выполняют роль простетической группы, участвующей в переносе электронов. Активной частью молекулы FAD или FMN служит изоаллоксазиновое кольцо рибофлавина, к атомам азота которого могут присоединяться два атома водорода за счет внутримолекулярной перегруппировки двойных связей:
|
|
FMN и FAD прочно связаны с соответствующими дегидрогеназными белками и не могут свободно переносить восстановительные эквиваленты путем диффузии к другим дегидрогеназным системам. Реакции, катализируемые флавинзависимыми дегидрогеназами, труднообратимы, и, следовательно, флавиновые коферменты не могут служить источником водородных эквивалентов в процессах восстановительного биосинтеза.
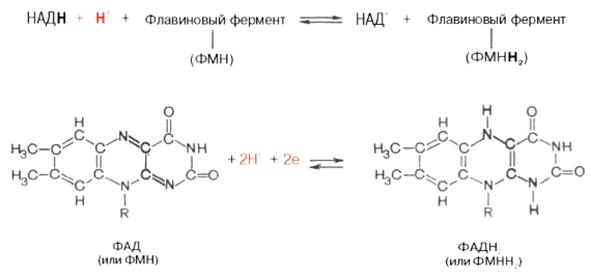
В соответствии с относительно низкими окислительно-восстановительными потенциалами (около ‒0,1 В) флавопротеины могут акцептировать водород от NADH. При окислении янтарной кислоты, α-глицерофосфата и СоА-производных жирных кислот флавинзависимые ферменты могут играть роль первичных дегидрогеназ и непосредственно принимать электроны и протоны от окисляемых субстратов без участия NAD и связанных с ним дегидрогеназ:
|
|
|
Третий тип переносчиков электронов в дыхательной цепи представлен бензохиноновым соединением, носящим название кофермента Q, или убихинона. При восстановлении он присоединяет два электрона и два протона, образуя гидрохиноновую форму CoQH2. Система CoQ/CoQH2 имеет величину Ео, лишь немногим более положительную, чем у флавопротеинов, которые поэтому могут передать свои восстанавливающие эквиваленты на хинон:
FPН2 + СoQ → FP + СoQН2 .
СoQ способен принимать водород от различных флавопротеинов. Система СoQ представляет собой узловой пункт, куда стекается водород, поступающий в дыхательную цепь от самых различных субстратов. Поэтому СoQ в дыхательной цепи представлен в более высоких концентрациях, чем большинство других переносчиков электронов. Хорошая растворимость в липидной фазе мембранных образований и относительно небольшой молекулярный вес придают СoQ свойство подвижного переносчика, взаимодействующего с фиксированными электронпереносящими белками.
Четвертый тип переносчиков электронов в дыхательной цепи от СoQ на кислород представлен группой различных гемсодержащих белков (гемопротеинов), называемых цитохромами. Отличаясь друг от друга структурой белкового компонента, все они имеют простетическую геминовую группу, по строению близкую к гему гемоглобина. В центре порфиринового кольца каждого гема находится ион железа. Гем цитохрома а отличается от простетических групп цитохромов b и c наличием формильного остатка, замещающего метильную группу. Цитохромы переносят электроны последовательно от СoQ на конечный акцептор – кислород. На участке NADH и СoQ осуществляется двухэлектронный перенос, цитохромы переносят по одному электрону. При этом происходит обратимое окисление-восстановление атома железа простетической группы, переходящего из Fe2+ в Fe3+. Следовательно, на данном участке цепи должны действовать две молекулы цитохромов.
|
|
В соответствии с величиной окислительно-восстановительного потенциала у разных цитохромов, они располагаются в определенной последовательности в дыхательной цепи между CoQ и кислородом (здесь и далее цит. – цитохром):
цит.b → цит.с1 → цит.с → цит.а → цит.а3 → О2
+70 мВ +212 мВ +210 мВ +210 мВ +385 +820 мВ
Первой реакцией на этом участке является перенос электронов от CоQН2 на цитохром b, имеющий наиболее низкую величину Е`0.
CoQH2 + 2Fe3+ - цит.b → CoQ + Fe2+ - цит.b + 2H+
В этой реакции для акцептирования двух электронов от восстановленного CoQ требуется 2 моля цитохрома b и два протона, которые могут быть перенесены через систему цитохромов и освобождены в окружающую среду. Окислительно-восстановительные пары CoQ/CoQH2 и Fe2+- цит. b, Fe3+- цит.b имеет близкие значения величины Е′0, и эти реакции происходят при небольших изменениях энергии. Восстановленная форма цит.b имеют меньшую величину Е′0, что позволяет ей действовать в качестве восстановителя для следующих переносчиков в дыхательной цепи, а именно цитохрома с:
2Fe2+ - цит.b + 2Fe3+ - цит.с → 2Fe3+ - цит.b + Fe2+ - цит.с
Цитохром с1, близкий по величине Е′0 к цитохрому с, участвует в этой реакции в качестве промежуточного переносчика электрона между цитохромами b и с. Завершающей является реакция, катализируемая ферментом цитохромоксидазой – сложным гемопротеином, состоящим из 7 полипептидных цепей, двух различных гемов (цитохромы а и а3), и двух атомов меди, принимающих участие в транспорте электронов:
_
Cu2+ + e → Cu+
Первый из цитохромов на этом участке – цитохром а – реагирует с цитохромом с, принимает электроны и переносит их на цитохром а3, который способен прямо взаимодействовать с кислородом как конечным акцептором электронов:
2Fe2+ - цит. а3 + 2Н+ + ½ О2 → 2Fe3+ - цит. а3 + Н2О
«Активный» кислород присоединяет два протона из окружающей среды, образуя воду. В этой реакции кислород, как наиболее сильный окислитель, акцептируя электроны, создает основную движущую силу для переноса электронов вдоль дыхательной цепи, в результате чего все выше расположенные переносчики поддерживаются в окисленном состоянии и оказываются способными принимать водород и электроны, поставляемые от окисляемых субстратов.
В транспорте электронов принимают участие белки (ферредоксины), содержащие негемовое железо, в молекуле которых железо связывается с белком-носителем через атом серы.
Отличительная особенность FeS-белков – строение их активного центра, содержащего негемовое железо, связанное нековалентными связями с кислотолабильной серой и серой, входящей в состав цистеиновых остатков пептидной цепи. Разные типы железосероцентров (FeS-центры) широко распространены в клетках. Простейший из них содержит один атом железа, нековалентно связанного в молекуле белка и получившего название рубредоксина, с четырьмя остатками цистеина (рис.26.2).
Рубредоксин имеет окислительно-восстановительный потенциал около -57 мВ и участвует в реакциях одноэлектронного переноса. Остальные FeS-белки имеют более сложноорганизованные FeS-центры, в состав которых входит неорганическая кислотолабильная сера. Известны Fe2S2-центры (содержат по два атома железа и неорганической серы), Fe3S3- и Fe4S4-центры. FeS-белки могут содержать один или более центров в молекуле. В зависимости от особенностей строения FeS-центров ферредоксины могут одновременно переносить один или два электрона. Окислительно-восстановительный потенциал ферредоксинов находится в диапазоне от -490 до -310 мВ.
|
|
|
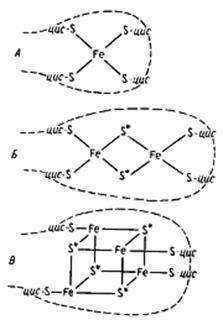
Рис.26.2. Железосерные центры FeS-белков. А ‒ железосерный центр рубредоксина; б – железосерный центр Fe2S2-типа; в – железосерный центр Fe4S4-типа
Все компоненты дыхательной цепи локализуются на внутренней мембране митохондрий и включены в состав белковых комплексов. Активные центры NADH-дегидрогеназы и сукцинатдегидрогеназы находятся на мембране, со стороны матрикса, как и центр для О2 на цитохроме а3. Цитохром с находится на наружной стороне мембраны, убихинон – в липидной фазе мембраны. Комплекс F1-F0 расположен на внутренней стороне мембраны и ориентирован внутрь матрикса (рис.26.3).
